Par Jean-Baptiste Castagnet
Les Scoliidae, plus communément appelées en français « scolies », forment une petite famille d’Hyménoptères Aculéates. Près de 560 espèces sont connues dans le monde, réparties dans une quarantaine de genres et deux sous-familles (Osten 2005). Dans les classifications modernes, les Scoliidae sont placées au sein de la superfamille des Vespoidea.
Le mot « Scolia » vient du grec « σκολιός », qui veut dire courbé, oblique, tortueux. Cela se réfère peut-être à la posture particulièrement incurvée de ces guêpes, bien évidentelorsque ces guêpes butinent.
Ce sont des insectes de taille moyenne ou grande, souvent de couleur noire avec des bandes ou des taches jaunes ou rougeâtre, leur corps est généralement assez velu. On les distingue des autres familles d’Aculéates par la présence d’une large plaque métasternale entre les coxae postérieurs (hanche en latin, base de la patte chez les arthropodes), le propodeum (premier article de l’abdomen des Apocrites) subdivisé en trois parties et l’aile antérieure dont l’extrémité, dénuée de nervures, est densément ridée en long.
Les Scoliidae présentent des mœurs solitaires et fouisseusses. Leurs larves sont ectoparasites de larves de Coléoptères de la super-famille des Scarabaeoidea.
Cette famille est nettement plus représentée dans les zones tropicales et subtropicales que dans les régions tempérées (figure 1). A titre d’exemple on rencontre 79 espèces appartenant à 13 genres en Inde (Gupta & Jonathan, 2003) contre seulement 8 espèces réparties dans 3 genres en France. Sous nos latitudes, c’est en région méditerranéenne que la diversité sera la plus élevée.

Classification des Scoliidae
Les Scoliidae sont scindées en deux sous-familles : les Proscoliinae Rasnitsyn, 1977 et les Scoliinae (Day et al.1981).
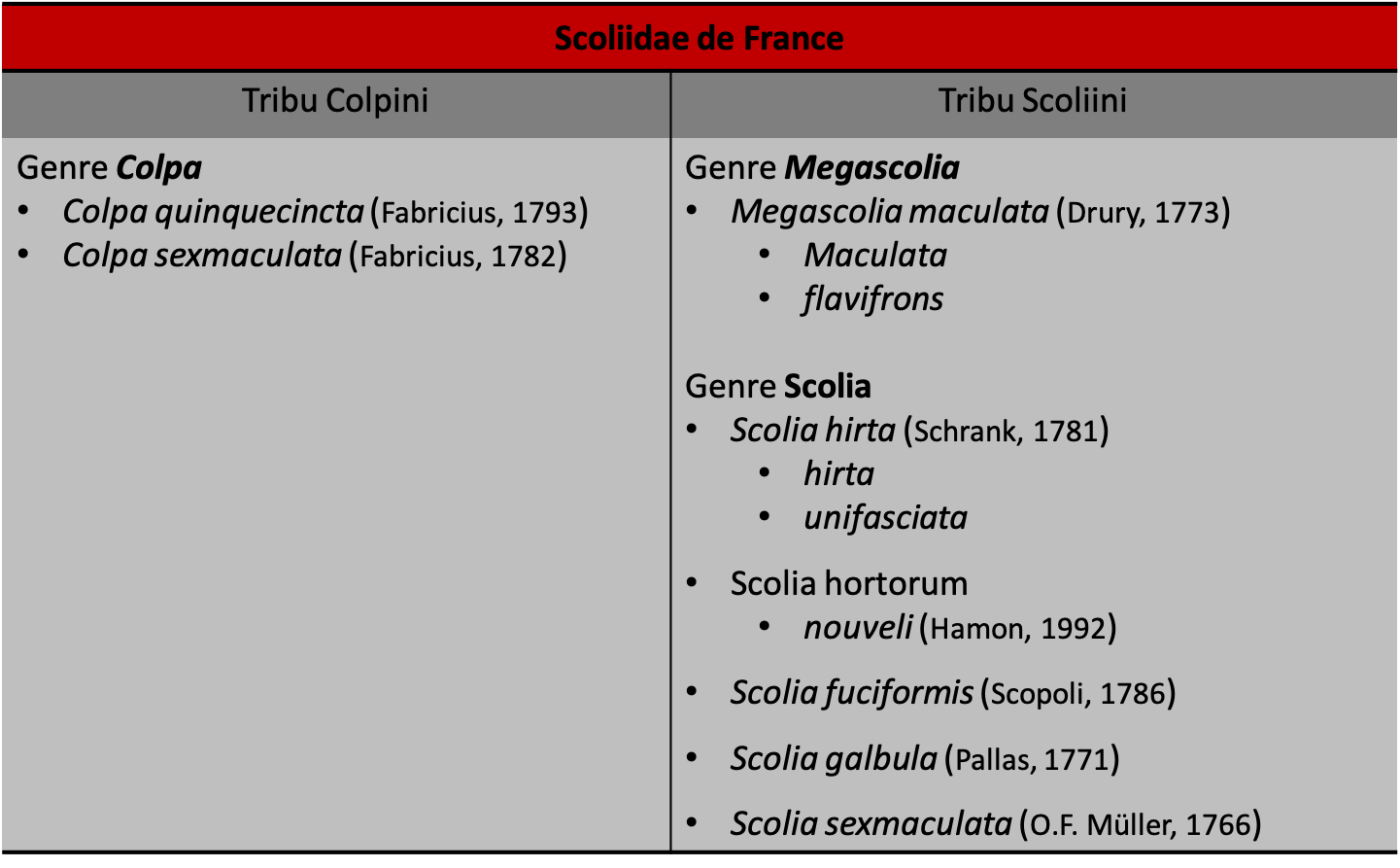
Les Proscoliinae, ne contenant qu’un genre : Proscolia et deux espèces (Osten & Arens, 2004), sont généralement considérés comme formant un groupe primitif placé à la base des Scoliidae. On admet généralement que les Scoliinae sont subdivisées en deux tribus, les Campsomerini et les Scoliini, se distinguant principalement par la nervation des ailes antérieures (figure 2).
Argaman (1996) propose une classification mondiale beaucoup plus complexe qui comprend 28 tribus et 143 genres différents : ce travail qui n’était qu’une ébauche, n’a pas été retenu par les auteurs ultérieurs, et il n’est malheureusement pas utilisable en l’état car de nombreux paragraphes traitent exclusivement d’un seul sexe et la création d’un grand nombre de genre et tribus repose sur des critères spécifiques et non génériques ou de coloration. Cependant, certaines propositions d’Argaman sont fondées, notamment d’ériger la sous-famille des Colpinae (selon la classification actuelle) comme une tribu : Colpini.

Les scolies de France
En France métropolitaine, il est possible d’observer 8 espèces, 10 taxa et 3 genres. Seulement deux des trois tribus sont représentées : les Scoliini et les Colpini (figure 3).
Les scolies présentent un dimorphisme sexuel net. Les femelles sont généralement plus grandes, massives, les antennes sont constituées de douze articles et le gastre (abdomen des insectes, il commence au 2ème segment abdominal chez les Apocrites) de six tergites visibles Chez les Scoliidae, le gastre (ou metasoma) correspond en effet à l’abdomen moins le propodeum (1er segment abdominal incorporé au thorax proprement dit). Le segment abdominal 1 du gastre est en réalité le segment 2 de l’abdomen. Au contraire, les mâles paraissent plus petits, élancés, les antennes sont constituées de treize articles et le gastre de sept tergites visibles, son extrémité portant trois pointes aiguës formant un trident.
Contenant deux espèces, le genre Colpa est commun le long des côtes et sur les dunes, plus rare dans les terres. Ces scolies se distinguent facilement des autres scolies françaises par la présence de deux cellules discoïdales sur l’aile antérieure. Les femelles de Colpa sexmaculata sont largement marquées de taches jaunes, contrairement aux femelles de Colpa quinquecincta qui sont généralement entièrement noires (figure 4).

Le genre Megascolia ne contient qu’une espèce Megascolia maculata, sans aucun doute la plus connue des Scoliidae car elle est généralement présentée avant tout comme l’un des plus gros Hyménoptères d’Europe (figure 5). Observable dans le Midi de la France, principalement en région méditerranéenne et sur la côte atlantique (Landes et Gironde), ce genre se distingue facilement des autres scolies de France par sa grande taille et par la présence de trois cellules submarginales et d’une cellule discoïdale sur l’aile antérieure.

On rencontre deux sous-espèces en France : M. m. maculata (Aquitaine) présentant des soies rousses sur le pronotum et l’extrémité du gastre et M. m. flavifrons (région méditerranéenne) avec une pilosité généralement entièrement noire. Le statut et la validité de ces deux sous-espèces ne sont pas encore définis, et seule la coloration de la pilosité permet de les distinguer (cependant certains individus aberrants de Méditerranée présentent une pilosité rousse similaire à la sous-espèce aquitaine). Une étude génétique à grande échelle (toute l’aire de répartition) est en cours afin de clarifier le statut des différentes sous-espèces de Megascolia maculata réalisée par Joan Diaz Calafat, Jakovos Demetriou, Dimitrios Avtzis et moi-même.
Le genre Scolia contient cinq espèces. Il se distingue des autres scolies de France par la présence de deux cellules submarginales et d’une cellule discoïdale sur l’aile antérieure. La plus commune est Scolia hirta, qui se rencontre dans presque tout l’hexagone. Cette espèce est de taille moyenne, le tégument et la pilosité sont noirs avec généralement des bandes jaunes sur le second et le troisième segment du gastre. La coloration étant variable, elle peut être confondue avec les autres espèces de Scolia en région méditerranéenne.
Problématique liée aux Scoliidae
Malgré leur taille souvent spectaculaire, leurs caractères remarquables, les différences externes entre les représentants de la famille des Scoliidae restent peu nombreuses. Cela est en partie dû à la fois à une grande homogénéité morphologique au sein des genres ou groupes d’espèces, et à grande variabilité au sein d’une même espèce, variabilité qui porte notamment sur l’étendue des motifs colorés.
Comme chez la plupart des parasites et parasitoïdes (lien), la formation des imagos dépend de l’état et la taille des hôtes, ce qui peut entrainer des phénomènes de nanisme (hypotrophie) ou de gigantisme (hypertrophie). De plus, les conditions environnementales (température notamment) au cours du développement larvaire semblent pouvoir influencer la coloration de ces insectes.
En résulte une certaine confusion régnant sur la taxonomie et la nomenclature des Scoliidae, accentuée par le fait que les espèces ont souvent été décrites non pas sur des critères morphologiques, mais plutôt sur des caractères de coloration du corps ou de la pilosité qui sont variables. En outre, les divers spécialistes ont parfois publié des analyses contradictoires et ont été conduits à modifier leurs conclusions à plusieurs reprises.
Tout comme la coloration, un critère fréquemment utilisé : « nombre de cellules submarginales », très pratique pour faire un premier tri, une première identification, est à prendre avec circonspection car le nombre de cellules est parfois variable (notamment pour les genres Colpa et Megascolia) (figure 6).
A l’heure du 2.0, où l’on voit fleurir un ensemble de groupe sur les réseaux sociaux visant à identifier les insectes sur de simples photographies et où chacun peut émettre son opinion, il n’est pas rare de voir des identifications de Scoliidae erronées. La variabilité intraspécifique restant encore trop sous-estimée, il est risqué, voire très hasardeux, de se prononcer sur les scolies sur la base de photographies : les Scoliidae (à de rares exceptions près) doivent être examinées sous la loupe binoculaire pour une identification sûre.
Biologie
Les imagos émergent généralement en fin de printemps et au début de l’été. Les mâles éclosent avant les femelles et volent ensuite à une faible distance au-dessus du sol, réalisant des vols prénuptiaux rapides plus ou moins en forme de huit en attendant l’émergence des femelles. Après l’accouplement, la femelle se met à la recherche de proies. Le cycle de développement larvaire est court, mais sous nos latitudes, la larve ne se nymphose qu’après une période d’hibernation passée dans un cocon. Nos espèces sont donc probablement monovoltines.
Les membres de cette famille sont ectoparasitoïdes principalement de larves de Coléoptères Scarabaeoidea vivant dans le sol. Cependant, il semble que certaines espèces (notamment les Microscolia) parasiteraient les larves de Coléoptères vivants dans le bois en décomposition. Les espèces du genre Microscolia ont une tête généralement hypertrophiée comparées aux autres membres de la famille des Scoliidae : l’hypothèse généralement admise serait que cela leur permettrait de creuser plus facilement le bois mort. On peut également noter comme proies certaines larves de Curculionidae (Clausen,1940).
Les femelles recherchent des larves de Scarabaeoidea au sein des milieux de développement de ces dernières. Une fois la larve détectée, la scolie la paralyse par une piqûre, pond et fixe un œuf sur la face ventrale de l’abdomen de cette larve (Fabre, 1891). L’observation de ce processus étant malaisée, les préférences trophiques et le spectre d’hôte des Scoliidae demeurent encore mal connus. Vereecken & Carriere (2003) ont cependant rapporté le comportement détaillé de Megascolia maculata flavifrons en présence de sa proie, une larve d’Oryctes nasicornis (figure 7).

Les adultes butinent les fleurs le jour, par temps chaud, avec une préférence pour les fleurs bleues (et notamment les Eryngium) (figure 5). Ils passent généralement la nuit enfouis à une faible profondeur au-dessous de la surface du sol, mais également pendant les heures fraîches de la journée. Les mâles peuvent parfois se regrouper à l’extrémité de tiges, maintenus par leurs mandibules pour passer la nuit (notamment les mâles de Colpa sexmaculata) ; le même comportement a été observé chez les abeilles solitaires. Lors des fortes chaleurs les scolies restent clouées au sol, le plus souvent à l’ombre en attendant que la température redescende (observation faîte en Crète sur Colpa sexmaculata, sous un soleil de plomb et 46°C).
Intérêt en lutte biologique
Du fait de la nature des proies parasitées, les Scoliidae pourraient constituer d’intéressantes auxiliaires dans la lutte biologique des larves qualifiées de « vers-blanc » parfois considérées comme « pestes » pour les activités humaines.
A ce titre, quelques espèces ont été importées et libérées en masse dans certaines régions, tel que l’Australie, les Philippines, les îles du Pacifique ou les Etats-Unis d’Amérique afin de réguler la prolifération de scarabéides.
Néanmoins, rares sont les introductions couronnées de succès. En effet, Krombein (1948) rapporte l’introduction de plus de 4 000 (♀ et ♂) de Campsomeriella annulata et plus de 11 000 (♀ et ♂) de Micromeriella marginella, relâchées au cours des années 1920 afin de lutter contre le Scarabée japonais (Popillia japonica) aux États-Unis (figure 8). Bien que ces espèces aient montré la capacité de paralyser les larves de ces scarabées en condition expérimentale, ces introductions se sont avérées infructueuses et ces deux scolies ne se sont pas établies dans le pays (Krombein, 1948 et Fleming, 1968).

Un certain nombre d’espèces ont également été introduit dans les îles du Pacifique afin de contrôler le Scarabée rhinocéros (Oryctes rhinoceros), un « ravageur » des cocotiers, mais la plupart d’entre elles ne semblent pas s’être établies probablement par l’incapacité à s’adapter notamment à l’environnement tropical du Pacifique (Swan 1974). Parmi les nombreuses espèces de scolies introduites, seule S. ruficornis s’est établie avec succès (Swan 1974, Waterhouse et Norris 1987, Gerlach 2003). L’impact de ces guêpes est toutefois limité car elles ne peuvent pénétrer dans les troncs frais, qui sont des sites de reproduction majoritaires. Leurs activités restent limitées aux sites de reproduction contenant des matériaux friables, tels que les tas de sciure, le compost et les rondins en décomposition (Catley 1969, Paudel et al., 2021).
Etat des populations françaises
Il n’y a pas d’études sur l’état des populations des Scoliidae en France, les observations et hypothèses détaillées ci-après n’ont pas encore fait l’objet d’études. Néanmoins, l’examen d’un grand nombre de collections de Scoliidae récoltées pré- et post-2000 semble indiquer une nette diminution de l’abondance des populations.

Un exemple flagrant et attristant reste pour moi un spot sauvage (zone de garrigue à thym) dans les Corbières que je prospecte depuis presque 10 ans. Ce paradis de la scolie, où l’on trouvait en abondance Scolia hortorum nouveli, a aujourd’hui été presque entièrement rasé pour la construction d’une banlieue. Scolia hortorum y est maintenant rare, presque inexistante (figure 9).
Concernant cette diminution d’abondance constatée, sont très probablement en cause : la régression et la disparition des habitats (les espèces inféodées aux milieux dunaires semblent sensibles à la bétonisation galopante des côtes) et les nombreux pesticides abondamment utilisés. Il semble également que la raréfaction et la disparition de leurs proies constituent des causes de la modification de distribution des espèces de Scoliidae (Carriere 1990). Mais, comme pour de nombreux autres insectes, la cause de la raréfaction des Scoliidae est sans doute multifactorielle.
L’auteur Je m’appelle Jean-Baptiste CASTAGNET, je suis diplômé d’un master en Ecologie de l’Université Paul Sabatier. Du plus loin que je me souvienne, j’ai toujours été passionné par les insectes. Enfant, je dévorais les livres d’entomologie, je m’extasiais devant la beauté de ces petites bêtes. Très tôt, j’ai lu les « Souvenirs entomologiques » de Jean-Henri Fabre et ces lectures ont développé mon goût pour les Hyménoptères Aculéates et plus particulièrement les Scoliidae. Plus tard lors de mes études universitaires une rencontre a fait basculer mon destin d’entomologiste : Jacques et Colette Bitsch, qui m’ont accompagné et introduit dans le petit monde des entomologistes. Sans leur aide et leur soutien, je ne pratiquerais probablement pas l’entomologie tel que je le fais aujourd’hui. Jacques est entomologiste, éminent spécialiste des Hyménoptères Sphéciformes : Colette également entomologiste est chargée de recherche honoraire au CNRS. J’ai déjà un temps réussi à faire de ma passion, l’entomologie, mon métier, et je ne perds pas espoir de remettre à nouveau un pied professionnel dans le monde de l’entomologie. Je passe aujourd’hui le plus clair de mon temps libre à étudier les Scoliidae du monde, et je pense que je n’aurai pas assez d’une vie pour tout voir ! Je m’intéresse particulièrement à la systématique et la taxonomie de cette famille. Je travaille actuellement sur la faune de l’ouest Paléarctique des Scoliidae, sur une révision du genre Megascolia, également sur les Scoliidae néotropicales et les Scoliidae des Philippines. Et à ce titre, je serai extrêmement reconnaissant à toute personne ayant et pouvant me fournir du matériel provenant des régions suivantes : Holarctique, Néotropicale, Indomalaise et Australasienne. |
Bibliographie
- Argaman Q., 1996. – Generic synopsis of Scoliidae (Hymenoptera, Scolioidea). Annales Historico-Naturales Musei Nationalis Hungarici, 88: 171-222 (lien)
- Carriere J., 1990. – Quelques notes éthologiques sur Megascolia flavifrons (Fabricius, 1775) en Languedoc (Hymenoptera, Scoliidae). Bulletin sciences naturelles, 65: 16-18
- Catley A., 1969. – The coconut rhinoceros beetle Oryctes rhinoceros (L.) [Coleoptera: Scarabaeidae: Dynastinae]. Pest Articles & News Summaries, 15 (1): 18-30 (lien)
- Clausen C. P., 1940. – Entomophagous insects. McGraw-Hill Publ. in the Zoological Sciences, 1-688
- Day M. C., Else G. R., Morgan D., 1981 – The most primitive Scoliidae (Hymenoptera). Journal of Natural History, 15: 671-684 (lien)
- Fabre J. H., 1891. – Souvenirs entomologiques (quatrième série). Delagrave, Paris, 1-328
- Fleming W. E., 1968. – Biological control of the Japanese beetle. U.S. Department of Agriculture Technical Bulletin, 1383: 1-78
- Gerlach J., 2003. – The presence of Scolia ruficornis in Seychelles (Scoliidae: Hymenoptera). University Museum of Zoology Cambridge, Cambridge, U.K., 76-77 (lien)
- Gupta S. K. & Jonathan J. K., 2003. – Fauna of India and the adjacent countries, Hymenoptera: Scoliidae. Zoological Survey of India, Kolkata, 1-277
- Krombein K. V. 1948. – Liberation of oriental scolioid wasps in the United States from 1920 to 1946. Annals of the Entomological Society of America, 41: 57-62 (lien)
- Osten T., 2005. – Checkliste der Dolchwespen der Welt (Insecta: Hymenoptera, Scoliidae). Bericht der naturforschenden Gesellschaft Augsburg, 62: 1-62
- Osten T., Arens W., 2004. – Beitrag zur Kenntnis der Scoliiden – Fauna Griechenlands (ohne Zypern) (Hymenoptera, Scoliidae). Entomofauna 25 (20): 305-320
- Paudel S., Mansfield S., Villamizar L., Jackson T., Marshall S., 2021. – Can Biological Control Overcome the threat from newly invasive coconut rhinoceros beetle populations (Coleoptera: Scarabaeidae. Annals of the Entomological Society of America, 114 (2): 247–256 (lien)
- Swan D. I., 1974. – A review of the work on predators, parasites and pathogens for the control of Oryctes rhinoceros (L.) (Coleoptera: Scarabaeidae) in the Pacific area. Commonwealth Institute of Biological Control, Pago Pago, American Samoa, 1-36 (lien)
- Vereecken N., Carriere J., 2003. – Contribution à l’étude éthologique de la grande Scolie à front jaune Megascolia maculata flavifrons (F., 1775) (Hymenoptera, Scoliidae) en France méditerranéenne. Notes fauniques de Gembloux, 53: 71-80 (lien)
- Waterhouse D., Norris K., 1987. – Biological control : Pacific prospects. Melbourne (Inkata Press), VIII + 1-454






Bonjour,
Il me semble que pour la liste des espèces de France, vous avez oublié Dasyscolia ciliata, observée sur les iles Lavezzi en Corse (Cocquempot & Hamon (1995)) –> https://www.persee.fr/doc/bsef_0037-928x_1995_num_100_3_17155