Par Laure Kaiser-Arnauld & Taiadjana Fortuna
Cotesia typhae Fernandez-Triana (Braconidae) est un Hyménoptère d’Afrique sub-saharienne, parasitoïde des chenilles de Sesamia nonagrioides Lefebvre (Lepidoptera, Noctuidae). Ces chenilles mangent l’intérieur des tiges de nombreuses espèces de plantes du groupe des Poales. Originaire d’Afrique, ce papillon ravage le maïs dans les pays du Sud de l’Europe, dont la France.
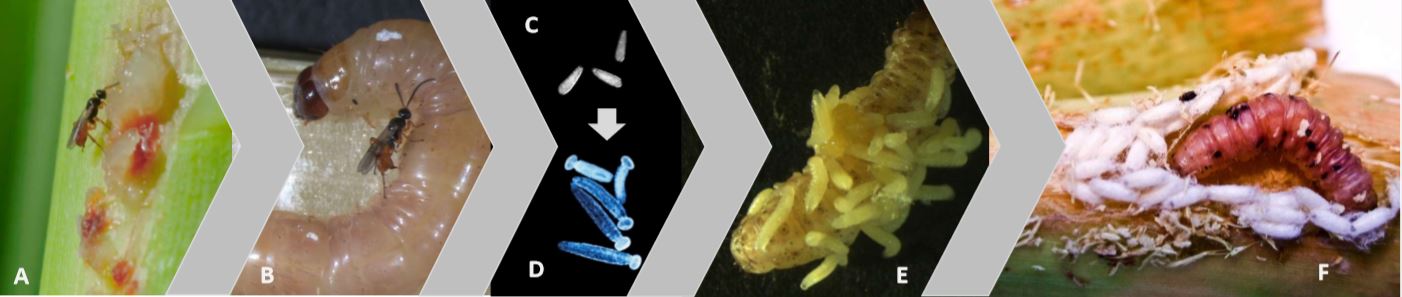
Les adultes de C. typhae ressemblent à de très petites guêpes de 2,5 mm de long, à la tête et au thorax marron et à l’abdomen majoritairement jaune, ne vivant que quelques jours (Kaiser et al. 2017). Grégaires, les adultes s’accouplent dès l’émergence. Les femelles partent alors à la recherche d’une chenille de S. nonagrioides pour y pondre. Elles détectent les plantes infestées à l’aide de récepteurs situés sur leurs antennes sensibles aux déjections se trouvant à l’entrée de la galerie creusée par la chenille.
La guêpe parasitoïde pénètre alors dans la galerie et, au premier contact avec la chenille, elle lui injecte avec son dard ou ovipositeur plusieurs dizaines d’œufs. Elle injecte en même temps des fluides (venin, protéines ovariennes, particules virales symbiontes) qui permettront d’une part que les œufs ne soient pas détruits par le système immunitaire de la chenille, et d’autre part que le développement de la chenille s’adapte à celui des larves parasites internes. Deux semaines plus tard (à 25°C), les larves au terme de leur développement sortent du corps de la chenille en perforant sa cuticule, et tissent chacune un cocon de nymphose, dont émergera l’adulte une semaine après (à 25°C) (figure 1).
La lutte biologique met à contribution les ennemis naturels d’espèces dans le but de limiter leur propagation quand elles sont nuisibles.
De nombreux insectes sont utilisés en tant que prédateurs ou parasites des ravageurs de culture. Quand un ravageur arrive d’ailleurs et devient invasif, il est classique d’aller chercher dans sa région d’origine des espèces de son cortège d’ennemis naturels dans le but d’en introduire dans la région envahie les plus aptes à s’y acclimater. Dans la plupart des cas, les insectes agents de lutte biologique ont un spectre d’action plus restreint que celui des insecticides.
Toutefois, depuis 2012, un décret impose d’estimer les risques environnementaux que pourrait poser l’introduction sur le territoire français d’espèces de macro-organismes utiles à la protection des plantes.
Plus généralement, la pratique de la lutte biologique se veut respectueuse de l’environnement et les études de gammes d’hôtes sont faites pour estimer l’intérêt d’ennemis naturels en lutte biologique, autant pour leur efficacité envers des insectes cibles que pour leur innocuité envers l’environnement.
Quête d’un candidat idéal
C’est dans cet esprit qu’a été réalisé un vaste recensement de Cotesia sesamiae Cameron, petit Hyménoptère d’Afrique sub-saharienne qui pond à l’intérieur de chenilles se nourrissant de plantes sauvages et cultivées du groupe des Poales (plantes herbacées monocotylédones regroupant les Poaceae – anciennement graminées -, et trois familles de plantes hygrophyles : Cyperaceae, Typhaceae et Joncaceae). En effet des études en champ de maïs au Kenya avaient montré qu’il existait au sein de l’espèce parasitoïde des populations locales qui ne se développaient par sur les mêmes espèces de chenilles hôtes.

Cette différenciation écologique et génétique des populations de C. sesamiae justifiait d’échantillonner l’espèce sur toute son aire de répartition, et d’identifier son spectre d’hôtes en explorant les plantes sauvages. Le taux naturel de chenilles parasitées par C. sesamiae étant faible en milieu sauvage, il a fallu collecter plus de 10 000 chenilles pour récupérer environ deux cent échantillons du parasitoïde. Ceux-ci ont été obtenus à partir d’une vingtaine d’espèces de chenilles sur autant d’espèces de plantes.
Des analyses génétiques ont révélé plusieurs populations dont la différenciation résulte d’un ensemble de facteurs, le plus influençant étant la préférence pour une espèce hôte donnée, puis l’infection par une bactérie endocellulaire, Wolbachia, entraînant des incompatibilités de croisements, et enfin la distance géographique (Branca et al., 2019). Parmi ces populations, l’une, retrouvées dans trois pays d’Afrique de l’Est (Ethiopie, Kenya, Tanzanie) se distinguait par un spectre d’hôtes réduit à une seule espèce, la noctuelle Sesamia nonagrioides, sur presque exclusivement une seule plante, la massette, Typha.
Cette noctuelle étant un ravageur du maïs en Europe et dans quelques pays du Moyen-Orient et d’Afrique de l’Ouest, une population de Cotesia sesamiae la parasitant exclusivement pourrait être un agent de lutte biologique intéressant. Mais quelle fiabilité pouvait-on accorder au caractère spécialiste mis en évidence ?
Un processus souvent négligé dans les études d’espèces pour la lutte biologique est la possibilité que leur spectre d’hôte évolue. La spécificité parasitaire ayant un déterminisme génétique, son évolution devrait dépendre des échanges de gènes entre populations parasitant différentes espèces hôtes. Nous voulions savoir si la stricte spécificité pour Sesamia nonagrioides constituait un caractère stable de la population de son parasitoïde (figure 2).
Une méthode pour estimer le flux de gènes est de caractériser la distance génétique entre échantillons, en analysant la différenciation de plusieurs segments d’ADN appelés marqueurs moléculaires (lien). Une des approches utilisée est la phylogénie moléculaire. Avec des collègues de l’Institut de Recherche sur la Biologie de l’Insecte (IRBI) de l’Université de Tours, nous l’avons appliquée à des représentants des populations de Cotesia sesamiae en Afrique sub-saharienne. Deux analyses indépendantes, basées sur différents types de marqueurs ont montré que la population spécialisée sur S. nonagrioides formait une lignée distincte, indiquant une absence de flux de gènes avec les autres lignées (figure 3) (Gauthier et al., 2018 ; Kaiser et al., 2015) (lien).
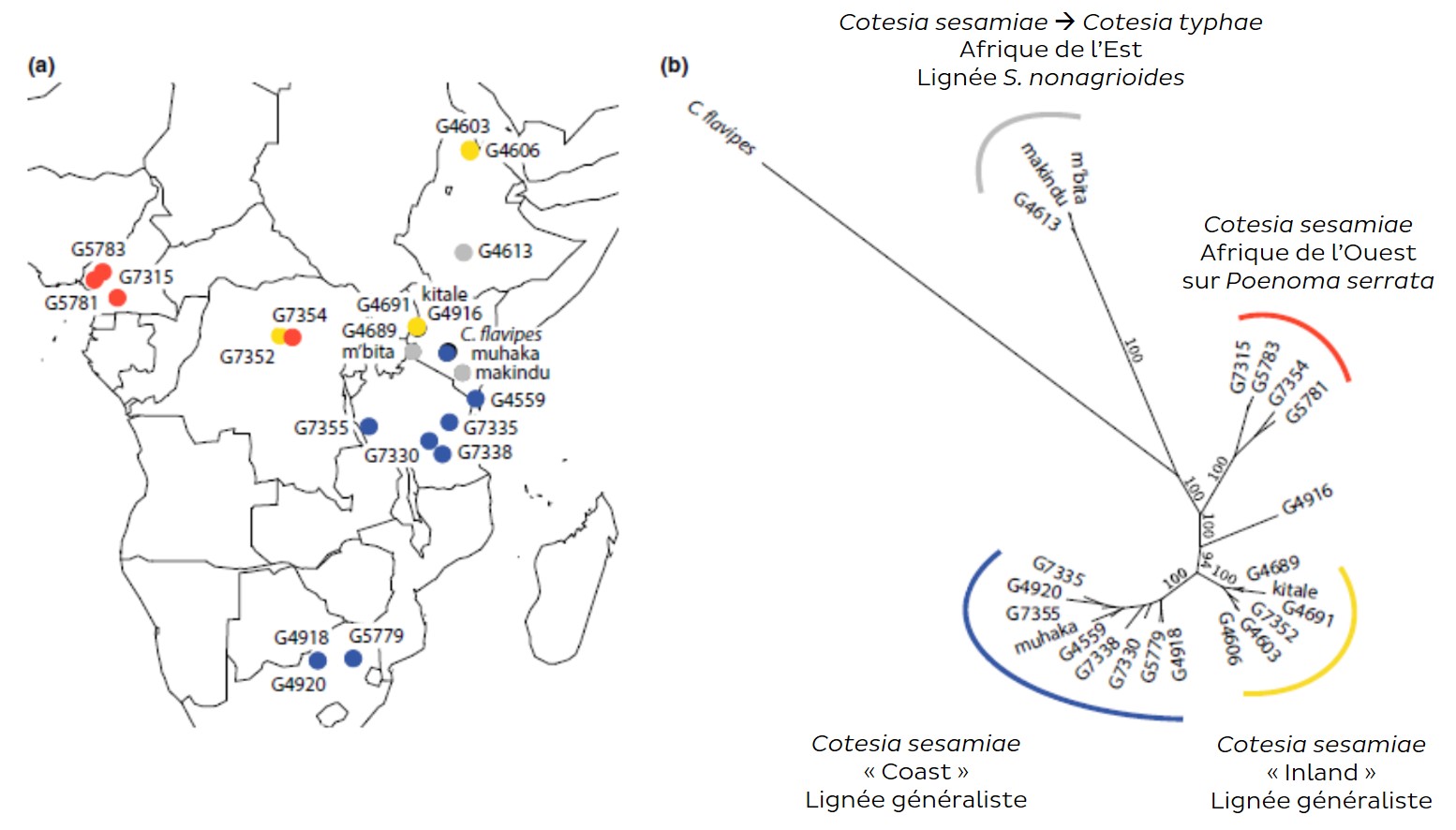
En biologie évolutive, l’isolement reproducteur entre populations peut conduire à la formation d’espèces distinctes. Cette population présentait des critères d’espèce à part entière : elle était la plus éloignée génétiquement des autres populations de C. sesamiae, et ne partageait pas la même niche écologique car les autres populations n’avaient pas ou très rarement été trouvées sur la sésamie. Elle présentait de plus de petites différences morphologiques visibles à l’œil nu, étant plus jaune et plus grande.
Nous avons vérifié son isolement reproducteur en laboratoire, en montrant qu’elle ne pouvait plus se croiser avec des représentants des autres lignées. Elle pouvait être considérée comme une espèce différente (Kaiser et al., 2015). Sa description morphologique précise faite par un spécialiste au Canada a permis d’identifier des critères d’identification complémentaires à l’identification moléculaire, et nous avons choisi le nom Cotesia typhae, en référence à la plante sur laquelle l’insecte parasite la sésamie en Afrique (Kaiser et al., 2017) (figure 4).
Outre son intérêt pour la lutte biologique, cet exemple illustre un cas de spéciation écologique, où un isolement sur une niche écologique conférant un avantage à la reproduction amène à un isolement reproducteur qui, s’il se renforce au cours du temps, peut aboutir à la formation d’une nouvelle espèce. La chenille S. nonagrioides étant résistante à C. sesamiae, nous avons proposé qu’un variant génétique du parasitoïde, ayant une virulence efficace contre S. nonagrioides, ait pu coloniser cette espèce hôte et s’y spécialiser de génération en génération.

Ce scénario suppose que l’espèce hôte soit disponible tout au long de l’année dans les régions étudiées, ce qui est le cas. Notre hypothèse a été étayée par la mise en évidence chez Cotesia typhae de mutations sur plusieurs gènes de virulence, et par la perte de fonction voire par la disparition de certains d’entre eux, par rapport aux autres populations de C. sesamiae, ce qui caractérise la réduction du spectre d’hôtes chez les espèces parasites (Gauthier et al., 2018).
Une utilisation en lutte biologique
Revenons à la lutte biologique. En France le maïs (Zea mais) est cultivé sur 3 millions d’Ha, soit presqu’un tiers de la surface en céréales.
Parmi les insectes ravageurs du maïs, deux Lépidoptères occasionnent 85% des traitements insecticides pratiqués, la pyrale Ostrinia nubilalis Hübner (Lepidoptera, Crambidae), présente dans tout le pays, et la sésamie S. nonagrioides Lefebvre (Lepidoptera, Noctuidae), présente au sud d’une diagonale Angers-Valence (sauf Massif-Central), et remontant la côte Atlantique depuis une décennie (Rousseau, 2009 ; Thibord, 2017).
La sésamie se reproduit sur deux à trois générations annuelles. Elle peut entraîner 30 à 70% de perte de rendement en maïs grain et semence, d’une part en provoquant le tallage des jeunes plants dont le méristème est consommé par les chenilles de la première génération, et d’autre part, en favorisant la verse des plantes ainsi que le développement de moisissures toxiques pour le bétail et l’homme (fusariose) dans les galeries creusées dans les épis par les chenilles de seconde génération (Arvalis, 2007; Bryła et al., 2013). Il y a un manque de méthodes de contrôle en France. Le maïs Bt n’étant pas autorisé, deux autres méthodes sont utilisables contre la sésamie : la destruction des résidus de culture où hibernent les chenilles et les insecticides conventionnels.

Cependant ces méthodes ne ciblent que la première génération du ravageur car les insecticides autorisés sont difficilement applicables à la seconde génération qui se développe dans des maïs trop hauts pour permettre une pulvérisation. Développer un agent de contrôle biologique permettrait de réduire les populations de chenilles des deux générations, et serait compatible avec le contrôle biologique de la pyrale qui se trouve souvent en co-infestation avec la sésamie. Ce contrôle se fait par l’épandage de l’insecte parasitoïde Trichogramma brassicae (Hymenoptera, Chalcidoidea), mais ce n’est pas possible dans les champs traités chimiquement contre la sésamie (figure 5).
Les populations de sésamies sont peu limitées par des ennemis naturels car les stades de développement sont protégés par les gaines foliaires ou la tige. Le principal parasitoïde de S. nonagrioides en Europe de l’Ouest est la mouche tachinaire Lydella thompsoni (Diptera, Tachinidae), qui entraîne une mortalité trop variable de la sésamie du maïs (1 à 30% : Figueiredo and Araujo, 1996; Grenier et al., 1990; Monetti et al., 2003). Des lâchers de tachinaires n’ont pu être mis au point en raison des difficultés d’élevage de ce diptère en laboratoire. Un parasitoïde oophage, Telenomus busseolae, a été introduit pour acclimatation en Grèce et au Portugal, mais il ne semble pas que cela ait été un succès, faute de documents pour en attester. C. typhae pourrait donc combler le manque d’agent de lutte biologique contre S. nonagrioides en Europe.
Cette espèce présente l’intérêt d’être spécifique de la sésamie et son utilisation par lâchers réguliers serait réaliste car une espèce sœur, Cotesia flavipes, est utilisée à grande échelle pour contrôler la pyrale de la canne à sucre Diatraea saccharalis au Brésil (plus de 18 millions d’individus relâchés par an sur plus de 3 millions d’hectares de canne, Parra, 2014; Vacari et al., 2012).
Un programme de recherches (financé par l’ANR et le programme national ECOPHYTO) a été entrepris pour savoir s’il était faisable d’utiliser C. typhae comme agent de lutte biologique contre la sésamie. C’est une collaboration entre le CNRS de Gif-sur-Yvette (Essonne, laboratoire EGCE), l’International Center for Insect Physiology and Ecology (ICIPE) au Kenya (Nairobi), l’Université de Tours (à l’IRBI : Institut de recherche sur la Biologie de l’Insecte), l’Institut du végétal Arvalis de Pau-Montardon et la société Bioline.
Il est nécessaire de documenter les aspects suivants : son efficacité, son innocuité envers l’environnement français, et la faisabilité économique de son utilisation en lutte biologique. Des résultats ont d’ores et déjà été acquis pour les deux premiers points, présentés ci-dessous. Ces objectifs appliqués sont associés étroitement avec des objectifs de connaissance de l’interaction hôte-parasite.
La suite de l’article est à retrouver en cliquant sur ce lien
Les auteuresLaure Kaiser-Arnauld : Ingénieure agronome de formation, Laure s’est consacrée dès son doctorat à l’étude des Hyménoptères parasitoïdes, en particulier à leur comportement d’adaptation à l’hôte et à leur spécificité parasitaire, à l’INRA puis au CNRS où elle a participé au tournage du film de Claude Julie Parisot « Les nouveaux guerriers des champs » (Arte 2016) et où elle dirigé l’Unité Mixte de Recherche Evolution, Génomes, Comportements et Ecologie (EGCE) Taiadjana Fortuna : écologue passionné par la nature a fait sa formation dans différents pays, au Portugal, au Canada et aux Pays Bas où elle a réalisé son doctorat à l’Université de Wegeningen. Depuis ses études de master, elle s’intéresse au monde des parasitoïdes et leur utilisation comme agents de lutte biologique. Elle est actuellement ingénieure de recherche IRD dans le pôle écologie à EGCE et est responsable avec Laure Kaiser-Arnauld de l’étude des risques environnementaux posés éventuellement par l’introduction de C. typhae en France. |
Bibliographie récente
- Kaiser L. et al. (2017) : Systematics and biology of Cotesia typhae (Braconidae), a potential biological control agent against the noctuid Mediterranean corn borer, Sesamia nonagrioides. Zookeys (682):105-136 (lien)
- Kaiser L. et al. (2017) : Relationship between oviposition, virulence gene expression and parasitism success in Cotesia typhae nov. sp. parasitoid strains. Genetica, 145:469-479 (lien)
- Thibord J.B. (2017) : Evaluation of crop losses due to pests on maize production in France. Ecologie chimique, pp137-147 (lien)
- Gauthier J. et al. (2018) : Genetic footprints of adaptative divergence in the bracovirus of Cotesia sesamiae identified by targeted re-sequencing. Molecular Ecology, V27(8) : 2109-2123 (lien)
- Branca A. et al. (2019) : Relative influence of host, Wolbachia, geography and climate on the genetic structure of the sub-saharan parasitic wasp Cotesia sesamiae. Front. Ecol. Evol (lien)
Ouvrages sur cette thématique
- La lutte biologique: Vers de nouveaux équilibres écologiques (Sciences en partage) (Lydie Suty – Editions Quae – 516 pages – 17 mars 2010)
- Le jardinier-maraîcher – Manuel d’agriculture biologique sur petite surface (Jean-Martin Fortier – Editions Ecosociété – 238 pages – 13 janvier 2016)
- Le sol, la terre et les champs – Pour retrouver une agriculture saine (Claude Bourguignon & Lydia Bourgugnon – Sang Terre Editions – 246 pages – 29 mai 2015)





