Par Lison Laroche
Les phlébotomes, présents dans toutes les régions intertropicales, sont des insectes diptères appartenant à la famille des Psychodidae et à la sous-famille des Phlebotominae. Ce sont de minuscules insectes (2 à 3 mm) bossus, dont l’aspect poilu est dû à l’abondance de soies sur la tête et le thorax (figures 1 et 7).
En raison de leur comportement hématophage, les phlébotomes sont impliqués dans la transmission de différents agents pathogènes tels que les parasites leishmanies et les phlébovirus (Famille : Phenuiviridae ; Ordre : Bunyavirales). Certains phlébovirus sont associés à des pathologies humaines, comme le virus Toscana (TOSV). Ce virus a été isolé pour la première fois en 1971 chez les espèces Phlebotomus perniciosus et Phlebotomus perfiliewi en Italie centrale (Toscane).
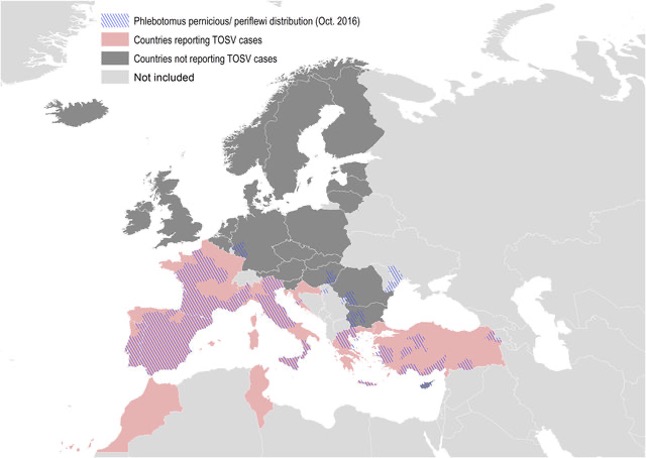
Le TOSV est endémique dans le bassin méditerranéen, où au moins 250 millions de personnes sont exposées au risque d’infection (Verani et al.,1988). Comme cela est souvent le cas avec les virus transmis par les arthropodes (arbovirus), de nombreuses infections par le TOSV ne sont pas signalées, car asymptomatiques pour la plupart (Braito et al., 1997). Le TOSV a un neurotropisme (affinité spécifique pour le système nerveux) particulier et est l’une des principales causes de méningites et d’encéphalites dans les régions endémiques (Charrel et al., 2005).
Les infections surviennent pendant les saisons chaudes, avec un pic durant l’été. Le TOSV est transmis à l’homme par la piqûre d’une femelle phlébotome infectée, et sa distribution géographique est liée à la présence de vecteurs phlébotomes qui continue de s’étendre. Le vecteur principal du TOSV est l’espèce Ph. perniciosus (Ayhan et al., 2020).
En raison de sa nature neuro-invasive, le TOSV est devenu le phlébovirus le plus préoccupant pour la santé publique, ce qui nécessite des recherches supplémentaires sur sa bio-écologie (Ayhan & Charrel, 2017).
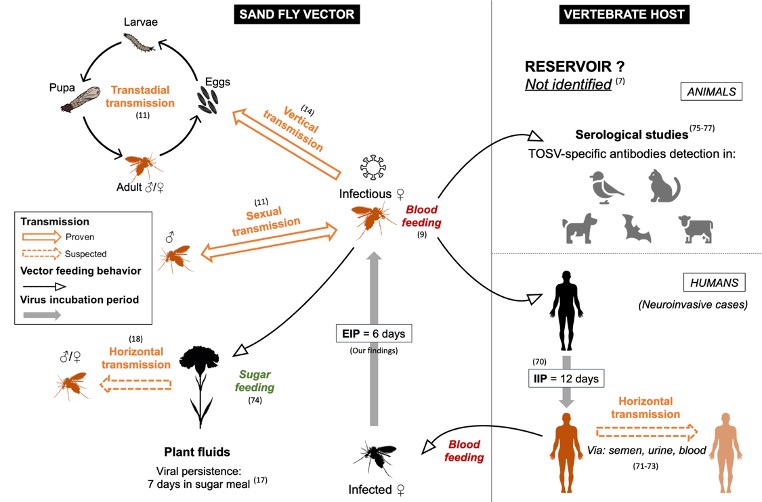
À ce jour, les informations sur le cycle naturel et la transmission du TOSV sont très limitées, en particulier la dynamique d’infection (la progression du virus au sein d’un organisme hôte au fil du temps) chez les vecteurs, les animaux ou les humains. Il a été démontré précédemment que le TOSV pouvait être transmis de la femelle phlébotome à sa descendance ainsi que d’une femelle infectée à un mâle (et inversement) lors de l’accouplement (Maroli et al., 1993). Cependant, l’importance de ces différents modes de transmission dans le cycle naturel du TOSV reste incertaine et nécessite davantage d’investigations.
Des recherches récentes ont suggéré que la transmission du virus entre phlébotomes partageant un repas de sucre sur une même plante pourrait jouer un rôle significatif dans le cycle naturel du virus (Laroche et al., 2023). Ce mode de transmission a déjà été démontré expérimentalement avec le phlébovirus Massilia, génétiquement lié mais distinct du TOSV (Jancarova et al., 2019). De plus, la persistance et l’infectiosité du TOSV dans le repas de sucre des phlébotomes ont été démontrées expérimentalement (Laroche et al., 2023). Cependant, la pertinence de cette voie de transmission alternative dans le cycle du TOSV dans les écosystèmes naturels reste à confirmer.
Au cours des dernières décennies, les arbovirus sont devenus des causes majeures de décès dans le monde entier, soulignant la nécessité de mieux comprendre leurs dynamiques de transmission (Heitmann et al., 2017 ; Soni et al., 2020) (figure 2). La plupart de ces recherches se sont concentrées sur les virus transmis par les moustiques, tels que les virus Zika, Dengue, et Chikungunya. Cependant, les virus transmis par les phlébotomes sont en constante émergence et réémergence, il est donc nécessaire de concentrer nos recherches sur les phlébovirus également.
Les épidémies d’arbovirus sont influencées à la fois par des facteurs intrinsèques (compétence vectorielle, souche ou lignée génétique du virus, effet de la dose virale, etc.) et extrinsèques (température, précipitations, activité humaine, etc.), qui peuvent influencer la biologie du vecteur (Lequime et al., 2020 ; Coffey et al., 2014). Ces facteurs peuvent affecter la dynamique de l’infection et de la transmission des arbovirus. Pour traiter de manière exhaustive l’impact des virus transmis par les phlébotomes sur la santé publique, des études supplémentaires sont nécessaires pour examiner leurs dynamiques d’infection. Ainsi, nous avons mis en place des infections expérimentales au laboratoire pour déterminer la dynamique d’infection du TOSV chez le vecteur Ph. perniciosus et mieux comprendre les mécanismes de transmission du virus.
Méthodologie des infections expérimentales
Les infections expérimentales de femelles Ph. perniciosus par le TOSV ont été réalisées dans un laboratoire confiné de sécurité biologique niveau 3 (IRD Vectopôle Montpellier, France). Un jour avant l’expérience, des femelles issues de l’insectarium ont été privées de repas de sucre. Avant l’infection, environ 100 femelles ont été transférées dans un pot d’alimentation et stockées dans un incubateur à 26 ± 1°C et 80 % d’humidité relative, afin de les acclimater. Des gorgeurs en verre ont été remplis de sang de lapin et recouverts d’une membrane de peau de poussin (figure 3 – vidéo en bas de page).
Le TOSV a été ajouté à une concentration finale de 10² TCID50/ml (dose 1), 10⁴ TCID50/ml (dose 2) ou 10⁶ TCID50/ml (dose 3) de sang. L’ensemble du système a été installé dans l’incubateur, où les gorgeurs ont été connectés à un bain d’eau circulant à 37°C et fixés aux pots d’alimentation. Les phlébotomes, ayant une activité crépusculaire, ont été exposés au sang pendant six heures dans une luminosité réduite. Les femelles gorgées de sang sont ensuite triées sur glace et transférées dans des boites de stockages maintenues dans l’incubateur.
Entre 10 et 30 individus ont été disséqués en trois parties : tête, corps (thorax et abdomen), membres (ailes et pattes) tous les deux jours pendant 15 jours et conservés dans un congélateur à -80°C pour quantification ultérieure du TOSV par RT-PCR. Afin de détecter le virus relâché par les femelles dans leur salive lors des repas de sucre quotidiens, après le repas de sang infectieux, les cotons imbibés de sucre ont été collectés quotidiennement et conservés à -80°C pour quantification ultérieure du TOSV.

Dynamique d’infection du virus Toscana chez le vecteur
Premièrement, nous avons confirmé la compétence vectorielle de Ph. perniciosus pour le TOSV en conditions expérimentales. La compétence vectorielle (capacité intrinsèque d’un vecteur à être infecté puis à transmettre le virus) est un processus progressif qui commence lorsque le vecteur prend un repas de sang infectieux à partir d’un hôte virémique.
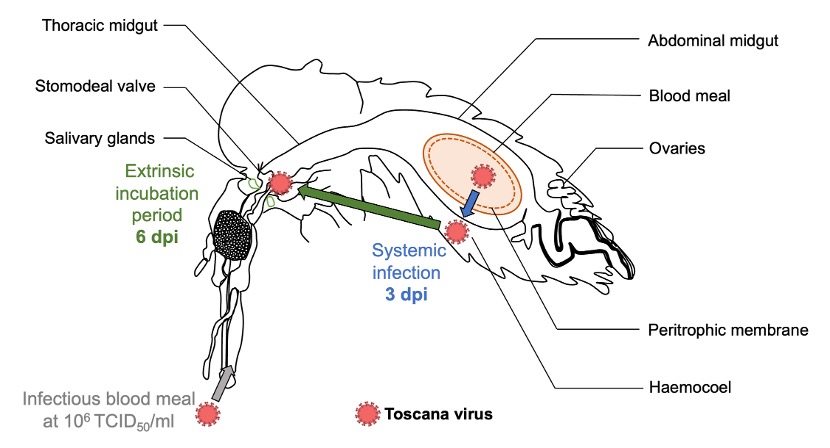
Après l’infection initiale et la réplication dans l’intestin moyen, le virus se propage vers les tissus secondaires dans l’hémocèle (infection systémique), puis vers les glandes salivaires, où il peut être libéré dans la salive et transmis lors d’un repas sanguin ultérieur (Fontaine et al., 2016). Ici, l’ARN viral du TOSV a été détecté dans la tête et le thorax jusqu’à au moins 15 jours post-infection (jpi), ainsi que dans l’hémocèle des ailes et les pattes (figure 4). De plus, le titrage viral dans les corps de phlébotomes infectés avec la dose 3 (10⁶ TCID50/ml) a montré que le TOSV était encore infectieux jusqu’à 14 jpi. Cette expérience a confirmé la réplication et la dissémination du TOSV chez Ph. perniciosus.

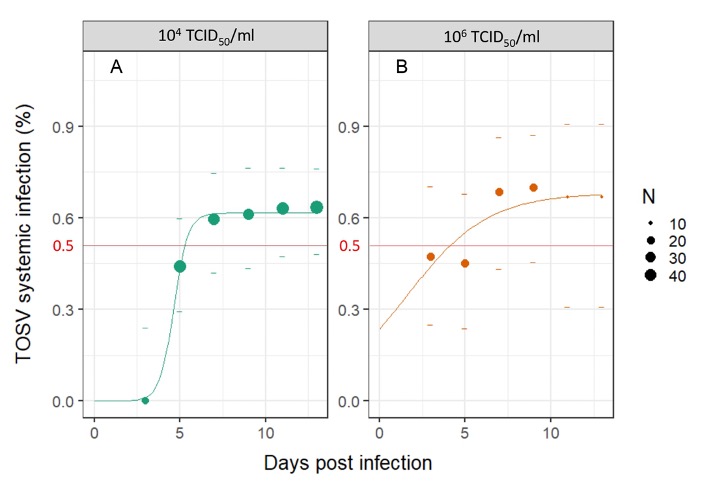
Nous avons ensuite démontré une corrélation directe entre les taux d’infection chez les phlébotomes et la dose infectieuse dans le repas sanguin ingéré. Lorsque les phlébotomes étaient infectés avec une faible dose de TOSV (10² TCID50/ml), les particules virales ne se sont pas disséminées dans le vecteur, et seuls quelques échantillons (corps) contenaient le TOSV avant que le phlébotome digère et excrète le repas sanguin. Par conséquent, on peut supposer que l’ingestion d’une faible dose virale ne conduit pas à une infection systémique. En revanche, chez les phlébotomes ayant ingéré 10⁴ TCID50/ml ou 10⁶ TCID50/ml, le TOSV s’est disséminé dans les tissus secondaires (dans l’hémocèle des têtes et membres), comme le montre la détection de l’ARN du TOSV pendant au moins 15 jours (figure 5).
D’après nos résultats expérimentaux, la dose infectieuse minimale pour une infection systémique par le TOSV chez Ph. perniciosus est supérieure à 10² TCID50/ml. Ce résultat est conforme à un autre modèle de virus transmis par les moustiques, une étude ayant démontré que des doses aussi faibles que 10³.⁹ PFU/ml (environ 10⁴ TCID50/ml) d’une souche asiatique du virus Chikungunya peuvent conduire à une transmission par Aedes albopictus (Ledermann et al., 2017).
Les niveaux de virémie dans les infections à phlébovirus chez les hôtes vertébrés sont généralement faibles et transitoires. Le vecteur doit ingérer une charge virale significative pour permettre la réplication et la transmission ultérieure du virus (Grazia Cusi et al., 2005). Après l’ingestion d’un repas de sang virémique, la charge virale dans un vecteur compétent augmente généralement de manière significative pour atteindre un plateau qui est maintenu pendant toute la durée de vie du vecteur (Lequime et al., 2020), ce qui est bien représenté pour le TOSV (figure 3). Pour plusieurs arbovirus, le pic de virémie des infections humaines symptomatiques est estimé à environ 10⁶ TCID50/ml (Tsetsarkin et al., 2007). Cependant, les cas humains asymptomatiques peuvent atteindre des niveaux de virémie aussi élevés que les estimations les plus basses pour les cas symptomatiques.
À ce jour, aucune étude n’a rapporté la charge virale du TOSV chez les patients asymptomatiques. Nos résultats ont montré que l’ARN du TOSV persiste chez les phlébotomes pendant plus de 15 jours lorsqu’ils sont infectés à une dose aussi faible que 10⁴ TCID50/ml. Ce seuil d’infection semble compatible avec la plupart des charges virales trouvées dans les hôtes réservoirs dans d’autres modèles d’arbovirus (Ledermann et al., 2017).
Par conséquent, les phlébotomes pourraient s’infecter pendant toute la période de virémie de l’hôte, qu’il soit symptomatique ou non.
Détection du virus dans le repas de sucre du phlébotome
Nous avons exploré la capacité des phlébotomes à transmettre le TOSV, en examinant spécifiquement leur aptitude à excréter le virus contenu dans leur salive pendant le processus d’alimentation. En conditions d’élevage, les femelles nourries de sang meurent la plupart du temps après la ponte, avant de prendre un deuxième repas sanguin, empêchant ainsi de mesurer la transmission lors d’un deuxième repas sanguin artificiel. Par conséquent, nous avons utilisé une alternative à ce problème en exploitant le comportement alimentaire des phlébotomes sur des solutions sucrées pour détecter le virus.
Afin de prédigérer le sucre, les phlébotomes libèrent de la salive pendant qu’ils se nourrissent (Charlab et al., 1999). Nous avons supposé que les phlébotomes infectés pourraient excréter des particules virales dans leur salive lorsqu’ils se nourrissent sur les cotons imbibés de sucre. Ces cotons ont ainsi été analysés par RT-PCR pour détection du virus. L’ARN du TOSV a été détecté dans les échantillons à 2, 6 et 8 jours post-infection. Une moyenne de 10³ copies d’ARN/ml (log10) de TOSV a été détectée dans les cotons collectés 2 jours post-infection. À 6 et 8 jours post-infection, l’ARN du TOSV a été détecté dans les échantillons de sucre avec une moyenne de 10³ et 10⁴ copies d’ARN/ml (log10) respectivement. Bien que la présence de particules de TOSV à 2 jpi puisse être attribuée à des résidus viraux (contamination entre individus, défécation, résidus de sang dans les pièces buccales du phlébotome, etc.), l’ARN viral du TOSV détecté à 6 et 8 jpi peut indiquer sa présence dans les glandes salivaires.
Ces résultats sont similaires à ceux observés précédemment avec le phlébovirus Massilia et Ph. perniciosus (Jancarova et al., 2019). Aussi, il a déjà été démontré que les moustiques Culex spp.libèrent des arbovirus pendant leur alimentation sur des solutions sucrées (Van den Hurk et al., 2007). La présence de l’ARN du TOSV dans le sucre pourrait signifier que le virus s’est disséminé ou qu’il est présent dans les glandes salivaires des phlébotomes, mais il reste à déterminer si le virus était infectieux.
Le TOSV atteint potentiellement les glandes salivaires de Ph. perniciosus 6 jpi. De plus, nous avons montré dans une autre étude que le TOSV persiste et reste infectieux jusqu’à 7 jours (à 26°C) dans une solution sucrée utilisé pour nourrir les phlébotomes d’élevage (Laroche et al., 2023). L’excrétion du TOSV lors du repas sucré, associée à cette récente démonstration suggère qu’une transmission horizontale (de phlébotome à phlébotome) pourrait se produire lors de l’alimentation sur une même plante dans la nature (figure 6). Pour mieux comprendre la dynamique de transmission et être en mesure de prédire l’émergence du TOSV, il serait crucial d’approfondir les recherches sur les éventuelles voies alternatives de transmission du TOSV entre phlébotomes via leur repas sucré.

Dynamique de transmission du TOSV
La transmission devient possible après l’achèvement de la période d’incubation extrinsèque (PIE), qui est ici considérée comme l’intervalle entre l’ingestion du virus et le premier moment où le virus est libéré de manière continue dans la salive du vecteur (Mellor, 2000). La durée moyenne de la PIE pour les phlébovirus transmis par les phlébotomes est d’au moins une semaine mais peut aller jusqu’à deux semaines comme pour le phlébovirus de la fièvre de la Vallée du Rift (RVFV) (Moutailler et al., 2007). Nous avons montré un effet-dose sur la dynamique de l’infection systémique, avec un temps médian pour atteindre une infection systémique d’environ 5 et 3 jours post-infection pour les phlébotomes infectés avec les doses 2 (10⁴ TCID50/ml) et 3 (10⁶ TCID50/ml), respectivement (figure 5).
Suite à la détection du TOSV sur les cotons sucrés à partir de 6 jpi, nous pouvons postuler que la PIE médiane du TOSV chez une femelle Ph. perniciosus, infectée avec la plus forte dose testée, est d’environ 6 jours (figure 8). La PIE peut être influencée par plusieurs facteurs (par ex. les conditions environnementales, la durée de vie ou le système immunitaire du vecteur), y compris la dose de virus ingérée (Winokur et al., 2020 ; Mbaika et al., 2016). Afin d’estimer avec précision la PIE du TOSV chez le vecteur, il serait intéressant de réaliser des répliques supplémentaires du test de coton sucré et d’autres expériences pour examiner les paramètres pouvant influencer cette période. Ce paramètre est essentiel car les pathogènes avec une PIE plus courte peuvent être transmis plus tôt après l’infection (Bellan et al., 2010).
Conclusion
Les résultats de ces travaux ont permis de confirmer la compétence vectorielle de Ph. perniciosus pour le TOSV, même à une dose plus faible dans le repas de sang (10⁴ TCID50/ml) que la dose virale observée au pic de virémie chez les mammifères symptomatiques (10⁶ TCID50/ml). Nos résultats suggèrent que la PIE du TOSV est courte (6 jours) comparée à celle d’autres virus transmis par les moustiques (14 jours pour les phlébovirus comme le RVFV (Moutailler et al., 2007), 10 jours pour les flavivirus comme Zika (Winokur et al., 2020)).
Compte tenu de cette courte durée de transmission, le risque épidémique dans les zones endémiques du TOSV doit être pris en considération.
Les résultats de cette étude permettent de mieux comprendre le maintien du virus dans les populations de phlébotomes et le cycle naturel du TOSV, tout en soulevant de nouvelles hypothèses sur les dynamiques de transmission (figure 9).
Auteure
Je me suis tout particulièrement intéressée aux phlébotomes durant mes recherches en thèse à l’IRD de Montpellier, qui sont des insectes vecteurs peu étudiés et responsables de plusieurs maladies virales et parasitaires. |
Bibliographie
- Ayhan N, Charrel RN. (2017) : Of phlebotomines (sandflies) and viruses: a comprehensive perspective on a complex situation. Curr Opin INSECT Sci. 22:117–24 https://doi.org/10.1016/j.cois.2017.05.019
- Ayhan N, Prudhomme J, Laroche L, Bañuls AL, Charrel RN. (2020) : Broader geographical distribution of toscana virus in the mediterranean region suggests the existence of larger varieties of sand fly vectors. Microorganisms. 8(1):e114 https://doi.org/10.3390/microorganisms8010114
- Bellan SE, Cornell SJ. (2010) : The Importance of Age Dependent Mortality and the Extrinsic Incubation Period in Models of Mosquito-Borne Disease Transmission and Control. PLoS One. 5(4):e10165 https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0010165
- Braito A, Corbisiero R, Corradini S, Marchi B, Sancasciani N, Fiorentini C, et al. (1997) : Evidence of Toscana virus infections without central nervous system involvement: A serological study. Eur J Epidemiol. 13(7):761–4 https://doi.org/10.1023/a:1007422103992
- Charlab R, Valenzuela JG, Rowton ED, Ribeiro JMC. (1999) : Toward an understanding of the biochemical and pharmacological complexity of the saliva of a hematophagous sand fly Lutzomyia longipalpis. Proc Natl Acad Sci. 96(26):15155–60 https://www.pnas.org/doi/abs/10.1073/pnas.96.26.15155
- Charrel RN, Gallian P, Navarro-Marı´ JM, Nicoletti L, Papa A, Sanchez-Seco MP, et al. (2005) : Emergence of Toscana virus in Europe. Emerg Infect Dis.; 11(11):1657–63 https://doi.org/10.3201/eid1111
- Coffey LL, Failloux AB, Weaver SC. (2014) : Chikungunya Virus-Vector Interactions. Viruses, Vol 6, Pages 4628–4663. 2014 ;6(11):4628–63 https://www.mdpi.com/1999-4915/6/11/4628/htm
- Fontaine A, Jiolle D, Moltini-Conclois I, Lequime S, Lambrechts L. (2016) : Excretion of dengue virus RNA by Aedes aegypti allows non-destructive monitoring of viral dissemination in individual mosquitoes. Sci Rep. 1–10 http://dx.doi.org/10.1038/srep24885
- Grazia Cusi M, Gori Savellini G, Terrosi C, Di Genova G, Valassina M, Valentini M, et al. (2005) : Development of a mouse model for the study of Toscana virus pathogenesis. Virology. Mar 1; 333(1):66–73 https://doi.org/10.1016/j.virol.2004.12.025
- Heitmann A, Jansen S, Lu¨hken R, Leggewie M, Badusche M, Pluskota B, et al. (2017) : Experimental transmission of zika virus by mosquitoes from central Europe. Eurosurveillance. 22(2):30437 https://www.eurosurveillance.org/content/10.2807/15607917.ES.2017.22.2.30437/
- Jancarova M, Bichaud L, Hlavacova J, Priet S, Ayhan N, Spitzova T, et al. (2019) : Experimental infection of sand flies by Massilia virus and viral transmission by co-feeding on sugar meal. Viruses. 11 (4):1–15 https://doi.org/10.3390/v11040332
- Laroche L, Ayhan N, Charrel R, Bañuls A-L, Prudhomme J. (2023) : Persistence of Toscana virus in sugar and blood meals of phlebotomine sand flies: epidemiological and experimental consequences. Sci Reports 131. 2023; 13(1):1–7 https://www.nature.com/articles/s41598-023-32431-9
- Ledermann JP, Borland EM, Powers AM. (2017) : Minimum infectious dose for Chikungunya virus in Aedes aegypti and albopictus mosquitoes. Rev Panam Salud Publica. 41:e65 https://pubmed.ncbi.nlm.nih.gov/28902278/
- Lequime S, Dehecq JS, Matheus S, De Laval F, Almeras L, Briolant S, et al. (2020) : Modeling intra-mosquito dynamics of Zika virus and its dose-dependence confirms the low epidemic potential of Aedes albopictus. PLOS Pathog. 16(12):e1009068 https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1009068
- Maroli M, Ciufolini MG, Verani P. (1993) : Vertical transmission of Toscana virus in the sandfly, Phlebotomus perniciosus, via the second gonotrophic cycle. Med Vet Entomol. 7(3):283–6 https://onlinelibrary.wiley.com/doi/full/10.1111/j.1365-2915.1993.tb00689.x.
- Mbaika S, Lutomiah J, Chepkorir E, Mulwa F, Khayeka-Wandabwa C, Tigoi C, et al. (2026) : Vector competence of Aedes aegypti in transmitting Chikungunya virus: Effects and implications of extrinsic incubation temperature on dissemination and infection rates. Virol J. 13 (1):1–9 https://virologyj.biomedcentral.com/articles/10.1186/s12985-016-0566-
- Mellor PS. (2000) : Replication of arboviruses in insect vectors. Vol. 123, Journal of Comparative Pathology. W.B. Saunders Ltd; p. 231–47 https://doi.org/10.1053/jcpa.2000.0434
- Moutailler S, Bouloy M, Failloux A-B. (2007) : Efficient oral infection of Culex pipiens quinquefasciatus by Rift Valley fever virus using a cotton stick support. Am J Trop Med Hyg. 76(5):827–9 https://pubmed.ncbi.nlm.nih.gov/17488899/
- Soni M, Khan SA, Bhattacharjee CK, Dutta P. (2020) : Experimental study of dengue virus infection in Aedes aegypti and Aedes albopictus: A comparative analysis on susceptibility, virus transmission and reproductive success. J Invertebr Pathol. 175:107445 https://pubmed.ncbi.nlm.nih.gov/32712268/
- Tsetsarkin KA, Vanlandingham DL, McGee CE, Higgs S. (2007) : A single mutation in Chikungunya virus affects vector specificity and epidemic potential. PLoS Pathog. 3(12):1895–906. https://doi.org/10.1371/journal.ppat.0030201
- Van den Hurk AF, Johnson PH, Hall-Mendelin S, Northill JA, Simmons RJ, Jansen CC, et al. (2007) : Expectoration of Flaviviruses During Sugar Feeding by Mosquitoes (Diptera: Culicidae). J Med Entomol. 44(5):845–50 https://academic.oup.com/jme/article/44/5/845/973141
- Verani P, Ciufolini MG, Caciolli S, Renzi A, Nicoletti L, Sabatinelli G, et al. (1988) : Ecology of viruses isolated from sand flies in Italy and characterized of a new Phlebovirus (Arabia virus). Am J Trop Med Hyg, 38(2):433–9 https://pubmed.ncbi.nlm.nih.gov/3128131/
- Winokur OC, Main BJ, Nicholson J, Barker CM. (2020) : Impact of temperature on the extrinsic incubation period of Zika virus in Aedes aegypti. PLoS Negl Trop Dis. 14(3):e0008047 https://journals.plos.org/plosntds/article?id=10.1371/journal.pntd.0008047

 Lison Laroche – Chercheure en entomologie médicale à l’
Lison Laroche – Chercheure en entomologie médicale à l’