Par Benoît GILLES
Les insectes participent à de nombreux services majeurs pour l’équilibre des écosystèmes comme la pollinisation (Calderone, 2012 ; Garibaldi et al., 2014 ; Huang and An, 2018). D’un point de vue économique, les abeilles sont les pollinisateurs parmi les plus importants, notamment l’Abeille domestique (Apis mellifera) qui garantit le rendement et la qualité des cultures (Meehan et al., 2011).
Pour protéger les cultures des insectes ravageurs, les filières agricoles ont recours à de nombreux insecticides ayant des impacts sur la santé et la survie des abeilles, domestiques et sauvages, et donc sur la disparation des populations de ces insectes (Goulson et al., 2015 ; Potts et al., 2016 ; Van der Sluijs et al., 2013 ; Vanbergen et al., 2013) (lien).
Des centaines d’études ont montré que l’exposition à des concentrations sublétales de néonicotinoïdes, comme l’imidaclopride (IMD), le thiaméthoxame (TMX) et la clothianidine (CLO), dans les aliments altère le comportement de recherche de nourriture, le comportement de retour à la colonie et d’orientation, ainsi que l’apprentissage et la mémoire olfactifs (par exemple : Gill et al., 2012 ; Henry et al., 2012 ; Parkinson et al., 2022a ; Schneider et al., 2012a ; Williamson et coll., 2014 ; Wright et coll., 2015).
La plupart de ces études consistent à administrer des pesticides dans des solutions sucrées puis à observer les changements de comportement ou de performance des abeilles. Cependant, peu d’entre elles se sont intéressées à savoir si les abeilles avaient la capacité de détecter et d’éviter les pesticides présents dans leurs aliments. Quelques-unes ont toutefois porté sur les néonicotinoïdes présents dans le nectar (Arce et al., 2018 ; Kessler et al., 2015 ; Muth et al., 2020), avec des résultats contradictoires. D’autres composés, comme le sulfoxaflor, qui affectent la signalisation cholinergique (substance augmentant ou imitant l’action de l’acétylcholine favorisant l’action du système nerveux et des muscles) dans le système nerveux des insectes, ont été proposés comme alternatives aux néonicotinoïdes sans que la question de savoir s’ils peuvent ou non être détectés par le sens du goût de l’abeille ait été posée !
Les insectes détectent les composés non volatils (c’est-à-dire les arômes) grâce à l’activation de cellules chimioréceptrices situées sur des chimiosensilles de contact au niveau des pièces buccales, des antennes et des tarses (lien). La liaison d’un ligand (par exemple, une molécule sucrée, un composé « amer » non nutritif, un sel, etc.) à une protéine réceptrice à la surface de la cellule chimioréceptrice, déclenche une cascade de transduction de signal (potentiel d’action) transmembranaire qui aboutit à une dépolarisation du neurone et donc à un influx nerveux (lien). En fonction du type de ligand, cet influx déclenche une réponse comportementale différente : inhibition ou activation de la prise de nourriture.
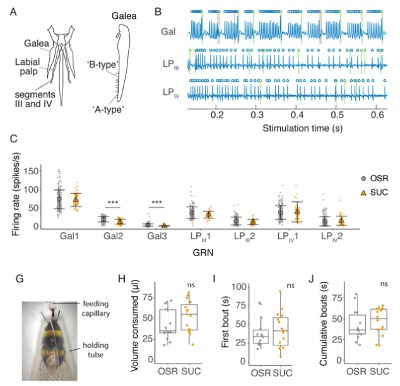
Le mécanisme de détection des sucres est hautement spécialisé chez les pollinisateurs de la famille des Apidae par rapport aux autres espèces en raison de leur régime alimentaire essentiellement basé sur le nectar. Par exemple, les bourdons apprécient le monosaccharide et le fructose. La détection des toxines comme les composés amers et les pesticides est réalisée sur les palpes labiaux (lien) chez un grand nombre d’espèces d’insectes.
Des études ont permis de mettre en évidence que les abeilles et les bourdons n’étaient ni attirés ni dissuadés de consommer des solutions sucrées contenant des néonicotinoïdes, des résultats concordant avec l’idée que ces espèces n’ont pas la capacité de détecter les pesticides (Muth et al., 2020). Autre question soulevée : le type de sucre peut-il influencer la perception des néonicotinoïdes par les sensilles des abeilles ? (Parkinson et al., 2022b).
Une équipe anglaise dirigée par Geraldine A. Wright du département de Biologie de l’Université d’Oxford a mené une combinaison d’analyses à la fois comportementale et électrophysiologiques pour tester si les pièces buccales des bourdons femelles (Bombus terrestris) butineuses disposent de mécanismes permettant de détecter les pesticides dans le nectar. Les scientifiques ont utilisé des butineuses en mouvement libre pour évaluer si ces insectes pouvaient détecter et éviter les toxines potentielles dans leurs aliments.
Pour identifier si les bourdons détectent la présence de néonicotinoïdes sur leurs pièces buccales, les scientifiques leur ont proposé des solutions composées de fructose et de glucose imitant le nectar du colza (Brassica napus) (OSR) et contenant des concentrations de néonicotinoïdes comparables à celles rencontrées sur le terrain durant une période de 2 minutes. L’équipe a également réalisé des analyses électrophysiologiques pour déterminer si les sensilles situées à plusieurs endroits des pièces buccales (galéa et palpes labiaux – lien) sont capables de détecter les néonicotinoïdes (IMD, CLO, et TMX), le sulfoxamine et le sulfoxaflor (SFX) et d’activer les neurones récepteurs gustatifs (figure 1).
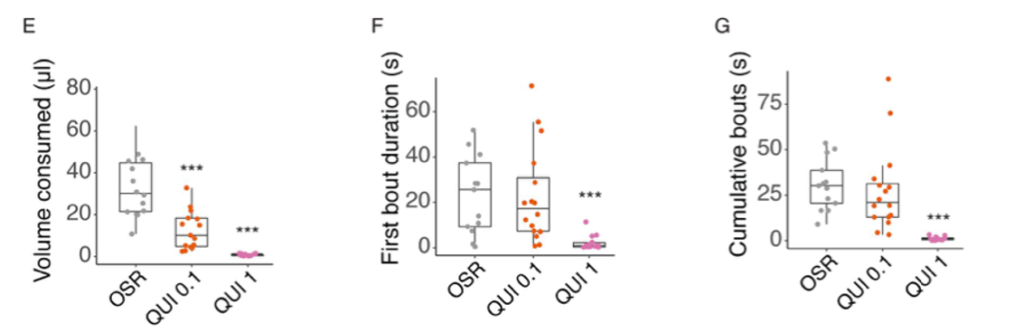
Les résultats montrent que les bourdons ne disposent pas de tels mécanismes. Les néonicotinoïdes et le sulfoxaflor n’ont pas modifié l’activité (activation ou inhibition) neuronale dans les pièces buccales. De manière frappante, l’étude révèle que les bourdons n’évitent pas d’ingérer des solutions de nectar même en présence de concentrations très élevées de pesticides (figures 2 et 3).
Bien que de faibles activités sensorielles aient été détectées, celles-ci n’étaient pas suffisantes pour générer un signal neuronal gustatif produisant une aversion pour les aliments contenant des toxines potentielles.
Les pièces buccales des Bourdons ne disposent pas de mécanismes permettant de détecter et d’éviter les pesticides cholinergiques présents dans le nectar.
Des résultats antérieurs avaient montré que les abeilles développaient une préférence pour les solutions contenant du TMX lorsqu’elles devaient choisir entre du saccharose et du saccharose mélangé à un pesticide (Kessler et al., 2015). Ce phénomène de préférence peut être causé par l’action pharmacologique du TMX sur les nerurones cholinergiques impliqués dans le codage de la récompense dans le cerveau de l’insecte. Ces effets sont particulièrement rapides car les composés absorbés atteignent l’hémolymphe des abeilles dans les 30 secondes suivant l’ingestion (Simcock et al., 2018).
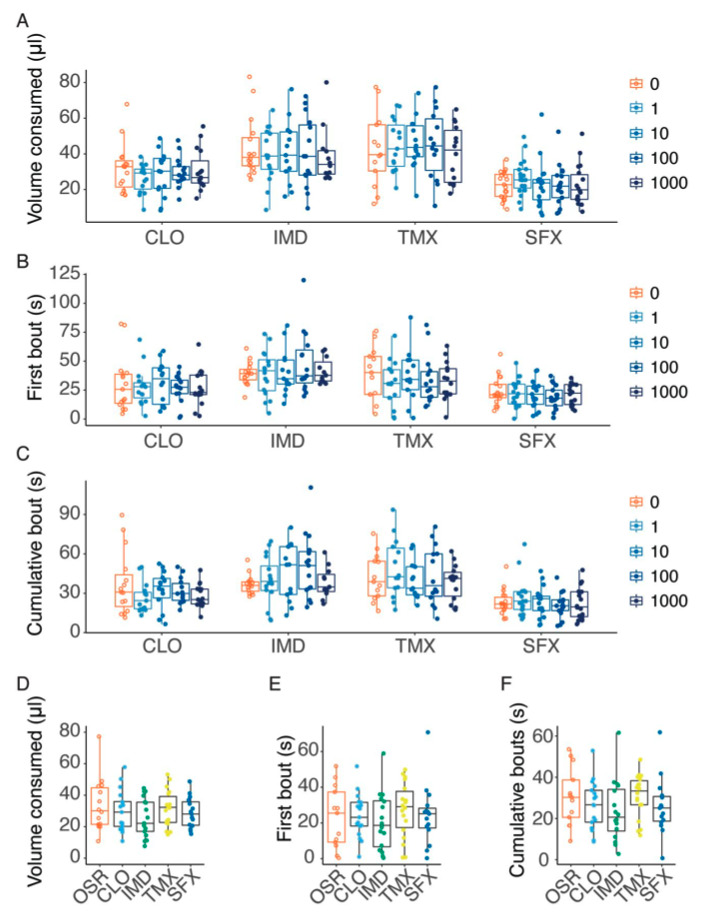
Lorsque les bourdons de cette étude ont été nourris avec un nectar contenant des concentrations élevées de pesticides, les réactions post-ingestion ne les ont pas empêché d’ingérer des doses potentiellement mortelles. Par exemple, la DL50 (taux de mortalité de 50%) du TMX chez Bombus terrestris est d’environ 6 ng/individu (Siviter et al., 2022) : les bourdons testés ont consommé une quantité médiane de 3,5 ng de TMX une fois dissous à 100 µM.
Si le TMX amène les bourdons à associer une « valeur de récompense » plus élevée à la nourriture trouvée dans un endroit particulier, ils apprendraient à y revenir de préférence plutôt qu’à d’autres solutions.
Fleurs et pollinisateurs ont co-évolué pour faciliter ou non l’accès au nectar et au pollen. Par exemple, la longueur de la corolle est corrélée à des groupes particuliers de pollinisateurs dotés de pièces buccales adaptées ; une longue corolle protège le nectar des visiteurs opportunistes. Dans de nombreuses fleurs, le nectar est positionné profondément dans la corolle, de sorte que le seul contact que les bourdons ont avec lui se fait via l’extrémité distale de la trompe (lien) (où se trouvent la plupart des sensilles). Pour cette raison, il est probable que l’appétence du nectar soit largement déterminée par les sensilles de la trompe et non par celles situées sur les antennes ou sur les tarses.
Pour en apprendre davantage sur les interactions et la coévolution fleur/pollinisateur : lien
Bibliographie
- Parkinson et al. (2023) : Mouthparts of the bumblebee (Bombus terrestris) exhibit poor acuity for the detection of pesticides in nectar. elife
- Arce A.N. et al. (2018) : Foraging bumblebees acquire a preference for neonicotinoid-treated food with prolonged exposure. Proceedings of the Royal Society of London B: Biological Sciences 285:8–11 (lien)
- Calderone N.W. (2012) : Insect pollinated crops, Insect pollinators and US agriculture : Trend analysis of aggregate data for the period 1992-2009. PLoS One 7:24-28 (lien)
- Garibaldi L.A. et al. (2014) : Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science, 339:1608-1611 (lien)
- Gill R.J. ; Ramos-Rodriguez O. & Raine N.E. (2012) : Combined pesticide exposure severely affects individual- and colony-level traits in bees. Nature, 491:105-108 (lien)
- Goulson D. ; Nicholls E. ; Botias C. & Rotheray E.L. (2015) : Bee declines driven by combined stress from parasites, pesticides and lack of flowers. Science, 347 (lien)
- Henry M. et al. (2012) : A common pesticide decrease foraging success and survival in honey bees. Science, 336:348-350 (lien)
- Huang X. ; An J.D. (2018) : Species diversity, pollination application and strategy for conservation of the bumblebee of China. Biodiversity Science, 26:486-497 (lien)
- Kessler S.C. et al. (2015) : Bees prefer foods containing neonicotinoid pesticides. Nature, 521:74–76 (lien)
- Meehan T.D. ; Werling B.P. ; Landis D.A. & Gratton C. (2011) : Agricultural landscape simplification and insecticide use in the Midwesterne United States. Proceedings of the National Academy of Science, 108:11500-11505 (lien)
- Muth F. ; Gaxiola R. & Leonard A. S (2020) : No evidence for neonicotinoid preferences in the bumblebee Bombus impatiens. R Soc Open Sci 7 (lien)
- Parkinson R.H. et al. (2022a) : Chronic exposure to insectivores impairs honeybee optomotor behavior. Frontiers in Insect Science, 2:1-14
- Parkinson R.H. et al. (2022b) : Temporal responses of bumblebee gustatory neurons to sugars. iScience 25 (lien)
- Potts S.G. et al. (2016) : Safeguarding pollinators and their values to human well-being. Nature, 540:220-229 (lien)
- Schneider C.A ; Rasband W.S. ; Eliceiri, Kevin W. (2012) : NIH Image to image : 25 years of Image Analysis. Nat Methods, 9:671-675 (lien)
- Simcock N.K. et al. (2018) : Appetitive olfactory learning and memory in the honeybee depend on sugar reward identity. J Insect Physio, 106:71–7 (lien)
- Siviter H. ; Matthews A.J. & Brown M.J.F. ( 2022) : A Combined LD50 for Agrochemicals and Pathogens in Bumblebees (Bombus terrestris). Environ Entomol, 51:378–384 (lien)
-