Les yeux, dans leur diversité de forme et de structure, permettent à un organisme, quel qu’il soit (invertébrés et vertébrés), de collecter l’énergie lumineuse (photons), de la convertir en énergie électrique qui sera ensuite transmise au cerveau via des neurones où elle sera analysée et interprétée pour donner naissance à une représentation mentale de l’environnement à l’animal lui permettant de se déplacer, de repérer une proie ou un partenaire sexuel.
Cependant, l’oeil des arthropodes est différent de celui des vertébrés tant au niveau de son anatomie que de son mode de fonctionnement : constitués de plusieurs sous-unités similaires, les ommatidies (voir infographie ci-contre), ils sont appelés yeux composés. Cette série de trois articles essaie d’apporter une synthèse générale sur la vision chez les insectes : 1) Anatomie et structure des yeux ; 2) Vision et perception du mouvement ; 3) Physiologie des récepteurs et mécanismes de régulation de la sensibilité à la lumière.
La description anatomique et structurelle des ommatidies, sous-unités de l’oeil composé des insectes, ayant fait l’objet d’un premier article, celui-ci est consacré à la formation de l’image, et à la perception de la distance et du mouvement.
I) Formation de l’image
La formation de l’image dépend des propriétés optiques de la lentille cornéale et des cônes cristallins de l’ommatidie (lire article sur l’anatomie). Ces deux structures, d’indice de réfraction différent, dévient les ondes lumineuses lorsque celles-ci les traversent.
Les yeux composés des insectes sont de deux types : apposition et superposition (lire article sur l’anatomie).
- Type apposition
La principale, voire la seule surface réfractante, est la lentille cornéale, parfois les cônes cristallins comme chez les lépidoptères.
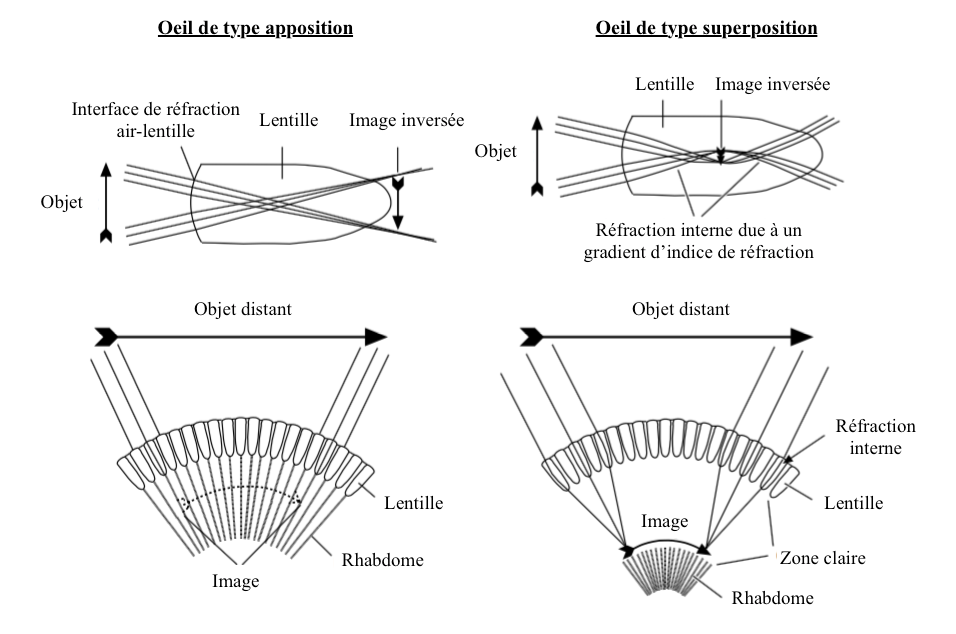
La présence de cellules cornéales, également appelées cellules pigmentaires secondaires, canalise la lumière vers le rhabdome de l’ommatidie. Chaque ommatidie fonctionne de ce fait de manière indépendante et produit une image inversée de l’objet du champ visuel dont le centre se situe à la pointe du rhabdome (union des rhabdomères de chaque cellule photoréceptrices) (lire article sur l’anatomie) (Figure 1). Ainsi, dans chaque ommatidie, le rhabdome reçoit une image d’intensité globale variant en fonction de la quantité de lumineuse. Les rhabdomes transmettent collectivement une image en mosaïque constituée de la contribution de chaque ommatidie. Bien qu’entrainant une perte des détails de l’image puisque l’ensemble des cellules photoréceptrices partagent le même champ visuel, ce mécanisme permet à l’insecte de maximiser la quantité de lumière entrant dans le rhabdome.
- Type superposition
Ces yeux se différencient principalement des yeux appositions par :
- L’absence de cellules pigmentaires secondaires permettant à la lumière traversant chaque lentille d’atteindre le rhabdome des ommatidies voisines (figure 1)
- La présence d’un gradient d’indice de réfraction dans l’axe transversal de la lentille et du cône cristallin (Figure 2)
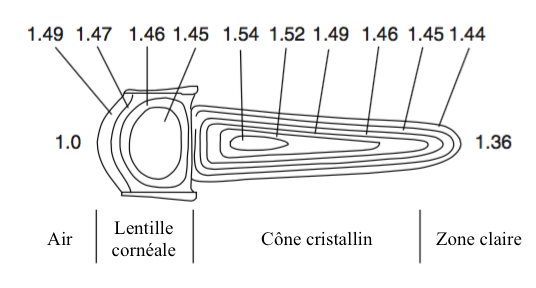
Ainsi, la lumière n’est pas réfractée en entrée de lentille mais en son sein en suivant une voie incurvée permettant aux rayons provenant de plusieurs lentilles d’être redirigés vers un même rhabdome. Ce mécanisme, décrit pour la première fois par le physiologiste autrichien Sigmund Exner (1846-1926), a été adapté pour créer les télescopes à double lentille.
II) Résolution
La résolution définit le degré de finesse avec laquelle l’oeil forme une image d’un objet. Dans les yeux composés, elle est déterminée par deux paramètres : l’angle interommatidial (ΔΦ) et l’angle d’entrée de la lumière dans l’ommatidie (Δρ) (angle d’acceptance) (lire ces articles : anatomie et vision 3D).
L’image sera d’autant plus nette que l’angle interommatidial sera petit. Chez les insectes, cet angle est généralement compris entre 1 et 3°, cependant, selon que les espèces sont prédatrices ou non, il peut être de 5° chez les coléoptères ou de 0,24° chez les odonates (libellules). Les yeux composés de certaines espèces peuvent présenter des zones aux angles interommatidiaux différents leur permettant d’obtenir des images nettes dans un champ visuel spécifique pour capturer des proies ou repérer les partenaires sexuels en vol – exemples : mante-religieuse (sur le devant de l’oeil) et libellules (sur le dessus de l’oeil) – (lire cet article).
Les espèces nocturnes satisfont à un compromis pour s’adapter à des environnements à faible luminosité : augmenter la réception de la lumière avec un angle interommatidial élevé et donc perdre en résolution.
La mouche a cependant trouvé une parade. La sélection naturelle a modifié le réseau neuronal de son système visuel de telle sorte que chaque rhabdome reçoive la lumière provenant de 7 ommatidies, lui permettant ainsi de conserver une certaine résolution avec un angle interommatidial faible et de capter suffisamment de lumière.
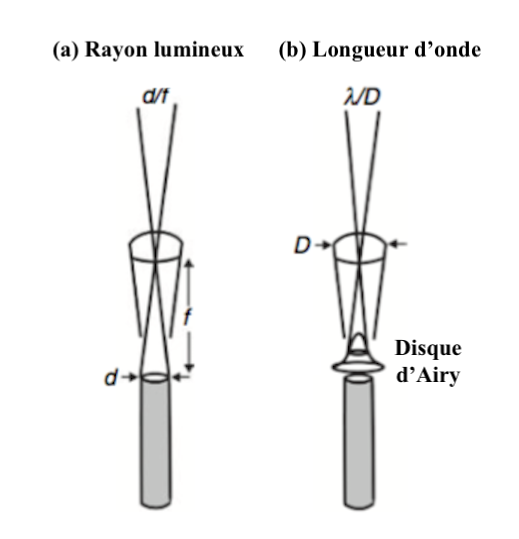
En terme de résolution, il n’y a aucun bénéfice à posséder un angle interommatidial plus petit que l’angle d’acceptance. Cet angle dépend de la largeur de rhabdome (d/f) et de la diffusion de la lumière (Figure 3a). Lorsque la lumière traverse une structure circulaire comme le sont la lentille et le rhabdome, la diffraction de la lumière forme une image appelée : tache d’Airy, en l’honneur de son découvreur, le mathématicien, physicien et astronome anglais George Biddell Airy (1801-1892). Ce phénomène optique entraine la formation d’un disque dû à la nature ondulatoire de la lumière. Le rayon de la tache lumineuse est fonction de la longueur d’onde (λ) et du diamètre de la lentille (D) (Figure 3b).
La résolution correspond à λ/D. Ainsi, chez les insectes, le diamètre de la lentille étant d’environ de 25µm, et la longueur d’onde lumineuse moyenne se situant autour de 0,5µm, la résolution de l’image au niveau d’une ommatidie est d’environ de 1°
0,5/25 = 0,02 radian
1 radian correspondant à 57,3°
57 x 0,02 = 1,15°
A titre de comparaison, la pupille de l’homme mesurant 2,5mm, la résolution est 100 fois plus importante que celle de l’abeille par exemple.
En raison de ces contraintes physiques, la seule possibilité pour les insectes d’augmenter leur résolution visuelle est d’augmenter le diamètre de leur lentille. Or, cela pose une autre contrainte : celle de la surface disponible. Pour obtenir une résolution similaire à celle de l’homme, le diamètre de l’oeil composé des insectes devrait mesurer près de 12m !
III) Forme et perception

Les abeilles constituent d’excellents modèles d’études pour comprendre la vision chez les insectes car elles peuvent être entrainées à discriminer des formes mais également des détails spatiaux subtils comme des éléments distincts dans une même image.
Cette faculté se rencontre chez d’autres espèces comme des mouches de la famille des Tephritidae (lire cet article) ou encore des guêpes polistes (Hyménoptères) de l’espèce Polistes dominulus. Ces dernières, vivant en petite colonie d’une vingtaine d’individus, ont la faculté de distinguer les variations des patterns/motifs faciaux présentes sur leurs congénères afin de les reconnaître individuellement comme des membre de la colonie, compétence que l’on retrouve chez les humains par exemple (figure 4).
IV) Champ visuel
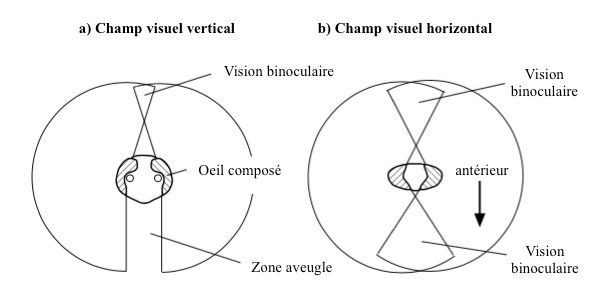
Grâce à leurs yeux composés, les insectes possèdent un large champ visuel. Par exemple, celui de la blatte Periplaneta (Blattodea) est de 360° avec une vision binoculaire sur le devant, l’arrière et le dessous (Figure 5). De tels champs visuels se rencontrent également chez de nombreux autres insectes comme les orthoptères, les diptères, les odonates, etc., les insectes dont la vision joue un rôle prépondérant dans leur écologie.
V) Distance et perception
Les insectes ont la capacité d’estimer les distances avec efficacité, pour le saut, la prédation, le vol…
L’estimation de la distance peut se faire par deux mécanismes : stéréoscopique et parallaxe de mouvement.
Les insectes de grande taille possèdent en général une bonne résolution visuel (angle interommatidial petit et angle entre les deux yeux grand) et une vision binoculaire leur procurant un fort potentiel pour apprécier les distances de manière stéréoscopique. C’est la cas par exemple pour les mantes-religieuses (Lire cet article).
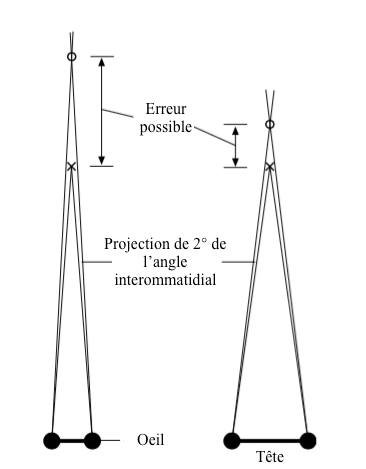
Les erreurs d’appréciation surviennent lorsque l’angle interommatidial est supérieur à 2° et la distance entre l’objet et l’insecte grande. C’est pourquoi, afin d’augmenter la précision, les insectes prédateurs ont les yeux écartés et placés de chaque côté de la tête (Figure 6).
Une autre technique consiste à se balancer sur le côté pour accroître l’angle entre les deux yeux jusqu’à 1°, voire plus : comportement de parallaxe de mouvement. Les balancements transversaux de l’observateur accentuent la position relative de l’objet. Plus ce dernier sera éloigné de l’observateur, moins celui-ci se déplacera dans le champ visuel par rapport aux objets plus proches.
VI) Suivi visuel
Le suivi visuel consiste à garder un objet en mouvement sur une zone précise et fixe de l’oeil (la fovéa) (exemple chez la mante-religieuse : tache noire au milieu de l’oeil – infographie ci-dessous) afin de maintenir une résolution et une précision maximale.
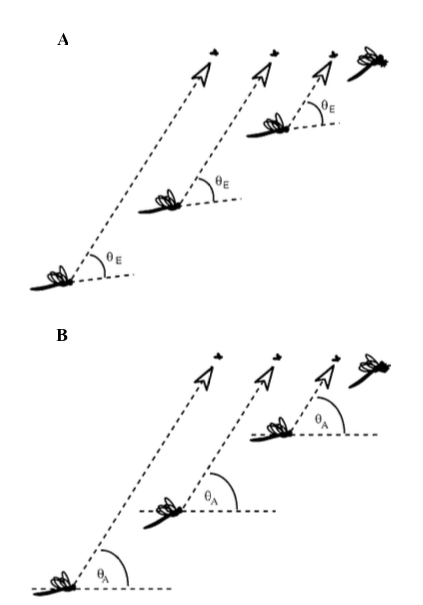
Si l’objet se déplace de manière lente et homogène, l’insecte compensera le mouvement par un déplacement, soit de la tête (mante-religieuse), soit du corps en entier (mouche Calliphora), afin de le conserver dans son champ visuel (figure 7).
Par contre, si le déplacement de l’objet est rapide et hétérogène, l’insecte compensera le déplacement lorsque l’objet sera sorti du champ visuel par un mouvement saccadé, soit de la tête, soit du corps en entier.
Les deux comportements peuvent se rencontrer chez les même espèces, qui sont pour la plupart prédatrices, sauteuses ou volantes.

Le fonctionnement de toutes ces structures et le traitement de l’information visuelle feront l’objet de prochains articles (pour être informé, inscrivez-vous à la newsletter si cela n’est pas encore fait !)
Source :
– The Insects : Structure & Function (5ème édition, 2013) – Edition : S.J. Simpson & A.E. Douglas – Cambridge University Press
– Encyclopedia of Insects : Vincent H. RESH & Ring T. CARDE, Academic Press-2009
– Tibbetts E. A. & Izzo A. (2010) : Social punishment of dishonest signalers caused by mismatch between signal and behavior – Current Biology, 20(18):1637-1640 (lien)
– Olberg R. M. ; Worthington A. H. & Venator K. R. (2000) : Prey pursuit and interception in dragonflies – J. Comp. Physiol. A, 186:155-162 (lien)
Recommandation d’ouvrages sur cette thématique
– Evolution of the Insects (David Grimaldi & Michael S. Engel – Edition : Cambridge University Press – 772 pages – 16 mai 2005)
– The Insects: An Outline of Entomology (P.J. Gullan & P.S. Cranston – Edition : Wiley-Blackwell – 624 pages – 5ème édition : 6 août 2014)
– The Insects: Structure and Function (R.F. Chapman & Stephen J. Simpson – Edition : Cambridge University Press – 959 pages – 5ème édition : 12 novembre 2012)
– Encyclopedia of Insects (Vincent H. Resh & Ring T. Cardé – Edition : Academic Press – 1024 pages – 2ème édition : 22 juillet 2009)