Par Fanny Vogelweith
Tout au long de leur cycle de vie – allant de l’œuf jusqu’à à la fin de leur vie d’adulte sexué – les insectes font face à de nombreuses menaces, aussi bien d’origine abiotique (e. g. température, vent, etc.) que biotique (e.g. ennemis naturels). Ils ont développé un incroyable arsenal de défenses pour se protéger des pressions qu’ils subissent et qui les menacent. Parmi les différentes barrières de défenses, c’est le système immunitaire qui est le point focal de cet article.
Souvent décrit comme le dernier rempart pour se défendre, le système immunitaire des insectes a longtemps été considéré comme moins sophistiqué que celui des vertébrés. Cependant, depuis les années 1990, les études montrant sa complexité se sont multipliées. Jules Hoffmann (directeur de recherche émérite, CNRS, Strasbourg) a d’ailleurs obtenu – avec Bruce Beutler et Ralph Steinman – le prix Nobel de physiologie et de médecine, en 2011, pour son travail sur l’immunité innée de la Drosophile.
Description générale du système immunitaire
Le système immunitaire lato sensu représente l’ensemble des processus biologiques qui protègent un organisme des maladies résultant des agents pathogènes et des cellules cancéreuses, en les identifiant et les éliminant. Sa fonction n’est donc pas seulement l’exclusion des parasites et la lutte contre les infections ! Il permet de distinguer un large éventail d’agents infectieux en les différenciant des cellules saines et des tissus hôtes.
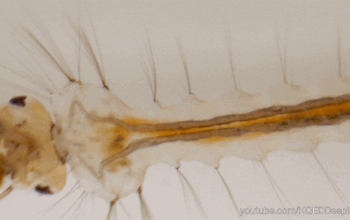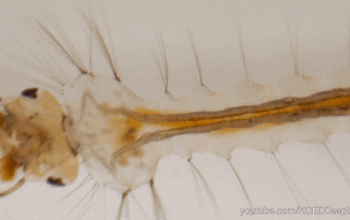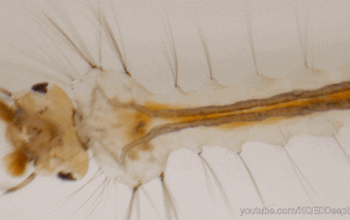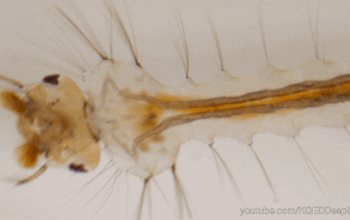
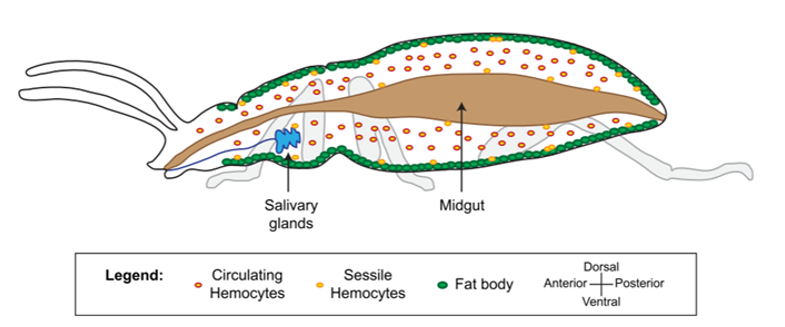
Le système immunitaire des invertébrés répond, comme celui des vertébrés, de façon innée. En revanche, il se distingue de celui des vertébrés par son absence d’immunité adaptative avec une mémoire basée sur des immunoglobulines spécifiques (protéines douées d’activités d’anticorps) (Carton & Nappi 2001). Cependant, chez les insectes, le système immunitaire inné livre une réponse humorale (la prophénoloxidase et les peptides antimicrobiens, voir section réponse immunitaire) et une réponse cellulaire (hémocytes, voir sections suivantes) dont le déclenchement dépent de la menace détectée. De nombreux organes sont impliqués dans le déclenchement de cette réponse, comme par exemple le corps gras et l’intestin moyen (figure 1) (lien).
Activation du système immunitaire
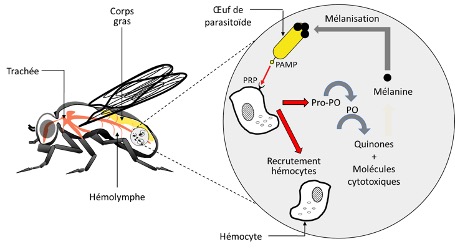
La réponse immunitaire des insectes est activée par la reconnaissance d’un large spectre de motifs du non-soi, et notamment, par ces cellules immunitaires appelées hémocytes (l’équivalent de nos globules blancs ou leucocytes). Ce non-soi est reconnu comme étranger grâce à des molécules spécifiques à la surface de ses cellules (appelés les modèles moléculaires associés aux agents pathogènes = Pathogen Associated Molecular Patterns ou PAMPs). Les molécules du pathogènes sont reconnues par leur équivalent présents à la surface des hémocytes, appelés peptides de reconnaissance des formes (Pattern Recognition Peptides = PRPs) (figure 2) (Siva-Jothy et al. 2005).
Une fois le pathogène détecté, une cascade de réponses est déclenchée en fonction de la menace (ex : bactérienne, virale, etc.), adaptant ainsi la réponse immune.
Réponse immunitaire
- Exemple de l’encapsulation* d’un œuf de parasitoïde
Dans le cas d’une infection suite à l’injection d’un œuf de parasitoïde dans l’organisme hôte (œuf ou chenille par exemple), les hémocytes circulant dans l’hémolymphe vont immédiatement sonner l’alarme (Siva-Jothy et al. 2005). Cela entraine le recrutement d’autres hémocytes qui vont s’agrègent autour de l’œuf afin de l’isoler du reste du corps de l’insecte (figures 2, 3). Le recrutement des hémocytes est rapide et peut durer dans le temps.
Par exemple, chez la Cochylis de la vigne (Eupoecilia ambiguella), l’augmentation des hémocytes est significative dès 2h après une injection mimant une attaque de parasitoïde, et augmente jusqu’à 24h post-infection (Vogelweith, données non publiées). Les hémocytes vont en même temps et tout aussi rapidement entrainer l’activation de la cascade enzymatique de la prophénoloxydase (Cerenius & Soderhall 2004). L’activation de cette enzyme va entrainer la production de mélanine et former une capsule mélanique autour de l’œuf (figures 2, 3). L’activation de la cascade entraine également la production de molécules cytotoxiques et de quinones qui vont être toxiques pour l’œuf et participer à son élimination (Nappi & Ottaviani 2000). Il faut noter que l’enzyme prophénoloxidase est également impliquée dans d’autres processus tels que la coagulation et la sclérotinisation (processus aboutissant à une cuticule rigide chez les arthropodes) après une blessure, permettant de la refermer (Sugumaran et al. 2000).
*Encapsulation : mécanisme de défense en réponse à l’invasion d’un organisme étranger à l’intérieur d’un insecte. Ainsi, l’hôte forme une capsule autour de l’organisme étranger grâce aux hémocytes et à la production de mélanine, et l’isole du reste du corps.
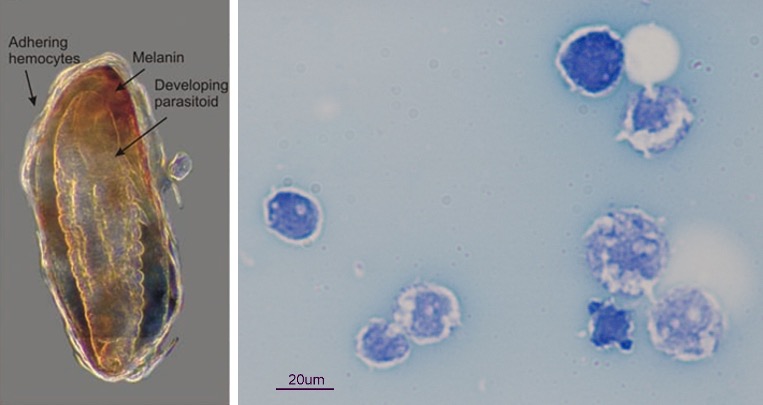
- Exemple de d’une infection par un microorganisme
Suite à une infection microbienne, un ensemble de peptides antimicrobiens (AMPs) est produit et sécrété dans l’hémolymphe par les hémocytes (figure 2), le corps gras et les épithéliums (Eleftherianos et al. 2021). A l’heure actuelle, plus de 360 AMPs ont été décrits et isolés chez les insectes avec des propriétés variés aussi bien antibactériennes, antifongiques qu’antiparasitaires (voir la revue de Eleftherianos et al. 2021). Contrairement aux autres effecteurs (hémocytes et prophénoloxidase), cette ligne de défense est plus spécifique et très efficace pour neutraliser les microorganismes (e.g. bactéries). Cependant, sa mise en œuvre est relativement lente en raison de son caractère inductible de cette voie immunitaire (Haine et al. 2008). Une fois stimulée, la production de peptides antimicrobiens peut être importante et se prolonger relativement longtemps compte tenu de la durée de vie des invertébrés (Haine et al. 2008).
La réponse immunitaire des insectes a donc une action humorale et cellulaire, immédiate grâce aux hémocytes et à la Phénoloxydase (PO – mélanisation des agents infectieux) (appelée immunité constitutive), et à long terme par l’intermédiaire des peptides antimicrobiens.
Le système immunitaire et ses compromis
Malgré cet outil performant, les insectes ne sont évidemment pas pour autant totalement protégés. En effet, maintenir une immunité constitutive et mettre en place une réponse immunitaire sont des fonctions biologiques couteuses. L’insecte n’ayant pas accès à des ressources illimitées, des compromis sont donc indispensables que ce soit au sein du système immunitaire lui-même ou par le biais d’autres traits d’histoire de vie, tels que la croissance ou la reproduction.
En effet, un compromis entre l’immunité constitutive (hémocytes et PO) et l’immunité à plus long terme (peptides antimicrobiens), modulé par la nourriture, a été mis en évidence chez les chenilles de la Cochylis de la vigne (E. ambiguella) (figure 4a) (Vogelweith et al. 2011) et de la Noctuelle méditerranéenne (Spodoptera littoralis) (Cotter et al. 2011). Ainsi, les chenilles de la Cochylis (figure 4b) se nourrissant du cépage savagnin rose (Gewürztraminer) seraient plus à même de se défendre contre les parasitoïdes (plus d’hémocytes et de prophénoloxidase) que celles élevées sur un chasselas qui elles seraient plus armées contre les bactéries (plus d’activité antimicrobienne) (figure 4c) (Vogelweith et al. 2011).
Un autre exemple de compromis, cette fois entre différents traits d’histoire de vie, est celui observé chez le Puceron vert du pois (Acyrthosiphon pisum), où les individus les plus féconds sont les moins résistants à une attaque par un parasitoïde (Gwynn et al. 2005). Ces insectes doivent donc adapter leur « investissement » dans l’immunité en fonction de leur environnement, de leur mode de vie (e.g. grégaire, solitaire) et des pressions qu’ils subissent.
C’est en raison de la complexité de ces interactions qu’est née une discipline appelée l’« immuno-écologie ».

Zoom sur les hémocytes
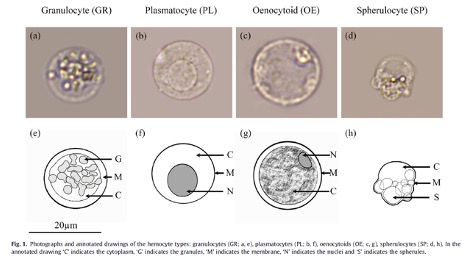
Les hémocytes sont des cellules très nombreuses, de morphologie variable, circulant librement dans l’hémolymphe des insectes (figures 1, 2, 3). Ils proviennent des tissus hématopoïétiques (e.g. corps gras, intestin moyen, glandes salivaires) dans lesquels ils se différencient et se divisent. Ils présentent différents types spécialisés dans des fonctions particulières de l’immunité (e.g. reconnaissance du non-soi), et dont le nombre varie en fonction du stade de développement de l’individu et de l’espèce (Lavine & Strand 2002).
Par exemple, chez l’Eudémis de la vigne (Lobesia botrana), 5 types d’hémocytes sont présents chez les jeunes chenilles puis 4 types chez les chenilles au dernier stade (figure 5). Certains hémocytes comme les plasmatocytes ou les granulocytes sont responsables de la reconnaissance des corps étrangers (figure 5) : les plasmatocytes sont les premiers à adhérer à un œuf de parasitoïde par exemple. Outre leur rôle dans l’encapsulation (figures 2, 3), les hémocytes sont également impliquées dans la phagocytose (processus consistant à l’internalisation par les hémocytes de petites particules étrangères conduisant à leur dégradation) des corps étrangers, la nodulation des bactéries (micro-agrégation d’hémocytes autour de plusieurs microorganismes infectieux, bactéries, etc.) et la coagulation de l’hémolymphe suite à une blessure dans la cuticule (Lavine & Strand 2002; Siva-Jothy et al. 2005). Ils constituent donc un paramètre clé de la réponse immunitaire (voir Lavine & Strand 2002 pour une description approfondie).
Bibliographie
- Carton, Y., Poirié, M., & Nappi, A. J. (2008) : Insect immune resistance to parasitoids. Insect Science, 15(1), 67–87 (lien)
- Cerenius, L., & Söderhäll, K. (2004) : The prophenoloxidase-activating system in invertebrates. Immunological Reviews, 198, 116–126 (lien)
- Cotter, S. C., Simpson, S. J., Raubenheimer, D., & Wilson, K. (2011) : Macronutrient balance mediates trade-offs between immune function and life history traits. Functional Ecology, 25(1), 186–198 (lien)
- Eleftherianos, et al. (2021) : Diversity of insect antimicrobial peptides and proteins – A functional perspective: A review. In International Journal of Biological Macromolecules (Vol. 191, pp. 277–287). Elsevier B.V. (lien)
- Gwynn, D. M., Callaghan, a, Gorham, J., Walters, K. F. a, & Fellowes, M. D. E. (2005) : Resistance is costly: trade-offs between immunity, fecundity and survival in the pea aphid. Proceedings. Biological Sciences / The Royal Society, 272(1574), 1803–1808 (lien)
- Haine, E. R., Moret, Y., Siva-Jothy, M. T., & Rolff, J. (2008) : Antimicrobial defense and persistent infection in insects. Science, 322, 1257–1259 (lien)
- Hillyer, J. F. (2016). Insect immunology and hematopoiesis. Developmental and Comparative Immunology (lien)
- Lavine, M. D. D., & Strand, M. R. R. (2002) : Insect hemocytes and their role in immunity. Insect Biochemistry and Molecular Biology, 32(10), 1295–1309 (lien)
- Nappi, A. J., & Carton, Y. (2001) : Immunogenetic aspects of the cellular immune response of Drosophila against parasitoids. Immunogenetics, 52(3–4), 157–164 (lien)
- Nappi, A. J., & Ottaviani, E. (2000) : Cytotoxicity and cytotoxie molecules in invertebrates. BioEssays, 22, 469–480 (lien)
- Siva-Jothy, M. T., Moret, Y., & Rolff, J. (2005) : Insect Immunity : An Evolutionary Ecology Perspective. Advances In Insect Physiology, 32(05), 1–48 (lien)
- Strand, M. R. (2008) : The insect cellular immune response. Insect Science, 15(1), 1–14 (lien)
- Sugumaran, M., Nellaiappan, K., & Valivittan, K. (2000) : A new mechanism for the control of phenoloxidase activity: inhibition and complex formation with quinone isomerase. Archives of Biochemistry and Biophysics, 379(2), 252–260 (lien)
- Vogelweith, F. (2013) : Effet de la plante hôte sur l’immunité des insectes phytophages : Influence du cépage de vigne sur la capacité des vers de la grappe à se défendre contre des bio-agresseurs. University of Burgondy (lien)
- Vogelweith, F., Moret, Y., Monceau, K., Thiéry, D., & Moreau, J. (2016) : The relative abundance of hemocyte types in a polyphagous moth larva depends on diet. Journal of Insect Physiology, 88, 33–39 (lien)
- Vogelweith, F., Thiéry, D., Quaglietti, B., Moret, Y., & Moreau, J. (2011) : Host plant variation plastically impacts different traits of the immune system of a phytophagous insect. Functional Ecology, 25(6), 1241–1247 (lien)