Les membracides sont des petits insectes appartenant à la super-famille des Membracoidea et à l’ordre des Hémiptères : pucerons, cicadelles et cigales, caractérisés par une métamorphose non complète (hémimétabolisme : lire cet article) et des organes buccaux de type piqueurs-suceurs (lire cet article).
Ces insectes sont connus pour les soins prodigués aux oeufs et aux larves, pour leur faculté à réaliser des sauts impressionnants et surtout pour leur excroissance ornementant leur thorax, qui revêt des formes, tailles, couleurs et textures des plus extravagantes (voir photos ci-dessous).

Actuellement, ce sont plus de 3 270 espèces qui ont été décrites à travers le monde, dont la plus grande diversité se rencontre en Amérique centrale et du sud. Elles sont réparties en familles : les Aetalionidae (6 genres et 42 espèces) – les Melizoderidae (2 genres et 8 espèces) – les Membracidae (plus de 400 genres et 3 000 espèces).
En France, seuls trois genres et quatre espèces sont présents, deux communes : Stictocephala bisonia et Centrotus cornutus, et deux plus rares : Gargara genistae et Centrotus chloroticus (voir photos).


I) Biologie générale
Phytophages, les membracides percent les tissus végétaux et en sucent le phloème (tissu conducteur de la sève élaborée : provenant des feuilles, riche en glucides et acides aminés) à l’aide de leur stylet (appareil buccal modifié en forme de « paille », lire cet article). Certaines espèces peuvent s’alimenter du xylème (tissus conducteur de la sève brute : provenant des racines, riche en eau et sels minéraux). Les larves se nourrissent, quant à elles, du parenchyme (tissu fondamental du végétal).
Comme tous les Hémiptères, les membracides possèdent un intestin modifié et spécialisé comportant une chambre de filtration qui leur permet de filtrer et d’assimiler les éléments nutritifs de la sève. Le surplus de liquide est excrété : le miellat, la plupart du temps récolté par les insectes sociaux comme les fourmis, les guêpes et les abeilles pour sa teneur en glucides et en acides aminés essentiels.
Les membracides peuvent être dépendantes d’une seule espèce de plante-hôte, ou de plusieurs selon les espèces, et ce, quel que soit leur stade de développement.

La ponte se fait soit dans les tissus de la plante-hôte, la femelle insérant ses oeufs à l’aide de son ovipositeur (appendices abdominaux en forme de « sabre » qui permettent aux femelles d’enfouir leurs oeufs dans un substrat, organes qui se retrouvent chez beaucoup de familles d’insectes : Orthoptères, Hyménoptères…), soit directement à la surface du végétal. Dans les deux cas, la femelle les recouvre d’une substance cireuse pour les protéger de la dessiccation, des prédateurs, des parasitoïdes, infections fongiques et des mécanismes chimiques de défense de la plante (résine, latex…) (voir photo 1).
De l’oeuf à l’imago, le développement passe par cinq phases larvaires hémimétaboles : les larves ressemblent aux adultes et ne passent pas par un stade de métamorphose complète (lire cet article).
Les modalités de leur accouplement restent encore mal connues : la femelle peut être fécondée par un ou plusieurs mâles selon les espèces.
Les espèces des régions tempérées ont tendance à être univoltines (une génération par an) et hibernent sous forme d’oeufs, et celles des régions tropicales multivoltines (plusieurs générations par an). Cependant, il existe chez ces dernières une certaine influence de la saisonnalité des plantes-hôtes et de l’habitat.
II) Comportement social & soins parentaux
Il existe un continuum du niveau de sociabilité chez les membracides : solitaire, grégaire et subsocial.
- Solitaire : individu, voir couple, isolé sur une partie du végétal (branche, pétiole, inflorescence florale, etc.). Il semblerait que ce soit le cas pour la grande majorité des espèces.
- Grégaires : défini par Eickwort (1981) comme « tout groupe d’indivis de la même espèce, comprenant plus d’un couple, présent sur un même emplacement », ce comportement confère aux individus un avantage alimentaire, protecteur et dans l’attraction des fourmis avec qui les membracides ont développé des relations mutualistes de protection et de soins (voir le prochain paragraphe). Plusieurs comportements d’agrégation ont été recensés : – rassemblement uniquement de larves de la même espèces, soit issues de la même fratrie, soit de fratries différentes provenant de pontes collectives (même endroit) – rassemblement d’adultes et de larves de la même espèce, du même âge ou non selon que l’espèce est sémelpare (une seule ponte dans la vie de l’animal) ou itéropare (plusieurs pontes) – rassemblement d’individus adultes et de larves d’espèces et d’âges différents (voir vidéo en bas de page).

Photo 2 : Femelle membracide et ses larves venant d’éclore (Source : Graham Wise – Flickr.com) - Subsocial : espèce prodiguant des soins parentaux à sa progéniture. Un soin parental est défini comme « tout comportement parental post-ovipositionnel (après la ponte) qui augmente la survie, la croissance et le développement des larves ». Chez les membracides, le soin parental le plus répandu est la protection (gardiennage) de la ponte et/ou des larves durant une période plus ou moins prolongées selon les espèces contre les prédateurs et les parasitoïdes, certaines jusqu’au stade adulte de leur progéniture (voir photo 2). D’autres comportements plus intéressants ont été observés chez les espèces où les tissus de la plante-hôte sont trop épais et résistants pour le passage du stylet des jeunes larves. La femelle réalise des incisions avec son ovipositeur pour les aider à atteindre les tissus parenchymenteux. D’autres espèces peuvent créer des puits dans les tissus du végétal où les liquides s’accumulent, les rendant ainsi accessibles et disponibles aux larves. Enfin, les femelles de certaines espèces ont des comportements actifs et agressifs face à un prédateur : coups de pattes, écartement des ailes, mouvement rapide du corps, vibration ou encore émission de phéromones d’alerte.
Le comportement de ponte est également très variable entre les espèces. Il peut être unique ou multiple, sur une ou plusieurs plantes-hôtes, étalé ou non dans le temps (de quelques jours à plusieurs semaines). Le choix des disperser les oeufs en plusieurs pontes et sur plusieurs plantes-hôtes diminue les risques de la prédation et du parasitisme. Les espèces à ponte unique, en général grégaires, déposent leurs oeufs sur des zones de la plante où d’autres femelles ont déjà pondu.
III) Relation de mutualisme avec les fourmis
Mutualisme : avantage réciproque entre deux espèces différentes (exemple à lire ici sur les fourmis champignonnistes)

Le miellat sécrété par les hémiptères et donc les membracides est riche en glucides et en acides aminés essentiels, ce qui constitue une importante source alimentaire exploitée par les fourmis et d’autres sociaux (guêpes et abeilles). Les mêmes interactions existent dans nos contrées entre les pucerons et les fourmis (voir photo 3 et vidéo en bas de page).
Les membracides bénéficient d’une protection des fourmis contre les prédateurs et les fourmis reçoivent en retour une ressource alimentaire riche, en grande quantité et facile d’accès.
Une thématique qui fera l’objet d’un prochain article.
Le mutualisme favorise certainement l’émergence de comportements grégaires chez les membracides car les fourmis sont plus fortement attirés par des regroupements que par des individus isolés : phénomène de densité/dépendance.
Au cours de l’évolution, certaines espèces de fourmis ont développé des comportements de protection bien plus avancés de leur ressource, le miellat, en construisant des abris à membracides (ou à d’autres hémiptères). Les membracides, larves et/ou imagos, de la même espèce ou non, sont placés à l’intérieur, sans possibilité de déplacement. La forme et la taille de ces abris, variables, sont spécifiques aux espèces. Ces interactions ne semblent pas être obligatoires car les espèces de membracides concernées peuvent être retrouvées à la fois à l’extérieur et à l’intérieur de ces abris.
IV) Morphologie : communication & camouflage
Les membracides possèdent sur leur thorax une excroissance de forme, de couleur, de taille et de structure extrêmement variables dont l’origine et le rôle sont encore sujet à controverse (voir paragraphe suivant). Cependant, cette excroissance, appelé « casque », est creuse et semble jouer un rôle dans la production et l’émission de signaux vibratoires que les insectes utiliseraient pour communiquer. Ces signaux ne sont pas aériens, mais se déplacent à travers les tissus du végétal qui sert de caisse de résonance, détectés par les nombreux poils sensoriels situés sur la face ventrale des membracides.

Les membracides semblent être capables de déterminer et de localiser la source sonore, ce qui sous-entend l’existence d’un mécanisme de localisation directionnelle qui n’a pas encore été décrit chez ces insectes. Le rôle du casque dans ce système n’a pas été mis en évidence.
Ils présentent, pour certaines espèces, des motifs et des colorations particulièrement visibles des autres animaux, notamment celle de leur casque, dans un but de prévenir aux prédateurs de leur toxicité : coloration aposématique. De nombreux exemples existent chez les insectes (exemple : papillons Heliconius, lire cet article) (voir photo 4).

D’autres, au contraire, ont des tenues de camouflages et miment la couleur et la texture de support végétal : coloration cryptique (voir photo 5).
La coloration aposématique semble plutôt être liée aux espèces grégaires et subsociales, et les colorations critique aux espèces solitaires.
Le type de coloration peut changer au cours des différents stades de développement. Il est évident qu’une forte pression de sélection s’exerce sur ces paramètres morphologiques.
V) Mécanisme du saut
Pour fuir, les membracides ont développé un mécanisme de fuite particulièrement efficace : le saut, avec une puissance telle qu’un insecte de quelques millimètres peut atteindre des vitesses de 5-5,5m/s en quelques millisecondes, ce qui représente tout de même une accélération de 550-719 G!!
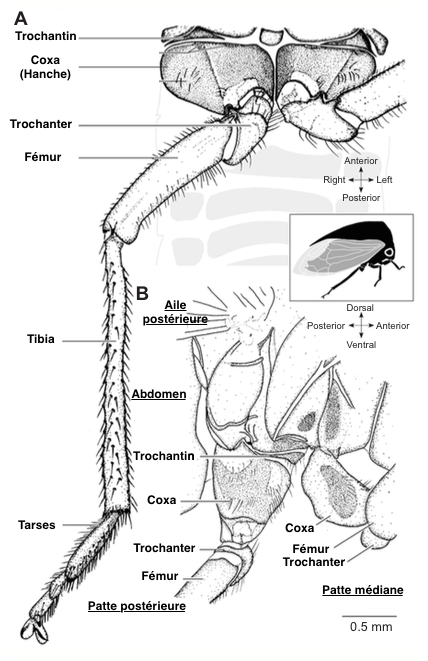
Cette performance exceptionnelle est possible grâce à un mécanisme de catapulte où d’énormes muscles thoraciques, sous tension, stockent une grande quantité d’énergie dans une structure composite (cuticule et protéines caoutchouteuse : la résiline) et qui la libèrent en une fraction de seconde comme un élastique.
Ces muscles sont situés à la base des pattes postérieures, dans l’articulation coxo-trochanter (voir illustration 1). Quand ils sont sous tension, le fémur est plaqué contre le corps de l’insecte dans une échancrure ventrale. Lorsque la pression est libérée, le fémur est propulsé vers l’arrière ce qui engendre un déplacement de l’insecte vers l’avant (voir illustration 2).

La forme aérodynamique des membracides permet d’augmenter l’efficacité du saut. La plupart du temps les ailes restent fermées durant cette phase et ne semblent pas intervenir. Cependant, il a été observé que, selon les espèces, les ailes pouvaient battre à des timing différents durant le saut, peut être pour stabiliser la trajectoire et la position du corps.
La vitesse et l’accélération du saut sont dépendantes de la taille et du poids de l’insecte qui quitte le sol en moyenne en 2 millisecondes!
Ce mécanisme permet à l’animal de générer des forces par unité de masse bien supérieures à ce que peut produire des muscles : elles sont incroyables puisqu’elles peuvent atteindre 5 300 à 33 000kw/kg. Si l’on considère que les muscles de saut représentent 11% de la masse totale du corps, ces valeurs se situent bien au-delà des possibilités physiologiques de contraction des muscles. Les muscles ne peuvent développer des puissances de contractions qu’aux alentours de 250-3 000kw/kg.
L’évolution a donc favorisé la sélection de ce système de propulsion par catapulte pour augmenter les performances du saut et donc les chances de survie de l’insecte. Cette innovation est apparue plusieurs fois au sein des lignées d’insectes comme chez les puces et les criquets.
VI) Origine de l’appendice protothoracique (le casque) : un débat toujours d’actualité
A l’heure actuelle, l’origine du casque chez les membracides demeure encore un sujet de controverse.
Deux hypothèses sont proposées, la première par le français Benjamin Prud’homme (Nature, 2011) qui suggère que le casque serait issu d’une troisième paire d’ailes modifiées rattachées au premier segment thoracique (le protothorax : T1) ; et la seconde par l’américain Istvan Miko (PlosOne, 2012) qui décrit le casque comme une excroissance du premier segment thoracique (voir illustration 3).
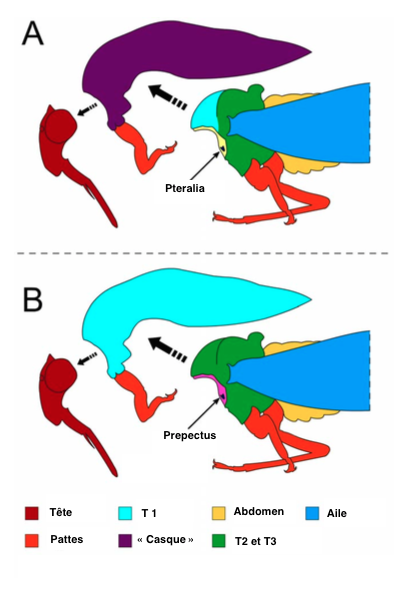
Pour l’équipe française, l’apparition d’une troisième paire d’ailes sur le protothorax constituerait une innovation sans précédent dans l’histoire évolutive des insectes. En effet, l’évolution engendre essentiellement des réductions ou des pertes d’organes et d’appendices. La structure morphologique des insectes comme on l’a connait aujourd’hui est restée inchangée depuis près de 350 millions d’années : une paire d’ailes sur le deuxième et troisième segment thoracique, T2 et T3 (lire cet article sur la phylogénie des insectes).
Leur conclusion est basée sur des études génétiques et morphologiques. Peur eux, le casque serait une structure indépendante du thorax, reliée par des articulations souples composées de nombreux éléments plus ou moins sclérifiés, comme ceux que l’on retrouve à la base de l’aile : les pteralia (lire cet article). Il proviendrait donc de la fusion de cette paire d’appendices thoraciques pour former une structure unique (présence d’une ligne médiane dans l’axe antéro-postérieur). Ces appendices et par la suite le casque, n’étant pas soumis aux contraintes fonctionnelles imposées par le vol, auraient évolué dans une diversité infinie de forme, de couleur, de taille et de texture.
De plus, l’étude de la structure du casque révèle la présence d’un réseau complexe de veines, de deux couches de cellules épithéliales reliées entre elles par des colonnes cuticulaires : des structures retrouvées dans les ailes des insectes (lire cet article).
Les analyses génétiques ont quant à elles mis en évidence l’expression de gènes impliqués dans le développement des ailes comme le gène Nubbin et dans la mise en place de l’axe proximo-distal des appendices : Distal-Less (DLL) et Homothorax (HTH). La présence de ces signatures moléculaires dans les cellules du casque indiquerait son origine alaire.
Une conclusion que réfute l’équipe internationale de Istvan Miko pour laquelle le casque serait une simple excroissance, une hypertrophie du protothorax (T1). Les éléments de l’articulation présentés comme des pteralia modifiés seraient des excroissances de la cuticule où sont fixés les muscles contrôlant la fermeture du spirale thoracique : le prepectus (ouverture donnant sur la trachée et permettant l’entrée d’air dans le corps de l’insecte). Aussi, le système complexe de veines et de trachées retrouvé dans le casque n’est pas pour eux homologue à celui des ailes, même si son but est le transport des éléments nutritifs et de l’oxygène.
De plus, la ligne médiane du casque serait une ligne ecdysiale (suture de la cuticule permettant à l’insecte de la quitter et donc de muer) et non une ligne de fusion entre deux ailes. Istvan Miko suggère qu’il n’y a pas de différences structurelles avec les autres segments thoraciques : T2 et T3.
Enfin, pour l’équipe menée par Istvan Miko, la présence des gènes Nubbin, DLL et HTH dans les cellules à l’orgie du casque durant son développement ne permet pas de conclure sur son origine alaire : en effet, ces gènes seraient également exprimés dans des organes autres que les ailes (le système nerveux et les pattes par exemple). Le gène Nubbin semble être lié au développement de l’ensemble des appendices et non uniquement à celui des ailes.
Le casque serait dans ce cas une simple évagination non articulée ayant une origine développementale proche de celle des ailes où seraient impliqués les même processus génétiques.
Des études complémentaires devront être menées pour découvrir le mystère qui se cache derrière cet organe des plus surprenants. Affaire à suivre!!
Vidéo :
Pour plus d’information :
Source :
– Miko I. et al. (2012) : On dorsal prothoracic appendages in treehoppers (Hemiptera : Membracidae) and the nature of morphological evidence – PlosOne, vol 7:1-12 (lien)
– Burrows M. (2013) : Jumping mechanisms of treehoppers (Hemiptera, Auchenorrhyncha, Membracidae) – The Journal of Experimental Biology, 216:788-799 (lien)
– Lin C.P. (2006) : Social behavior and life history of membrane treehoppers – Journal of Natural History, 40(32-34):1887-1907 (lien)
– Prud’homme B. et al. (2011) : Body plan innovation in treehoppers through the evolution of an extra wing-like appendage – Nature, vol473:83-86 (lien)
Sites internet à visiter :
– https://treehoppers.insectmuseum.org
Recommandation d’ouvrages sur cette thématique :
– Mutualism: Ants and their Insect Partners (Bernhard Stadler & Tony Dixon – Edition : Cambridge University Press – 248 pages – 7 avril 2008)







Bonjour,
Je me suis permis de mettre un lien vers votre très intéressante page sur les membracides à la suite de ma publication de quelques photos d’une larve de Stictocephala bisonia.
Bravo pou ce travail très documenté sur ces insectes si passionnants!
Merci beaucoup! 😉
Bonjour,
j’ai 16ans et je suis un passionné des Membracides. je part en Guyane en août et je voudrai savoir quels sont les meilleurs moyens pour pouvoir en observer dans cette jungle épaisse.
Merci d’avance pour votre réponse