Par Mathilde Capelli – Etty Colombel – Marine de Bodard – Hilal Tunca Cosic & Elisabeth Tabone
Un élevage du parasitoïde oophage européen Anastatus bifasciatus a été mis au point au Laboratoire Biocontrôle de l’Unité Expérimentale de la Villa Thuret (UEVT) d’Antibes. La production en continu de cet Hyménoptère parasitoïde nous permet tout d’abord d’étudier la biologie et le comportement de cet insecte, obtenant ainsi des données sur son cycle de vie en laboratoire. Différents hôtes de substitution ont ensuite été testés, pour essayer d’améliorer la production et la qualité de l’élevage d’A. bifasciatus. Cette optimisation permettra d’une part de répondre aux besoins expérimentaux de notre laboratoire, des partenaires et de l’ensemble de la communauté scientifique. Parallèlement, la production d’A. bifasciatus permettra d’envisager la mise en place de stratégies de lutte biologique contre les œufs de différents ravageurs (Paysandisia archon, Thaumetopoea pityocampa, Thaumetopoea processionea, Halyomorpha halys…).

Anastatus bifasciatus (Hyménoptère : Eupelmidae) est un parasitoïde polyphage indigène d’Europe (figure 1). Il est connu pour être un parasite des œufs du Bombyx disparate (Lymantria dispar) depuis les années 1920. En 1922 et 1923, des chercheurs ont trouvé des œufs du Bombyx disparate parasités par A. bifasciatus à Hyères (France), Madrid (Espagne), Dahlem (Allemagne) et Caltagirone (Sicile) (Crossman, 1925).
Cette espèce solitaire a été collectée sur des œufs d’Halyomorpha halys dans plusieurs pays d’Europe, puis mise en élevage sur ce même hôte (Haye et al.,2015 ; Costi et al., 2019 ; Stahl et al., 2019b). En plus d’H. halys, A. bifasciatus est capable de parasiter les œufs de différents Lépidoptères et Hétéroptères Européens, incluant plusieurs espèces préoccupantes pour la conservation de la biodiversité (Noyes, 2014 ; Stahl et al., 2018). Même si le taux de parasitisme naturel d’A. bifasciatus dans la nature est assez faible (Costi et al., 2019), cette espèce provoque un taux de mortalité importants des œufs hôtes, à la fois par son oviposition, mais aussi grâce à de l’host feeding (définition) (Stahl et al., 2019a).
L’équipe du Laboratoire Biocontrôle, rattachée à l’Unité Expérimentale de la Villa Thuret (UEVT) d’INRAE PACA, et localisé au Cap d’Antibes (06), travaille sur la mise en place de stratégies de lutte biologique contre des insectes ravageurs de plantes. Dans le cadre de différents projets, l’équipe travaille, entre autre, sur l’utilisation de macroorganismes parasitoïdes ou prédateurs pour lutter contre plusieurs ravageurs. Les parasitoïdes testés peuvent être oophages ou larvaires.
Dans le cas des parasitoïdes d’œufs, la larve se développe à l’intérieur de l’œuf de l’insecte-hôte, dont l’embryon est tué à un moment plus ou moins précoce de la vie larvaire du parasitoïde. Les parasitoïdes oophages tuent ainsi leur hôte avant que ce dernier puisse causer des dégâts (Bin, 1994) puisqu’ils devancent l’apparition du stade chenille.
C’est pourquoi l’utilisation d’Hyménoptères parasitoïdes constitue un des moyens de lutte biologique parmi les plus efficaces pour contrôler les ravageurs des cultures (Pintureau, 2009).
Etant indigène d’Europe et s’adaptant à des œufs de différentes tailles et différentes familles (Lépidoptères, Hétéroptères…), on peut penser qu’A. bifasciatus représente un candidat potentiel pour la lutte biologique contre d’autre ravageur des plantes. Il est donc important de mettre en place un élevage d’A. bifasciatus fonctionnel et efficace, puis d’essayer d’améliorer sa production et son efficacité dans l’optique d’une utilisation comme agent de biocontrôle, dans le cadre de plusieurs programmes de lutte biologique contre des ravageurs des plantes.

Conditions d’élevage
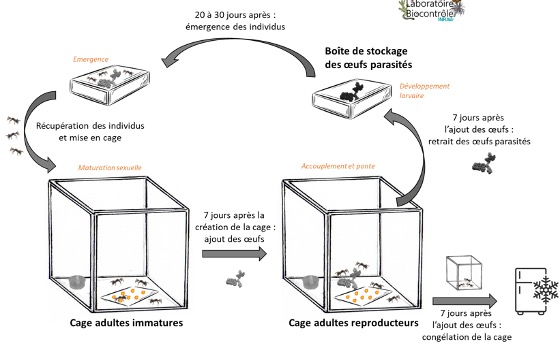
L’élevage d’A. bifasciatus est effectué dans une chambre climatique confinée, qui donne sur un sas étanche pour éviter toute sortie d’insecte. Les conditions climatiques de la salle d’élevage correspondent à une température de 25°C et à une humidité relative de 75%. Une photopériode de 16h jour et 8h nuit est appliquée, dans le but de respecter le cycle circadien d’A. bifasciatus. Tous les stades des insectes (œufs parasités, adultes immatures et adultes reproducteurs) se trouvent dans la même salle d’élevage, mais dans des boîtes et cages différentes (figure 5). Après utilisation, toutes les boîtes et les cages sont nettoyées à l’eau de Javel, bien rincées et mises à sécher. Les déchets des élevages sont placés en congélateur à -18°C au minimum une semaine, afin de limiter l’apparition de maladies pouvant affecter les élevages. Cela permet également d’éviter la contamination des autres salles du laboratoire, voire du milieu externe.
Elevage
Notre élevage d’A. bifasciatus a tout d’abord débuté suivant les consignes de Fisher et Jaccard (2016). Puis nous avons au fur-et-à-mesure optimisé et simplifié l’élevage, notamment en termes de temps de développement, de choix d’hôte de substitution, d’alimentation, et de manipulations. Notre élevage se déroule en respectant les différents stades de développement de l’insecte : larve, adulte immature, et adulte reproducteur.
- Stade larvaire
Les œufs parasités par les femelles A. bifasciatus sont placés dans des petites boîtes de développement fermées (de dimension 10.5cm x 6.5cm x 2.5cm) dont le couvercle est recouvert de grillage pour permettre l’aération (figure 3A). Du miel est étalé sur le couvercle en grillage pour permettre aux individus d’A. bifasciatus de se nourrir directement après leur émergence. Chaque boîte contenant une ponte correspond à un numéro unique, pour lequel est noté la période de ponte, le nombre et la date des œufs hôtes utilisés, ainsi que le nombre de femelles et de mâles d’A. bifasciatus présents dans la cage lors de la ponte. Toutes les petites boîtes contenant les œufs parasités sont placées dans une grosse boite (de dimension 36cm x 24cm x 14cm) saturée en eau et en sel dite « boîte à sel » (figure 3B). Cela permet de garder une humidité relative supérieure à 75%, qui est nécessaire pour le bon développement des embryons d’A. bifasciatus dans les œufs.
Tous les jours, le nombre de mâles et de femelles d’A. bifasciatus qui émergent de chaque boîte est noté. Les individus sont récupérés de la boîte de développement grâce à un aspirateur à bouche pour insectes (figure 3C). Cela permet de ne pas les manipuler avec les mains, et de les récupérer plus facilement car ils sont vifs très rapidement après leur émergence. Il est nécessaire de remettre du miel tous les jours car l’émergence des parasites s’étale sur une dizaine de jours.

- Stade adulte immature
L’émergence de tous les nouveaux individus provenant de la même ponte dure une dizaine de jours en moyenne. La majorité des adultes sortent les 2ème et 3ème jours d’émergence. A partir du 4ème jour, ce ne sont plus que quelques individus qui émergent au fur-et-à-mesure. Les mâles ont tendance à sortir les premiers, tandis que les femelles émergent plus tard.
Pour éviter la consanguinité, toutes les semaines les individus qui émergent simultanément des différentes boîtes de développement sont placés dans une même cage (de dimension 30cm x 30cm x 30cm) (« Cage Adultes immatures ») (figure 4A).
Dans cette cage, un flacon rempli d’eau avec un coton dentaire (tiges en coton ayant une capacité d’absorption par capillarité) est disposé pour que les individus puissent s’abreuver (figure 4B). Un morceau de feuille plastique avec des gouttes de miel bio déposées à l’aide d’une aiguille est également placé dans la cage pour que les individus puissent se nourrir (figure 4C). Il faut faire attention à la taille des gouttes de miel ; si elles sont trop grosses les individus risquent de s’y coller et d’y mourir.

- Stade adulte reproducteur
Sept jours après avoir émergés, les A. bifasciatus deviennent matures sexuellement. Des œufs de l’insecte hôte sont ainsi ajoutés dans la cage (qui devient la « Cage Adultes reproducteur »), pour permettre aux femelles d’y pondre. Les œufs sont collés sur une feuille de papier jaune avec du miel bio sur laquelle est notée la date de mise en ponte, la date de sortie de ponte, le nombre d’œufs hôte utilisés, ainsi que le nombre de femelles et de mâles d’A. bifasciatus présents dans la cage au moment de la ponte (figure 4D). Le nombre d’œufs à coller est dépendant du nombre de femelles présentes dans la cage : un ratio de 15 œufs hôte par femelle A. bifasciatus est nécessaire pour une production optimale et pour éviter le superparasitisme.
Bien que les femelles pondent pendant une quarantaine de jours, nous réduisons la période de ponte des femelles d’A. bifasciatus pendant une semaine. Cela nous permet de ne pas conserver des individus trop âgés, pour garder un élevage frais et efficace. Les cages des adultes reproducteurs contiennent toujours un abreuvoir et des feuilles en plastique avec les gouttes de miel, comme dans la cage des adultes immatures. Après la semaine de ponte, la « cage des adultes reproducteurs » est placée au congélateur avec les A. bifasciatus à l’intérieur.
Synthèse d’un cycle d’élevage
Cycle biologique
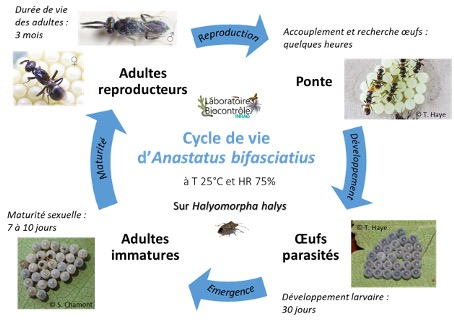
La mise en place de l’élevage d’A. bifasciatus sur des œufs d’H. halys nous a permis de déterminer son cycle de vie. En laboratoire, A. bifasciatus passe par 3 stades :
- Un stade larvaire qui dure environ un mois à l’intérieur d’œufs de lépidoptères ou d’hétéroptères
- Un stade adulte immature qui dure entre 7-10 jours
- Un stade adulte reproducteur avec une longévité de plus de 3 mois
Le cycle de développement d’A. bifasciatus de l’œuf à l’adulte, i.e., la maturation des embryons entre la ponte par la femelle adulte A. bifasciatus dans les œufs de l’hôte et l’émergence du nouveau parasite, dure en moyenne 30 jours sur des œufs d’H. halys (figure 6). En prenant en compte le temps de maturation de l’adulte émergeant, le cycle de vie total d’A. bifasciatus dure ainsi en moyenne 40 jours (de la ponte d’une femelle à la ponte de sa descendance). Les individus adultes peuvent ensuite vivre trois mois, voire plus, sur des œufs de H. halys frais, en condition optimale de laboratoire.
Optimisation de l’élevage sur différents hôtes de substitution
Dans la nature, Anastatus bifasciatus parasite les œufs de Lymantria dispar, un ravageur forestier qui n’est pas simple à élever à cause de sa diapause et de ses besoins en nourriture. Pour pouvoir mettre en place un élevage d’A. bifasciatus, nous avons donc besoin d’œufs-hôte de substitution de Lépidoptères et/ou d’Hétéroptères. L’hôte de substitution permet de faire l’intermédiaire entre l’élevage des ennemis naturels des ravageurs et les ravageurs eux-mêmes. Il permet également une production à grande échelle de ces auxiliaires (He et al., 2010), qui sont indispensables pour mettre en place des stratégies de lutte biologique contre les ravageurs.
L’hôte de substitution est sélectionné suivant plusieurs critères : le temps du cycle d’élevage, l’absence de diapause de l’hôte, la nourriture nécessaire, le prix du matériel d’élevage et des consommables, ainsi que la nature non-dangereuse de l’hôte (non allergisant ou urticant). De plus, les caractéristiques des parasitoïdes élevés dessus sont à prendre en compte (taux d’émergence, temps de développement, taux de parasitisme, longévité, fécondité…) ainsi que leur qualité (Bai et al.,1992 ; Corrigan & Laing, 1994).
Notre élevage d’A. bifasciatus a tout d’abord été effectué sur des œufs d’H. halys, car c’est sur les œufs de ce ravageur que nous avons obtenus nos premiers individus. Une comparaison a été effectuée sur différents œufs-hôtes dans le but d’optimiser l’élevage d’A. bifasciatus et le rendre le plus performant possible.
D’après Fisher et Jaccard (2016), la grande taille de la femelle d’A. bifasciatus la pousse à préférer des œufs-hôtes de volume important. Ainsi, si ces derniers sont de taille sub-optimale (cas des œufs de Nezara), et que la femelle n’a pas d’alternative, elle y dépose quand-même des œufs, mais non fécondés, ne produisant alors que des mâles. Nous avons ainsi essayé de faire pondre des individus sur des œufs de Philosamia ricini, le Bombyx eri, provenant de nos élevage (Capelli et al., 2023), ainsi que sur des œufs de Paysandisia archon, le papillon palmivore (figure 7).
Le but de ces expérimentations est d’optimiser l’élevage sur des œufs d’hôtes de plus en plus gros, pour augmenter la fitness (capacité d’un individu à se reproduire – valeur adaptative) des parasitoïdes comme cela a déjà été montré sur trichogrammes (Tabone et al., 2013).

Sur Paysandisia archon, les femelles d’A. bifasciatus sont capables de tuer les larves dans l’œuf. En effet, il est connu que la ponte A. bifasciatus s’accompagne d’une puissante envenimation qui tue l’embryon des œufs-hôtes, ce qui explique que ces derniers puissent être attaqués avec succès très peu de temps (1-2 jours) avant leur éclosion (Fisher et Jaccard, 2016). Cependant, sur P. archon, qui possède pourtant des œufs de grosse taille (environ 4-5mm de longueur), A. bifasciatus n’a pas réussi à effectuer un cycle complet, la descendance n’ayant pas émergée.
Plusieurs autres espèces de parasitoïdes oophages (Trichogramma sp., Ooencyrtus sp.) ont été testées et aucune n’a réussi à effectuer un cycle complet dessus (Capelli et al., 2019). Plusieurs hypothèses peuvent être avancées pour expliquer ceci (résistance des œufs de P. archon aux oeufs de parasitoïdes, sécrétions de toxines… Tiradon et al., 2013).
Nous avons ensuite comparé nos élevages sur les deux hôtes les plus intéressants : P. ricini et H. halys. Bien qu’H. halys soit moins touchée par les problèmes de consanguinité que d’autres espèces de punaises (comme par exemple Nezara viridula), les élevages d’Hétéroptères sont tout de même délicats à gérer dans le temps.
Dans le but de garder un élevage robuste, l’une des améliorations mises en place par notre équipe pour éviter la consanguinité est d’isoler les couples de chaque population.
L’objectif est de croiser les descendants issus de boîtes différentes (résultats non publiés). De plus, le fait de placer un couple par boîte permet également d’éviter le cannibalisme envers les œufs des congénères. Enfin, des individus provenant du terrain de temps en temps ont été régulièrement réinjectés dans les élevages pour augmenter le brassage génétique.
En revanche, l’élevage de P. ricini est plus simple que celui d’H. halys pour plusieurs raisons biologiques, économiques, écologiques et pratiques : l’absence de diapause, la disponibilité et le coût de la nourriture moindre (plante disponible dans la nature), le prix du matériel d’élevage et des consommables, le temps de développement est plus rapide, ainsi que la nature non-dangereuse de l’insecte pour la santé humaine comme pour l’environnement.
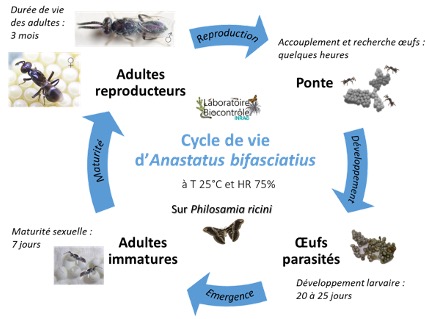
En effet, l’élevage de P. ricini étant plus simple, moins cher, et moins contraignant car il s’agit d’une espèce de laboratoire peu mobile, à la différence d’H. halys qui est un ravageur invasif non-indigène. Par ailleurs, il a été montré que, pour d’autres parasitoïdes oophages élevés sur P. ricini, leurs caractéristiques biologiques étaient meilleures (taux d’émergence, temps de développement, taux de parasitisme, longévité, fécondité ; Tunca Cosic et al., 2020). De plus, la taille des œufs de P. ricini, étant un peu plus grande que celle d’H. halys, on peut penser que cette espèce permettra d’apporter une grande quantité d’aliments. On sait également qu’un stockage au froid des œufs de P. ricini n’influence pas l’appétence de certains parasitoïdes oophages (Tunca Cosic et al., 2022). Enfin, A. bifasciatus élevé sur des œufs de P. ricini a un cycle de développement plus court (20-25 jours au lieu de 30 jours sur H. halys) et une préoviposition plus rapide (7 jours au lieu de 7-10 jours sur H. halys) (figure 8).
Conclusion
L’élevage d’A. bifasciatus au sein du laboratoire Biocontrôle de l’UEVT INRAE PACA répond aux différentes contraintes humaines, matérielles, et aux différents problèmes qui ont pu être rencontrés (alimentation, superparasitisme, …). L’utilisation du Lépidoptère P. ricini comme hôte de substitution apporte de nombreux avantages écologiques, économiques, de facilité et surtout d’efficacité.
Cet élevage garantit l’apport constant d’A. bifasciatus de bonne qualité, pour assurer une production sur du long terme. De plus, cela permet des expérimentations dans le cadre de plusieurs programmes de lutte biologique contre des insectes ravageurs (Paysandisia archon, Halyomorpha halys, Thaumetopoea pityocampae) ; bien qu’il soit nécessaire de faire des études complémentaires sur le terrain pour bien évaluer les risques environnementaux consécutifs à des lâchers inondatifs d’A. bifasciatus (ANSES, 2020).
Remerciements
Nous remercions Tim Haye du CABI en Suisse qui nous a envoyé des œufs d’Halyomorpha halys parasités par Anastatus bifasciatus pour démarrer notre élevage, et Serge Fisher, Agroscope Changins-Wädenswil, Switzerland pour ses judicieux conseils.
Autre exemple d’étude d’un parasitoïde : Cotesia typhae
Les auteures
 CAPELLI Mathilde – Docteure en sciences agronomiques, Mathilde a réalisé sa thèse au Cirad sur l’île de la Réunion sur l’alternance de production des fruitiers tropicaux, puis s’est spécialisée en entomologie et lutte biologique au Laboratoire Biocontrôle de l’INRAE UEVT à Antibes.
CAPELLI Mathilde – Docteure en sciences agronomiques, Mathilde a réalisé sa thèse au Cirad sur l’île de la Réunion sur l’alternance de production des fruitiers tropicaux, puis s’est spécialisée en entomologie et lutte biologique au Laboratoire Biocontrôle de l’INRAE UEVT à Antibes.
 COLOMBEL Etty – Technicienne en expérimentation à l’INRAE UEVT à Antibes, Etty est responsable des élevages des ravageurs et des auxiliaires, et spécialiste des trichogrammes.
COLOMBEL Etty – Technicienne en expérimentation à l’INRAE UEVT à Antibes, Etty est responsable des élevages des ravageurs et des auxiliaires, et spécialiste des trichogrammes.
 DE BODARD Marine – Ingénieure d’étude diplômée en horticulture à AgroCampus Ouest, Marine s’est spécialisée en lutte biologique au Laboratoire Biocontrôle puis dans le conseil en arbres d’ornements, notamment comme Télépilote de drone.
DE BODARD Marine – Ingénieure d’étude diplômée en horticulture à AgroCampus Ouest, Marine s’est spécialisée en lutte biologique au Laboratoire Biocontrôle puis dans le conseil en arbres d’ornements, notamment comme Télépilote de drone.
 TUNCA COSIC Hilal – Professeure associée à l’Université d’Ankara Faculté de l’Agricole, Département de la Protection des Plantes en Turquie, où elle a réalisé sa thèse sur les « Effets de certains extraits de plantes et d’insecticides sur le développement et le comportement parasitaire de Chelonus oculator Panzer (Hymenoptera : Braconidae), Bracon hebetor Say (Hymenoptera : Braconidae), Venturia canescens Grav. (Hymenoptera : Ichneumonidae) ».
TUNCA COSIC Hilal – Professeure associée à l’Université d’Ankara Faculté de l’Agricole, Département de la Protection des Plantes en Turquie, où elle a réalisé sa thèse sur les « Effets de certains extraits de plantes et d’insecticides sur le développement et le comportement parasitaire de Chelonus oculator Panzer (Hymenoptera : Braconidae), Bracon hebetor Say (Hymenoptera : Braconidae), Venturia canescens Grav. (Hymenoptera : Ichneumonidae) ».
 TABONE Elisabeth – Ingénieure de recherche à l’INRAE UEVT à Antibes et responsable de l’équipe du Laboratoire Biocontrôle, Elisabeth est spécialisée dans la recherche de solutions innovantes pour la protection des plantes et des forêts contre les chenilles défoliatrices, à l’aide de macro-organismes prédateurs ou parasites.
TABONE Elisabeth – Ingénieure de recherche à l’INRAE UEVT à Antibes et responsable de l’équipe du Laboratoire Biocontrôle, Elisabeth est spécialisée dans la recherche de solutions innovantes pour la protection des plantes et des forêts contre les chenilles défoliatrices, à l’aide de macro-organismes prédateurs ou parasites.

Elisabeth Tabone – Mathilde Capelli – Etty Colombel – Marine de Bodard
Bibliographie
- ANSES (2020). https://www.anses.fr/fr/system/files/ANASTATUSB_MO18-017_Ans.pdf
- Bai, B., Luck, R. F., Forster, B., & Janssen, J. A. M. (1992). The effect of host size on quality attributes of the egg parasitoid, Trichogramma pretiosum. Entomologia Experimentalis et Applicata, 64, 37–48 (lien)
- Capelli, M., Venard, M., Huguet, M., Colombel, E., Tabone, E. (2019). Biocontrôle de Paysandisia archon, en prévention de l’extension des attaques de Rhynchophorus ferrugineus sur palmiers. Presented at 11. Congrès de l’AMPP – La protection des Plantes : face aux défis actuels et en perspectives, Rabat, MAR (2019-03-26 – 2019-03-27) (lien)
- Capelli, M., De Bodard, M., Colombel, E., Tabone, E. (2023). Techniques d’élevage d’un hôte de substitution : Philosamia ricini, le Bombyx eri. NOV’AE, (13) (lien)
- Corrigan, J. E., & Laing, J. E. (1994). Effects of the rearing host species and the host species attacked on performance by Trichogramma minutum Riley (Hymenoptera: Trichogrammatidae). Environmental Entomology, 23, 755–760 (lien)
- Costi, E., Haye, T., & Maistrello, L. (2019). Surveying native egg parasitoids and predators of the invasive Halyomorpha halys in Northern Italy. Journal of Applied Entomology, 143, 299–307 (lien)
- Crossman, S. S. (1925). Two imported egg parasites of the gipsy moth, Anastatus bifasciatus Fonsc and Schedius kuvanae Howard. Journal of Agricultural Research, 30, 643–675.
- Fisher, S. et Jaccard, G. (2016). Méthode d’élevage des parasitoïdes oophages Anastatus bifasciatus et Trissolcus basalis sur punaises Pentatomidae. AGROSCOPE Entomologie.
- Haye, T., Fischer, S., Zhang, J., & Gariepy, T. (2015). Can native egg parasitoids adopt the invasive brown marmorated stink bug, Halyomorpha halys (Heteroptera: Pentatomidae), in Europe? Journal of Pest Science, 88, 693–705 (lien)
- He, L. M., Jiao, R., Xu, C. X., Hao, B. F., & Yu, L. C. (2010). Review on Substitute Host of Natural Enemies of Pests. Journal of Hebei Agricultural Sciences, 4.
- Noyes, J. (2014). Universal Chalcidoidea Database – World Wide Web Electronic Publication. Natural History Museum Update August. http://www.nhm.ac.uk/our-science/data/chalcidoids/.
- Pintureau, B. (2009). La lutte biologique et les Trichogrammes : application au contrôle de la pyrale du maïs, p.262. Le Manuscrit, Paris, France.
- Stahl, J. M., Babendreier, D., & Haye, T. (2018). Using the egg parasitoid Anastatus bifasciatus against the invasive brown marmorated stink bug in Europe: can non-target effects be ruled out? Journal of pest science, 91, 1005–1017 (lien)
- Stahl, J. M., Babendreier, D., & Haye, T. (2019a). Life history of Anastatus bifasciatus, a potential biological control agent of the brown marmorated stink bug in Europe. Biological Control, 129, 178–186 (lien)
- Stahl, J. M., Gariepy, T. D., Beukeboom, L. W., & Haye, T. (2019b). A molecular tool to identify Anastatus parasitoids of the brown marmorated stink bug. Entomologia Experimentalis et Applicata, 167, 692–700 (lien)
- Tabone, E., Buradino, M., Colombel, E., Salignon, M., Fourcade, A., Ganivet, J., & Martin, J. C. (2013). Un parasitoïde oophage pour contrôler Paysandisia archon (Burmeister): Le Trichogramme. Proceeding AFPP–ZNA. Toulouse, France (lien)
- Tiradon, M., Bonnet, A., Khanh, H. D. T., Colombel, E., Buradino, M., & Tabone, E. (2013). Evaluation of a new biological pest control method against the palm borer, Paysandisia archon using oophagous parasitoids. In AFPP–Palm pest mediterranean conference (lien)
- Tunca Cosic, H., Cosic, B., Colombel, E. A., Venard, M., Capelli, M., & Tabone, E. (2020). Performance of Ooencyrtus kuvanae (Hymenoptera: Encyrtidae) on two host species, Halyomorpha halys and Philosamia ricini. Journal of Applied Entomology, 144, 961–967 (lien)
- Tunca Cosic, H., Cosic, B., Venard, M., Capelli, M., Colombel, E. A., & Tabone, E. (2022). Effects of different Philosamia ricini (Lepidoptera: Saturniidae) cold storage periods on Ooencyrtus pityocampae and Ooencyrtus kuvanae (Hymenoptera: Encyrtidae) rearing. Bulletin of Entomological Research, 112, 667–673 (lien)




