par Laure Kaiser-Arnaud & Taiadjana Fortuna
Cotesia typhae Fernandez-Triana (Hymenoptera, Braconidae) est un Hyménoptère d’Afrique sub-saharienne, parasitoïde des chenilles de Sesamia nonagrioides Lefebvre (Lepidoptera, Noctuidae). Ces chenilles mangent l’intérieur des tiges de nombreuses espèces de plantes du groupe des Poales. Originaire d’Afrique, ce papillon ravage le maïs dans les pays du Sud de l’Europe, dont la France.
Suite de l’article du 23 mars 2020 : lien
Efficacité de C. typhae contre la sésamie du maïs : traits d’histoire de vie, mécanismes de virulence, facteurs de différentiation et essais sous serre
Plusieurs échantillons de C. typhae ont pu être collectés au Kenya et multipliés en élevage à l’ICIPE et au laboratoire EGCE de Gif-sur-Yvette. L’efficacité de souches du parasitoïde, provenant de différentes localités kenyanes a pu être étudiée sur des populations africaine et française de sésamie (Kaiser et al., 2017 ; Benoist et al., 2017). Différents traits d’histoire de vie ont été caractérisés : les adultes vivent en moyenne 3 jours à 25°C ; les femelles sont prêtes à pondre dès l’accouplement ; elles parasitent 2 à 3 chenilles pendant leur courte vie si elles ne sont pas tuées avant par ces dernières, qui se défendent.
La durée du développement larvaire endoparasite est de 13-14j à 25°C et celui du développement nymphal, en cocon de soie tissé hors de l’hôte, de 7-8j à cette température. La fécondité réalisée est en moyenne d’une centaine de descendants, dont environ 70% de femelles. Des différences de succès de parasitisme des chenilles françaises ont été observées selon la provenance géographique des parasitoïdes.
Ainsi les souches en provenance de l’Ouest du Kenya se sont avérées les plus virulentes, parasitant avec succès 70 à 95% des chenilles, le reste formant normalement des chrysalides.
Nous avons approfondi l’étude sur une souche de l’Ouest et une du Sud Kenya, très contrastées par leur virulence envers les sésamies françaises, car des variations intra-spécifiques de phénotypes permettent d’une part d’en rechercher les variations physiologiques et génétiques sous-jacentes, et d’autre part d’explorer les facteurs écologiques et les scénarios évolutifs de la différentiation.
Le genre Cotesia, comme tous ceux de la sous-famille des Microgastrinae, doivent leur virulence à un partenaire singulier, appelé bracovirus. Comment cela fonctionne-t-il ?
L’ADN de ces guêpes parasites renferme des séquences d’origine virale, acquises par transfert horizontal chez l’ancêtre de la sous famille, probablement lors du développement de la larve parasite dans une chenille infectées par un nudivirus. Chez la guêpe ces séquences sont fonctionnelles car elles encodent des protéines de capsides, mais seulement dans un tissu particulier. En effet la production des capsides n’a lieu que dans des cellules des calyces qui sont les oviductes latéraux où sont stockés les ovocytes à maturité. Étonnamment, des segments d’ADN portant les gènes de virulence, d’origine « Hyménoptère » et non virale, sont répliqués conjointement à la production des capsides, à l’intérieur desquelles ils se retrouvent capturés, sous forme circularisée.
Ces curieuses particules virales, dites bracovirus ou polyDNAvirus (PDV), forment un fluide laiteux (calyx fluid) autour des œufs et le tout est injecté dans la chenille au moment de la ponte, avec également le venin produit par la glande à venin qui s’ouvre dans l’oviducte. A l’intérieur de la chenille hôte, les bracovirus deviennent infectieux : ils infectent les cellules de nombreux tissus de l’hôte et utilisent la machinerie cellulaire de ce dernier pour produire massivement des protéines de virulence. Ces dernières appartiennent à plusieurs familles connues et inconnues et quelques fonctions ont pu être caractérisées, notamment l’inactivation de la réponse immunitaire de la chenille aux œufs parasites, et la dérégulation de son métabolisme au bénéfice du parasite (Pennacchio et Strand 2006) (figure 1).
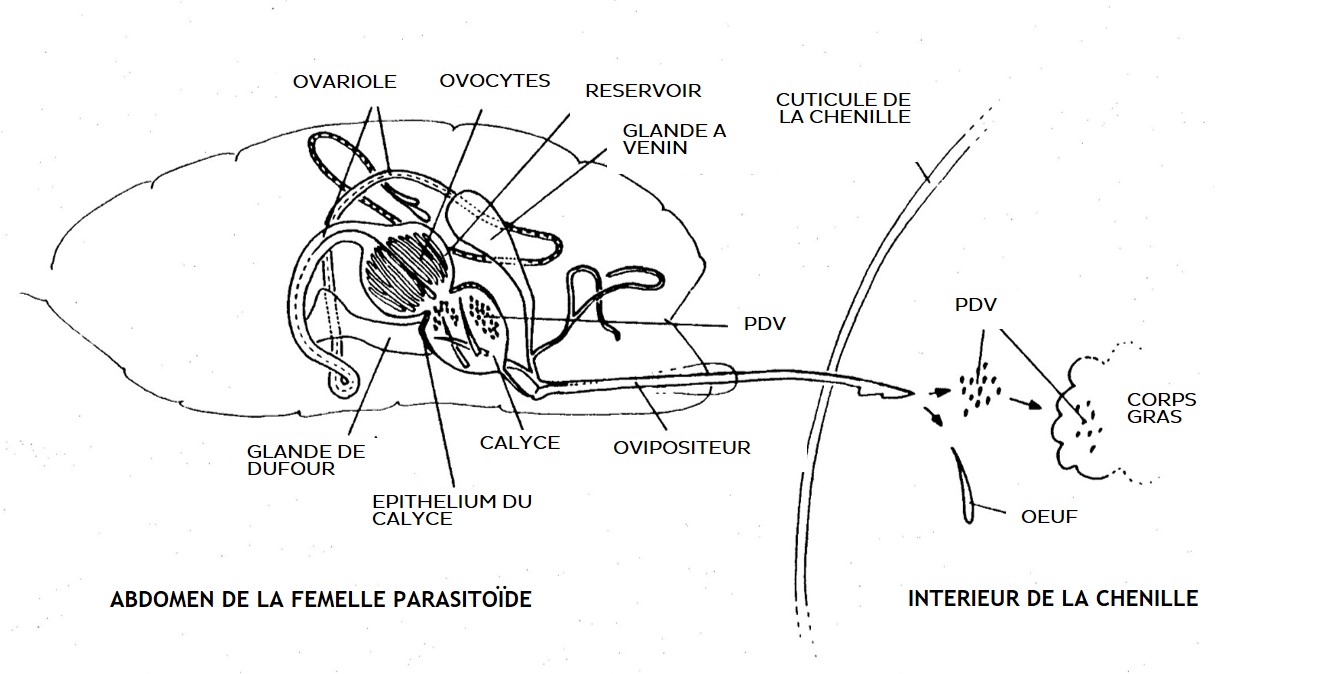
- La différence de virulence observée entre les C. typhae de l’Ouest et le Sud du Kenya viendraient-elles de leurs bracovirus ? En particulier de la quantité de particules injectées ? Non car nous avons pu l’estimer et elle ne diffère pas d’une souche à l’autre (Benoist et al, 2019).
- De l’expression des gènes de virulence véhiculés dans la chenille par les particules ? Cela a pu être vérifié pour deux gènes parmi 150 connus (Benoist et al., 2017), donc l’étude de l’expression des gènes de virulence devra être beaucoup plus exhaustive.
- De mutations se répercutant sur l’activité des protéines de virulence ? C’est possible car des régions génomiques portant des gènes de virulence, et également des gènes de venin, sont différenciées entre les deux souches de la guêpe parasite et expliquent une partie de la variation du phénotype de virulence (Benoist et al., à paraître en 2020).
Mais pourquoi y-aurait-il des variations génétiques de la virulence entre les deux populations de C. typhae ?
Chez les parasites, la virulence évolue en réponse à des changements de la résistance de l’hôte et réciproquement, c’est ce qu’on appelle la co-évolution. Ainsi, une différence de résistance entre les populations Ouest et Sud Kenyane de sésamies pourrait expliquer la différence de virulence entre les populations parasitoïdes respectives. Nous avons élevé les deux populations de sésamies africaines, les avons exposées chacune aux deux souches de C. typhae, et avons pu confirmer cette hypothèse d’adaptation locale.
L’origine de la différence de résistance des sésamies Ouest et Sud Kenyanes est inconnue. Nous avons de plus observé que les sésamies de l’Ouest avaient un niveau de résistance à C. typhae comparable aux sésamies françaises, ce qui peut expliquer pourquoi la souche Ouest kenyane de C. typhae est bien virulente sur l’hôte français, au contraire de la souche Sud kenyane (Benoist et al. 2019).
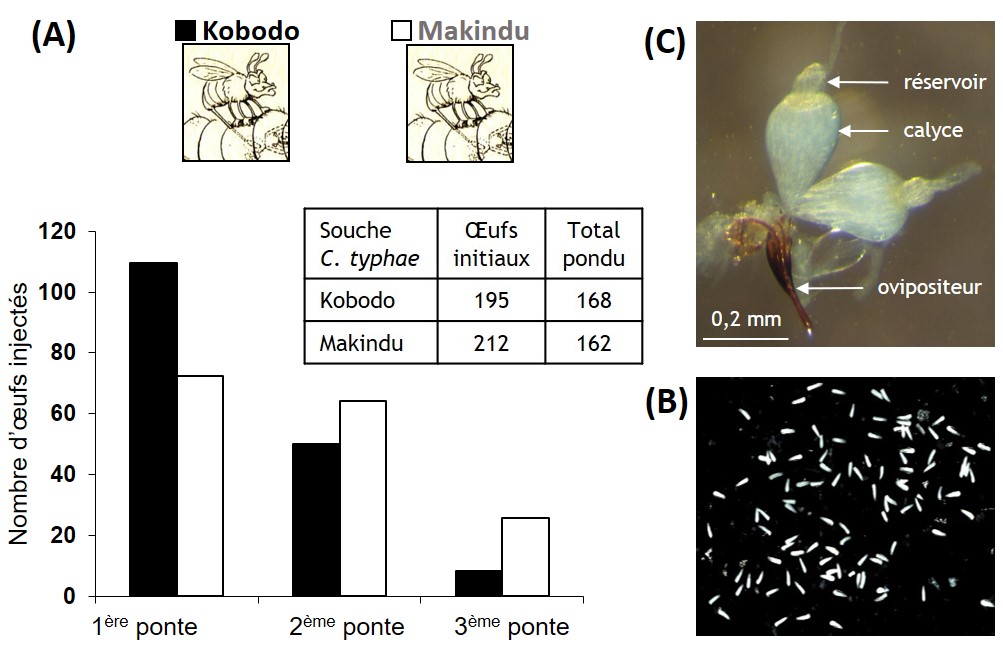
Outre la variation de virulence, nous avons observé une différence de stratégie de ponte, celle de la souche Ouest de C. typhae étant de type « tous les œufs dans le même panier », c’est-à-dire qu’elle dépose la majorité de ses œufs dans la première chenille rencontrée, alors que la souche Sud les répartit plus également entre les 2-3 chenilles qu’elle parasite. Cette différence reflète celle de la ressource en hôtes dans les localités d’origine : à l’Ouest un mélange d’espèces de chenilles et de plantes réduirait la probabilité de rencontrer la bonne association (S. nonagrioides sur Typha), d’où l’avantage reproducteur à beaucoup pondre dans la première chenille hôte rencontrée, alors que dans la localité Sud, cette association est dominante et la probabilité qu’une guêpe parasite trouve plusieurs chenilles d’affilée serait élevée (figure 2 ci-dessus)).
La connaissance des traits d’histoire de vie et du comportement de la guêpe parasite nous a permis de paramétrer un essai sous serre pour estimer leur efficacité parasitaire sur des parterres expérimentaux de maïs infestés de façon contrôlée par différents stades larvaires (collaboration avec l’Institut Arvalis). Nous avons estimé le nombre de cocons de nymphose de C. typhae à introduire compte-tenu de leur sexe-ratio, du nombre de chenilles parasitées par femelle et du nombre de chenilles présentes.
Dans les conditions choisies, un premier essai a montré que le parasitoïde avait entraîné la mortalité de 50% des chenilles. Un second essai est en cours d’analyse. Beaucoup d’inconnues limitent la prédiction d’une efficacité au champ, comme la réaction des parasitoïdes à des variations de températures, et de densité et stades de l’hôte. Une inconnue est la durée d’action qu’aurait un lâcher de parasitoïdes, sachant que le cycle de C. typhae est de trois semaines, et celui de la sésamie de 8 semaines. Théoriquement ce serait possible dans la mesure où les sésamies pondent pendant 3-4 semaines d’affilée au cours d’une génération, entraînant la présence de chenilles en continue sur la culture de maïs (figure 3).
Cet étalement temporel du stade larvaire devrait permettre la reproduction de générations successives de C. typhae. De plus, introduire un échantillonnage de C. typhae à des stades de développement différents pourrait permettre d’éviter des discontinuités importantes de la présence d’adultes parasitoïdes. Nous espérons pouvoir développer un modèle mathématique pour simuler le couplage des phénologies de l’hôte et du parasitoïde et la dynamique de leur population, afin de simuler l’efficacité de différentes modalités de lâchers de C. typhae.

Risques environnementaux potentiels de l’introduction de C. typhae dans l’environnement français
En raison d’éventuels risques environnementaux posés par l’introduction de macro organismes exotiques à des fins de lutte biologique, plusieurs pays dont la France (en 2012) ont réglementé ce type d’introduction. Le risque à évaluer en premier lieu est celui de prédation ou parasitisme d’espèces non-cibles. Un avantage des Hyménoptères du genre Cotesia est leur importante spécificité, liée à leur biologie d’endoparasites de larves d’insectes.
Comme expliqué plus haut, leur développement nécessite l’inactivation de la réponse immunitaire de la larve hôte et la manipulation de sa physiologie et de son comportement, et les défenses mises en place par l’hôte et leur contournement par le parasitoïde génèrent un processus de co-évolution entraînant des adaptations locales caractérisées par des associations hôte-parasite très spécifiques. C. typhae n’a été trouvée que sur S. nonagrioides, et ce, quand sa chenille se développe sur une plante du genre Typha (la massette), et plus rarement de Cyperus.

Cette spécificité a été constatée même quand d’autres espèces de chenilles étaient présentes dans la localité, voir sur la même plante. Toutefois en France les Typha (T. latifolia et T. angustifolia) sont colonisées par des espèces de chenilles qui ne sont pas présentes en Afrique, et il est donc important de savoir dans quelle mesure C. typhae pourrait les parasiter.
Pour évaluer plus largement les espèces que C. typhae serait susceptible de parasiter, nous avons considéré toutes les espèces de la même sous-tribu que S. nonagrioides, les Apameina, et vivant en foreurs de plantes de la même niche écologique que les massettes : le roseau commun (Phragmites australis), les joncs (Juncus effusus), le rubanier (Sparganium emersum), et les carex. Douze espèces répondent à ces critères sur le territoire français, dont deux seulement sur Typha : Nonagria typhae et Globia sparganii. Toutes ces Apameina ont en commun d’être univoltines (diapause embryonnaire), ce qui limite la période de présence des chenilles aux mois de mai et juin.
Nous avons réalisé 3 campagnes de collecte de terrain, principalement dans deux régions où le maïs est à la fois infesté par la sésamie (Thibord, 2017) et à proximité de peuplements de Typha et de roselières : l’Ouest du Marais Poitevin et l’estuaire de la Gironde. Nous avons pu ramener au laboratoire dix des douze espèces, en effectifs très variables (figure 4 ci-dessus et figure 5 ci-dessous).

Les identifications ont été faites par séquençage du marqueur moléculaire COI. La démarche préconisée est séquentielle (Van Lenteren et al., 2003) : on présente d’abord la chenille « sur un plateau » à la guêpe parasite ; si celle-ci y pond et s’y développe, on recherche alors si la guêpe la préfère en situation de choix avec l’espèce cible. Si c’est le cas, on cherchera à estimer la capacité de la guêpe à localiser la chenille non cible dans sa plante, à distance, etc… Ce sont donc des recherches potentiellement de longue haleine, car il n’est pour l’instant pas possible d’élever ces insectes au laboratoire en ayant plusieurs générations par an.
Nous avons pu présenter cinq espèces de chenilles en nombre suffisant à C. typhae : Globia sparganii et Nonagria typhae, les nonagries du rubanier et de la massette, toutes deux trouvées sur Typha ; Archanara neurica et Lenisa geminipuncta trouvées sur phragmites, et Coenobia rufa trouvée sur jonc. La guêpe a accepté de pondre dans une proportion variable de chenilles selon les espèces, mais nous n’avons pu estimer la probabilité qu’elle s’y développe car les chenilles, parasitées ou non, meurent prématurément faute de s’alimenter correctement sur leurs plantes hôtes coupées. Il faudra cultiver ces dernières.
Nous avons toutefois pu observer un comportement encourageant : quand les adultes de C. typhae sont nés en présence d’une tige de maïs portant des traces de la sésamie (déjections, galerie), ils préfèrent ensuite fortement l’odeur d’une tige de maïs infestée par la chenille de sésamie à celle d’une tige de Typha infestée par une chenille de G. sparganii.

Ces observations ont été faites dans un « olfactomètre », appareil dans lequel l’insecte peut faire un choix entre deux flux d’air de débit identique mais diffusant des odeurs distinctes (figure 6 ci-contre). Comme C. typhae serait introduite dans des parcelles de maïs infestées de sésamies, les femelles auraient cette expérience, et comme elles ne vivent que quelques jours et ne pondent que 2-3 fois, la probabilité qu’elles quittent le champ de maïs et arrivent à localiser et parasiter d’autres chenilles sur Typha, Phragmites ou jonc paraît très faible. Nous envisageons toutefois de caractériser les capacités de dispersion de ce petit parasitoïde, au Kenya puisqu’il n’est pas possible de le faire en France ou en Europe.
Un autre élément important de l’estimation du risque environnemental est le risque d’établissement (qui peut aussi être considéré comme un bénéfice pour les espèces dont on espère l’acclimatation). En effet si l’insecte établit des populations pérennes, le risque pour les espèces non cibles augmenterait et d’autres risques liés à la colonisation de niches écologiques apparaîtraient, comme la compétition avec d’autres ennemis naturels de la sésamie du maïs.
L’hiver est le principal obstacle à l’établissement d’organismes strictement tropicaux comme C. typhae. En Europe la sésamie passe l’hiver au stade de chenille hibernante, dans une logette creusée à la limite entre la tige et le pivot racinaire. Une étude commence pour établir l’incidence de températures hivernales sur C. typhae en développement dans des sésamies en état physiologique de diapause. Des données antérieures acquises sur une espèce sœur, C. chilonis, également tropicale, indiquent que l’hiver entraînerait une létalité quasi-totale, et que les rares adultes naîtraient au début du printemps, où les chenilles propices au parasitisme ne sont pas encore présentes (Galichet et al, 1982).
Enfin, l’estimation de l’efficacité de C. typhae contre S. nonagrioides et la faisabilité de la méthode sont aussi des composantes du dossier de demande d’introduction de C. typhae dans l’environnement français car la décision d’autorisation ou non repose sur une analyse des risques et bénéfices.
Ces données d’évaluation du risque environnemental, acquises en premier lieu pour constituer ce dossier, vont aussi permettre un inventaire faunistique des Lépidoptères foreurs de tiges de Poales en milieu humide, et de leurs ennemis naturels (notamment mouches tachinaires, Ichneumons). De plus les données d’incidence d’une gamme de températures sur le développement, la survie et la fécondité de C. typhae vont permettre de calibrer le modèle de simulation de la phénologie du parasitoïde, et de mieux appréhender son efficacité potentielle au champ.
Conclusion
Compte-tenu de la complexité, la diversité et la capacité d’adaptation du vivant, nous savons que le risque zéro n’existe pas. Idéalement il faudrait cultiver autrement, de façon à ce que des équilibres entre phytophages et parasitoïdes, prédateurs, pathogènes… limitent la nuisibilité des ravageurs. Mais ces solutions sont et seront d’abord appliquées à très petite échelle. Or le besoin d’une méthode de lutte biologique contre la sésamie du maïs en grande culture est très actuel. Sachant que le maïs est une culture introduite, et que la sésamie est venue d’Afrique (il y a 174 000 ans, Kergoat et al. 2015) sans ses parasitoïdes, en introduire un paraît une solution adaptée à cet écosystème d’origine exotique !
Les auteuresLaure Kaiser-Arnauld : Ingénieure agronome de formation, Laure s’est consacrée dès son doctorat à l’étude des Hyménoptères parasitoïdes, en particulier à leur comportement d’adaptation à l’hôte et à leur spécificité parasitaire, à l’INRA puis au CNRS où elle a participé au tournage du film de Claude Julie Parisot « Les nouveaux guerriers des champs » (Arte 2016) et où elle dirigé l’Unité Mixte de Recherche Evolution, Génomes, Comportements et Ecologie (EGCE) Taiadjana Fortuna : écologue passionné par la nature a fait sa formation dans différents pays, au Portugal, au Canada et aux Pays Bas où elle a réalisé son doctorat à l’Université de Wegeningen. Depuis ses études de master, elle s’intéresse au monde des parasitoïdes et leur utilisation comme agents de lutte biologique. Elle est actuellement ingénieure de recherche IRD dans le pôle écologie à EGCE et est responsable avec Laure Kaiser-Arnauld de l’étude des risques environnementaux posés éventuellement par l’introduction de C. typhae en France. |
Bibliographie récente
- Benoist R. et al. (2017) : Relationship between oviposition, virulence gene expression and parasitisme success in Cotesia typhae parasitoid strains. Genetica, 145:469-479 (lien)
- Benoist R. et al. (2019) : Role of egg-laying behavior, virulence and local adaptation in a parasitoid’s chances of reproducing in a new host. Journal of Insect Physiology (120) (lien)
- Kaiser L. et al. (2017) : Systematics and biology of Cotesia typhae (Braconidae), a potential biological control agent against the noctuid Mediterranean corn borer, Sesamia nonagrioides. Zookeys (682):105-136 (lien)
- Kaiser L. et al. (2017) : Relationship between oviposition, virulence gene expression and parasitism success in Cotesia typhae nov. sp. parasitoid strains. Genetica, 145:469-479 (lien)
- Kergoat G.J. et al. (2015) : Integrative taxonomy reveals six new species related to the Mediterranean corn stalk borer Sesamia nonagrioides (Lepidoptera Noctuidae). Journal of the Linnean Society (175):244-270 (lien)
- Thibord J.B. (2017) : Evaluation of crop losses due to pests on maize production in France. Ecologie chimique, pp137-147 (lien)
Ouvrages sur cette thématique
- La lutte biologique: Vers de nouveaux équilibres écologiques (Sciences en partage) (Lydie Suty – Editions Quae – 516 pages – 17 mars 2010)
- Le jardinier-maraîcher – Manuel d’agriculture biologique sur petite surface (Jean-Martin Fortier – Editions Ecosociété – 238 pages – 13 janvier 2016)
- Le sol, la terre et les champs – Pour retrouver une agriculture saine (Claude Bourguignon & Lydia Bourgugnon – Sang Terre Editions – 246 pages – 29 mai 2015)





