Par Joel Meunier

Il existe une vingtaine d’espèces de perce-oreilles en France (aussi appelés pince-oreilles ou encore forficules selon les régions), dont la plus fréquente est le Perce-oreille commun Forficula auricularia. Cet insecte appartient à l’ordre des Dermaptères, qui compte environ 1700 espèces dans le monde et dont la morphologie est caractérisée par un corps souvent allongé se terminant par deux pinces rigides (Photo 1 ci-contre). Les femelles ont des pinces droites qui sont utilisées comme des ciseaux lorsqu’elles défendent leurs œufs et juvéniles contre les petits prédateurs, alors que les mâles ont des pinces recourbées en forme de crochets principalement utilisées pour effrayer les prédateurs et plaire aux femelles.

Contrairement à ce que leur taille laisserait penser, ces pinces ne sont pas les meilleures armes des perce-oreilles. En effet, ces derniers sont capables de projeter des composés chimiques à l’odeur âcre sur leurs agresseurs à partir de glandes présentes sur le dos (Photo 2 ci-contre). Les pinces et ces composés sont inoffensifs pour l’Homme et il convient de préciser dès maintenant que les perce-oreilles ne percent (ou ne pincent) pas non plus nos oreilles et qu’ils n’y rentrent pas lorsque l’on prend du bon temps sur l’herbe. Leur nom, d’ailleurs, vient très probablement de la forme des pinces des mâles qui rappelle celle de nos oreilles.
Si l’Homme n’a rien à craindre du Perce-oreille commun, ce n’est pas le cas des ravageurs de cultures. Le perce-oreille est en effet une espèce omnivore et grande prédatrice, capable de s’attaquer à de nombreux champignons, vers, chenilles et autres insectes ravageurs présents dans les cultures, notamment les vergers (Malagnoux et al., 2015).
Cycle de vie
Le cycle de vie de ce perce-oreille est relativement long pour un insecte et permet donc aux cultivateurs de profiter de ses effets sur le long-cours. Emergeant généralement au début du printemps, les adultes forment des groupes mixtes (mâles et femelles) atteignant plusieurs centaines d’individus. Les perce-oreilles étant nocturnes, ces groupes se forment principalement du lever jusqu’à la tombée du jour et offrent à leurs membres un large choix de partenaires sexuels.
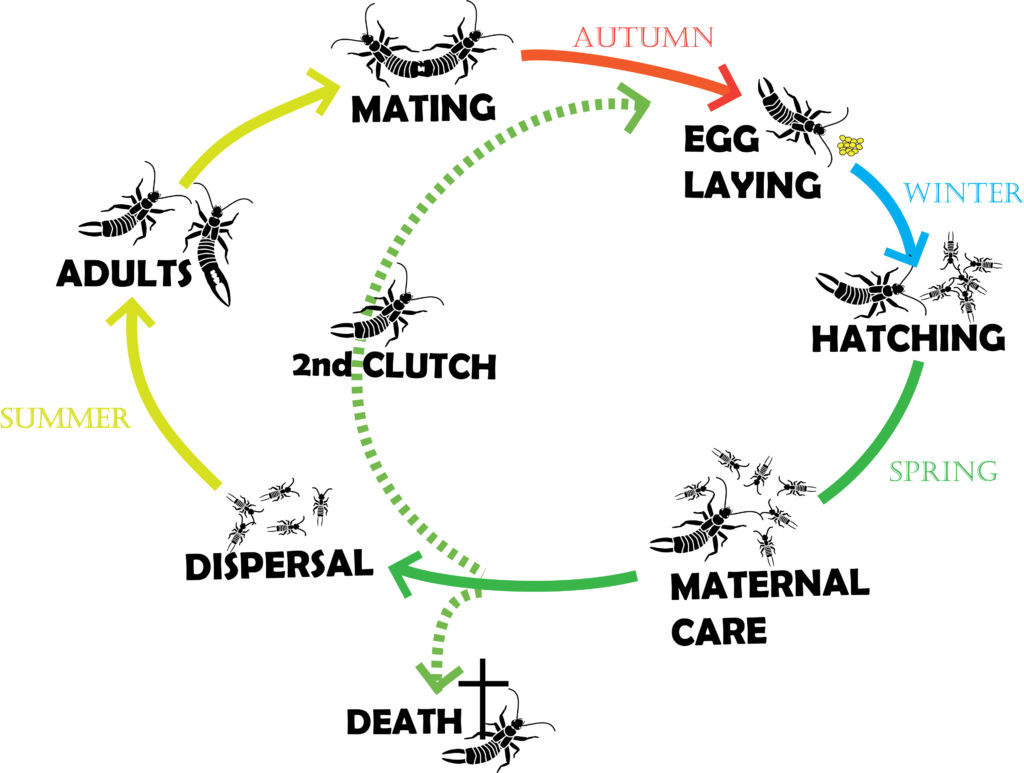
Ainsi chez cette espèce, les femelles et les mâles peuvent avoir jusqu’à 5 partenaires (Sandrin et al., 2015). Au début de l’automne, les femelles s’isolent et partent à la recherche d’un nid. Ce dernier, d’architecture assez rudimentaire, est soit creusé par la femelle directement dans le sol, soit consiste en l’utilisation opportuniste d’une cavité déjà présente sous l’écorce d’un arbre ou dans la terre. Les mâles, s’ils essaient de les suivre, sont rapidement chassés par les femelles, car ils ont tendance à consommer les œufs. Une première couvée d’environ 30 œufs (mais il peut y en avoir une centaine) est pondue au début de l’hiver (Photo 3) et les femelles s’occupent jusqu’à leur éclosion au printemps. Les femelles vont ensuite rester avec leurs juvéniles pendant plusieurs semaines (Photos 4 & 5 ci-dessous).

Ces derniers vont enfin partir du nid pour former de nouveaux groupes sociaux, et passer par quatre mues successives (une cinquième ayant lieu au moment de l’éclosion de l’œuf (article sur l’origine de la métamorphose – lien) avant de devenir des adultes. Certaines des femelles, quant à elles, vont pondre une deuxième couvée qui éclora avant l’été (Meunier et al., 2012). Les mâles meurent en général pendant l’hiver et ont donc une durée de vie de 6 mois, alors que les femelles meurent au cours de l’été suivant et ont donc une durée de vie de 12 mois.
Il est important de noter que la phénologie présentée ici reflète ce que l’on trouve généralement en Europe, mais qu’elle dépend fortement du continent et des conditions environnementales des populations étudiées. Cette espèce originaire d’Europe a en effet été introduite accidentellement dans de nombreux pays il y a une centaine d’année. Elle est aujourd’hui présente sur tous les continents grâce à une grande capacité d’adaptation aux contraintes climatiques locales (Tourneur and Meunier, 2020).
Des études génétiques montrent aussi que l’espèce Forficula auricularia serait un complexe d’au moins deux espèces sœurs, morphologiquement indiscernables et dont nous ne savons que très peu de choses sur les différences de cycle de vie et de comportements (Wirth et al., 1998).
Soins maternels

Les femelles du Perce-oreille commun passent donc une grande partie de leur vie à s’occuper de leurs œufs et de leurs juvéniles. Cette vie de famille est assez unique chez les insectes, où les parents ne s’occupent que très rarement de leurs petits et, lorsqu’ils le font, ne s’en occupent que peu de temps et de façon sommaire (Wong et al., 2013). Un autre élément particulièrement intéressant de leur vie de famille est qu’elle est facultative. Les jeunes ont en effet des capacités de déplacement précoces et peuvent aller chercher de la nourriture quelques jours seulement après avoir éclos (Wong and Kölliker, 2012).
Les jeunes ne souffrent pas particulièrement de l’absence de leur mère et nos études expérimentales en laboratoire montrent que retirer la mère dès l’éclosion des œufs n’induit pas de surmortalité et semble même être associée à une meilleure croissance des juvéniles (Thesing et al., 2015). Il semblerait donc que, contrairement à la grande majorité des espèces animales avec une vie de famille, les juvéniles du Perce-oreille commun aient la possibilité d’adopter une vie solitaire ou une vie familiale.
Cette espèce nous offre ainsi une chance exceptionnelle de mieux comprendre ce qui a promu le passage de la vie solitaire à la vie de famille au cours de l’évolution en étudiant pourquoi les juvéniles (ou leur mère) décident de rester en groupe ou de vivre seul.
Pourquoi les juvéniles restent-ils en famille ?
La réponse pourrait être assez simple : à cause des bénéfices que les petits tirent des soins maternels. Par exemple, les femelles perce-oreilles apportent de la nourriture à leur petits en ramenant des morceaux de feuilles, de fruits ou de cadavres dans le nid, ou alors en régurgitant de la nourriture par la bouche (un peu comme le fait une grande majorité d’oiseaux), ou enfin par coprophagie, c’est-à-dire en produisant des fèces dans le nid qui seront ensuite consommés par les juvéniles (Staerkle and Kölliker, 2008).

Les femelles perce-oreilles protègent aussi leurs petits contre les microbes et elles le font d’une manière assez inattendue. Leurs fécès ont en effet des propriétés antimicrobiennes capables de limiter le développement d’une grande diversité de micro-organismes (Diehl et al., 2015). Ces mères utilisent donc ces propriétés en couvrant le nid de leurs fèces pour lutter ainsi contre la présence de microbes.
Nos études récentes suggèrent néanmoins que rester avec leur mère peut être une stratégie risquée pour les juvéniles chez le Perce-oreille commun. En effet, lorsque les conditions sont mauvaises et que la nourriture vient à manquer, nous avons montré que les mères avaient tendance à monopoliser toute cette nourriture pour elles seules, ce qui entrainait une surmortalité et un retard de développement importants chez leurs petits (Meunier and Kölliker, 2012). Monopoliser la nourriture permet aux mères de maximiser leur chance de produire une deuxième couvée à un moment où les conditions seront peut-être meilleures (Kramer et al., 2017).
D’autres études ont aussi montré que les mères perce-oreilles s’occupent en priorité des petits qui sont en meilleure santé et délaissent les petits dont la condition est la moins bonne (Mas and Kölliker, 2011). Ces résultats révèlent que les soins maternels ne sont pas inconditionnels chez cette espèce et que les petits les plus faibles ne bénéficient que peu de ces soins et donc de la présence de leur mère. Enfin, il faut bien conserver à l’esprit que pour un juvénile, la vie de famille ne consiste pas uniquement à interagir avec ses parents mais aussi avec ses frères et sœurs.

Ces interactions sont souvent conflictuelles chez les animaux et chez le Perce-oreille commun, elles peuvent prendre une forme particulièrement extrême : le cannibalisme (Dobler and Kölliker, 2010) (photo 6 ci-contre). Il est ainsi fréquent que les juvéniles se mangent les uns les autres sans que leur mère ne mette fin à ce comportement pour le moins définitif. Dans l’ensemble, rester en famille avec sa mère n’est donc pas toujours une option sans frais pour les juvéniles de ce perce-oreille.
Du point de vue des petits, la vie de famille chez les animaux est souvent vue comme le résultat d’un savant mélange de bénéfices associés aux soins parentaux et de coûts liés à la compétition avec les frères et sœurs. Le Perce-oreille commun ne semblait pas déroger à cette règle. Pourtant, nos récent travaux démontrent que cette vision est incomplète, car des formes de coopération existent au sein des fratries et apportent leur lot de bénéfices pour les juvéniles. En particulier, les juvéniles du Perce-oreille commun sont capable d’aller chercher de la nourriture rapidement après l’éclosion des œufs puis d’échanger cette nourriture les uns avec les autres pendant la vie de famille (Falk et al., 2014).
Cet échange se fait par trophallaxie proctodéale (c’est-à-dire par contacts bouche-anus) ou par coprophagie, lorsque les frères et sœurs déposent leur fèces dans le nid. Ce qui est intéressant, c’est que ces échanges sont plus élevés dans les familles où les mères s’occupent moins de leur couvée (Kramer et al., 2015). Il y aurait donc un phénomène de compensation de la part des juvéniles, qui s’entraident plus lorsque les mères sont les moins efficaces. Ces résultats sont particulièrement intéressants parce qu’ils apportent une vision nouvelle dans notre compréhension de l’émergence ou du maintien de la vie de famille au cours des générations.
Moteur évolutif de la vie de famille ?
En effet, ils suggèrent qu’une des raisons pour lesquelles les juvéniles restent avec leur famille pourrait venir des bénéfices qu’ils obtiendraient des interactions avec leurs frères et sœurs plutôt que des bénéfices (facultatifs) qu’ils tireraient des interactions avec leur mère.
Dans un contexte plus large, le soin maternel ne serait donc pas nécessairement le principal moteur évolutif de la vie de famille (une idée pourtant bien présente dans la littérature sur ce sujet), mais plutôt un moteur parmi d’autres (Kramer and Meunier, 2019). Ces récentes découvertes sur la biologie du Perce-oreille commun démontrent donc qu’étudier cette espèce offre un éclairage nouveau sur de grandes questions de la biologie telles que celle de l’évolution de la vie de famille chez les animaux.
Outre sa vie de famille, un autre trait particulièrement intéressant chez le Perce-oreille commun est le soin des mères envers leurs œufs. Les femelles adoptent en effet une stratégie surprenante qui consiste à produire des œufs avant l’hiver puis à s’en occuper continuellement pendant plusieurs semaines, en s’enfermant dans leur nid et en arrêtant toute autre activité (dont la recherche de nourriture). Pendant ces semaines d’isolement, les mères passent un temps considérable à nettoyer leurs œufs (entre leurs mandibules) et lorsqu’on empêche ces contacts de façon expérimentale, les œufs ne se développent pas.
Ce nettoyage permet d’abord aux femelles d’enlever la moisissure qui entraînerait autrement la mort prématurée des œufs (Boos et al., 2014). Le nid offre en effet un microclimat humide idéal pour le développement des moisissures. Le nettoyage des œufs permet aussi aux femelles de déposer des molécules chimiques (des hydrocarbures) ayant à la fois des propriétés antimicrobiennes et des propriétés physiques augmentant leur résistance contre la dessiccation (Boos et al., 2014). Ce comportement de soin ne dépend pas uniquement de la présence des moisissure (ou autres microbes) sur les œufs, mais aussi de la présence de microbes dans l’environnement (Diehl and Meunier, 2018).
Les femelles du perce-oreille sont donc capables d’évaluer les risques microbiens dans l’environnement et d’adapter leurs soins aux œufs en fonction. Une belle preuve d’anticipation !

Chez le Perce-oreille commun, les soins envers les œufs semblent si essentiels pour leur développement que les femelles en prodiguent à tous les œufs qu’elles rencontrent, sans distinction. Il en va des œufs des autres femelles de la même espèce (Van Meyel et al., 2019), des œufs d’une autre espèce de perce-oreille (Boos et al., 2015) voire même de billes de verres ayant vaguement la forme d’un œuf de perce-oreille (Boos et al., 2014). L’accès à ces œufs (ou billes) étrangers ne se fait pas en condition naturelle, mais ces données nous permettent de mettre en lumière qu’aucun mécanisme de reconnaissance maternel n’est mis en place – ou tout du moins utilisé – par les mères de cette espèce.
Ce résultat était assez surprenant, car les soins aux œufs sont généralement coûteux pour les femelles – surtout lorsqu’elles n’ont pas accès à de la nourriture pendant cette longue période – et il est donc important qu’elles s’assurent que leur dépense d’énergie ne profite pas à d’autres femelles ou espèces qui parasiteraient leur nid en y déposant leurs œufs.
Pourquoi est-ce que les femelles Perce-oreilles ne rejettent pas les œufs étrangers ?
Nos récents résultats apportent un premier élément de réponse à cette question. Ils montrent en effet que les mères perce-oreilles ne font pas que s’occuper de leurs œufs pendant ces semaines s’isolement, mais parfois qu’elles en mangent (Koch and Meunier, 2014) ! Et cette consommation est d’autant plus grande que la couvée inclut beaucoup d’œufs. Accepter un grand nombre d’œufs – qu’ils soient les leurs ou non – pourrait donc permettre aux femelles d’avoir accès à une plus grande réserve de nourriture pour affronter l’hiver et ainsi d’augmenter leurs chances de produire une deuxième ponte après l’éclosion de la première. Des études sont en cours pour chercher à comprendre les raisons de cette consommation des œufs et l’importance de cette stratégie surprenante dans la biologie de cette espèce.
Conclusion
Alors que les travaux sur la vie de famille du Perce-oreille commun commencent à nous livrer quelques secrets surprenants, de nouvelles questions se posent sur la biologie des autres Dermaptères et notamment sur leur vie de famille. Cet ordre d’insecte est en effet très (trop) peu étudié et nous n’avons aujourd’hui qu’une connaissance rudimentaire de la biologie d’une petite dizaine d’espèces (sur plus de 1700 connues !), elle-même souvent basée sur des observations anecdotiques de seulement quelques individus.
Étudier ces autres espèces nous permettrait, par exemple, de déterminer si cette vie de famille est un caractère commun à tous les Dermaptères ou si elle n’a évolué (ou a été perdue) que chez certaines espèces – et pourquoi c’est le cas.
De la même manière, ces études nous permettraient d’explorer le rôle de l’environnement (biotique ou abiotique, tel que la présence de pesticides ou de perturbateurs endocriniens) et notamment des changements globaux actuels dans l’évolution de la vie de famille et inversement, de tester l’importance de cette vie de famille dans la résistance des espèces face à ces changements.
Enfin, ces études pourraient ouvrir de nouvelles pistes de recherche sur la bonne utilisation des perce-oreilles dans la lutte biologique contre les ravageurs de culture, quel que soit le continent et le type de culture, une alternative potentielle aux pesticides qui pourrait se montrer particulièrement efficace. Alors, pourquoi donc ne pas se retrousser les manches et s’intéresser de plus près à cet ordre encore bien trop négligé ?
Espèce remarquable de Dermaptère : Allodahlia scabriuscula

Site de référence sur les Dermaptères : http://dermaptera.speciesfile.org/HomePage/Dermaptera/HomePage.aspx
Joel Meunier Joel Meunier est Chargé de recherche CNRS à l’Institut de Recherche sur la Biologie de l’Insecte (IRBI) – UMR 7261-CNRS – Université de Tours. Il étudie l’évolution de la vie sociale chez les insectes et s’intéresse à la vie de famille du forficule européen depuis une dizaine d’année. |
Bibliographie
- Boos S. ; Meunier J. ; Pichon S. & Kölliker, M. (2014) : Maternal care provides antifungal protection to eggs in the European earwig. Behavioral Ecology 25, 754–761 (lien)
- Boos S, ; Röllin L. ; Wong J. W. Y. & Kölliker M. (2015) : Maternal transfer of cuticular hydrocarbons? Evidence from between-species cross-fostering experiments in earwigs. Journal of Insect Behavior (lien)
- Diehl J. M. C. & Meunier J. (2018) : Surrounding pathogens shape maternal egg care but not egg production in the European earwig. Behavioral Ecology 29, 128–136 (lien)
- Diehl J. M. ; Körner M. ; Pietsch, M. & Meunier J. (2015) : Feces production as a form of social immunity in an insect with facultative maternal care. BMC Evolutionary Biology 15, 15:40 (lien)
- Dobler R. & Kölliker M. (2010) : Kin-selected siblicide and cannibalism in the European earwig. Behavioral Ecology 21, 257–263 (lien)
- Falk J. ; Wong J. W. Y. ; Kölliker M. & Meunier J. (2014) : Sibling cooperation in earwig families provides insights into the early evolution of social life. The American Naturalist 183, 547–557 (lien)
- Koch L. K. & Meunier J. (2014) : Mother and offspring fitness in an insect with maternal care: phenotypic trade-offs between egg number, egg mass and egg care. BMC evolutionary biology 14, 125 (lien)
- Kramer J. et al. (2017). When earwig mothers do not care to share: Parent-offspring competition and the evolution of family life. Functional Ecology 31, 2098–2107. (lien)
- Kramer J. & Meunier J. (2019). The other facets of family life and their role in the evolution of animal sociality. Biological Reviews 94, 199–215. (lien)
- Kramer J. ; Thesing J. & Meunier J. (2015). Negative association between parental care and sibling cooperation in earwigs: a new perspective on the early evolution of family life? Journal of Evolutionary Biology 28, 1299–1308. (lien)
- Malagnoux L. et al. (2015). Management strategies in apple orchards influence earwig community. Chemosphere 124, 156–162. (lien)
- Mas F. & Kölliker M. (2011). Differential effects of offspring condition-dependent signals on maternal care regulation in the European earwig. Behavioral Ecology and Sociobiology 65, 341–349. (lien)
- Meunier J. & Kölliker M. (2012). When it is costly to have a caring mother: food limitation erases the benefits of parental care in earwigs. Biology Letters 8, 547–550. (lien)
- Meunier J. et al. (2012). One clutch or two clutches? Fitness correlates of coexisting alternative female life-histories in the European earwig. Evolutionary Ecology 26, 669–682. (lien)
- Sandrin L. ; Meunier J. et al. (2015). Multiple paternity and mating group size in the European earwig, Forficula auricularia. Ecological Entomology 40, 159–166. (lien)
- Staerkle M. & Kölliker M. (2008). Maternal food regurgitation to nymphs in earwigs (Forficula auricularia). Ethology 114, 844–850. (lien)
- Thesing J. ; Kramer J. ; Koch L. K. & Meunier J. (2015). Short-term benefits, but transgenerational costs of maternal loss in an insect with facultative maternal care. Proceedings of the Royal Society B: Biological Sciences 282, 20151617. (lien)
- Tourneur J. & Meunier J. (2020). Variations in seasonal (not mean) temperatures drive rapid adaptations to novel environments at a continent scale. Ecology. (lien)
- Van Meyel S. ; Devers S. & Meunier J. (2019). Love them all: mothers provide care to foreign eggs in the European earwig Forficula auricularia. Behavioral Ecology 30, 756–762. (lien)
- Wirth T. et al. (1998). Molecular and reproductive characterization of sibling species in the european earwig (Forficula auricularia). Evolution 52, 260. (lien)
- Wong J. W. Y. & Kölliker M. (2012). The effect of female condition on maternal care in the European earwig. Ethology 118, 450–459. (lien)
- Wong J. W. Y. ; Meunier J. & Kölliker M. (2013). The evolution of parental care in insects: the roles of ecology, life history and the social environment. Ecological Entomology 38, 123–137. (lien)






Super article, merci.