Par Tony Robillard
Les grillons forment un groupe d’insectes Polynéoptères appartenant à l’ordre des Orthoptères et au sous-ordre des Ensifères. Comme beaucoup d’Ensifères, ils se caractérisent par la faculté des mâles à produire des signaux de communication, émis à l’aide de structures spécialisées portées par leurs élytres (ailes antérieures rigidifiées). Cet appareil stridulatoire leur permet de produire des sons servant généralement à attirer la femelle pour la reproduction.
Ces insectes sont principalement tropicaux ; on n’en trouve que quelques espèces en France métropolitaine, bien qu’ils peuplent beaucoup de laboratoires de biologie et d’animaleries, où ils servent de nourriture aux NAC (nouveaux animaux de compagnie) en tous genres… De ce fait, seule une poignée d’espèces de grillons a fait l’objet de nombreuses études portant sur la communication acoustique, la sélection sexuelle, ou le fonctionnement du système nerveux. Mais cette apparente familiarité, pour le public comme pour le biologiste, dissimule une grande diversité, souvent méconnue, chez ces insectes dont on connaît près de 5 000 espèces (Cigliano et al. 2021).
Cette diversité résulte de leur longue histoire évolutive (lien), car on estime l’origine des grillons à environ 250 millions d’années (Song et al. 2015). Cette diversité touche non seulement leur morphologie, mais aussi leurs habitats, leurs comportements et leurs émissions sonores.
Les représentants de la sous-famille Eneopterinae constituent la parfaite illustration de cette diversité, ce qui fait d’eux un groupe modèle depuis une vingtaine d’années pour des études portant sur l’évolution de la communication et sur la diversification, notamment en milieu insulaire (Nouvelle-Calédonie, en Asie du Sud-Est).
Caractéristiques morphologiques et diversité phénotypique
Les Eneopterinae sont des grillons dont la taille varie entre un et cinq centimètres. Ils possèdent peu de caractéristiques exclusives permettant de les différencier des autres grillons, mais ils sont toutefois reconnaissables par un ensemble de caractères morphologiques et anatomiques incluant :
- La forme générale de la tête, plus haute que large en vue de face, avec des yeux développés latéralement
- Les éperons portés par les tibias de la troisième paire de pattes : quatre éperons internes et quatre éperons externes sur la face dorsale, trois éperons apicaux internes et trois externes, le médian étant le plus long dans les deux cas. Des épines sont présentes sur la partie dorsale du tibia postérieur au-dessus et entre les éperons subapicaux
- La présence d’un coussinet adhésif sur la face ventrale du second article des tarses : ce caractère également présent chez d’autres groupes de grillons a conduit jusqu’à récemment à une certaine confusion quant à la définition des contours de la sous-famille
- Les organes tympaniques sur le tibia de la première paire de pattes : chez la plupart des Eneopterinae, les tympans de la face interne sont recouverts par un repli de cuticule ne laissant apparaitre la membrane tympanique que par une mince fente longitudinale
- L’ovipositeur de la femelle, bien développé et aplati latéralement
Hormis ces quelques caractéristiques communes, les Eneopterinae sont diversifiés en formes, tailles et colorations, ainsi que dans la structure de leurs pièces génitales mâles, organe très utilisé en systématique des grillons et différent d’un groupe d’espèces à l’autre.
Pour ne s’intéresser qu’à quelques exemples contrastés des phénotypes de ces grillons (figure 1), citons les Lebinthus, généralement petits, bruns, trapus et brachyptères, rappelant les grillons des bois (Nemobius sylvestris) ; le genre Nisitrus, mince, jaune vif et noir, muni d’ailes transparentes ; Paranisitra, cousin de ce dernier, mais aptère, tacheté de brun et de jaune, aux pattes fines et allongées, une bande jaune barrant sa face ; ou encore Cardiodactylus, souvent plus grand, aux longs élytres généralement ornés de patrons spécifiques de taches jaunes ou blanches.

Vidéo de Cardiodactylus palawan
Ecologie
Ces grillons vivent le plus souvent dans des milieux forestiers, mais on trouve certaines espèces dans les lisières ou dans des milieux plus ouverts tels que les savanes africaines ; quelques espèces australiennes sont également distribuées dans des zones plus tempérées et certaines sont même connues de milieux semi-désertiques. Certains d’entre eux s’accommodent fort bien de milieux dégradés, voire semi-urbains, et colonisent fréquemment cultures, friches et jardins :ils sont très communs dans les parcs au milieu de grandes agglomérations telles que Singapour ou Kuala Lumpur (Robillard, 2011; Robillard & Tan, 2013; Ming Kai Tan & Robillard, 2014).
En termes d’habitats, la plupart des espèces vivent près ou dans la litière, sur des plantes basses ou des arbustes, et quelque fois sur le tronc de plus gros arbres ou dans des litières aériennes. De rares espèces se rencontrent en milieu herbacé, comme celles du genre Xenogryllus, notamment dans les savanes africaines (Jaiswara et al. 2019a). Comme chez la plupart des grillons, les Eneopterinae ont en général un habitat d’activité, où les mâles s’exposent pour émettre leur chant d’appel, et un habitat de refuge, où ils se dissimulent en dehors des heures d’activité et où les couples se livrent à de longues séquences de copulation.
De même, si l’on définit la période d’activité des grillons comme le moment durant lequel le mâle émet le chant d’appel, certains Eneopterinae sont strictement diurnes (ex : espèces des genres Eneoptera et Nisitrus qui chantent dès le matin), d’autres sont nocturnes (ex : genres Agnotecous, Xenogrylllus, Ponca) ou crépusculaires (certaines espèces de Salmanites et de Cardiodactylus). Des données en cours d’analyse semblent indiquer que chaque espèce possède une séquence d’activité bien particulière, avec parfois plusieurs pics d’activité par 24h (Tan & Robillard, en préparation).
Vidéo de Paranisistra longipes
Systématique & Classification
Les Eneopterinae comptent environ 250 espèces décrites, réparties dans une vingtaine de genres. Leur nombre est en constante augmentation a doublé depuis 20 ans (on comptait 120 espèces en 2000), ce qui devrait se poursuivre en même temps que l’exploration taxonomique dans ce groupe. En effet, en comptant les nouvelles espèces identifiées dans les collections ou récemment collectée, mais qui n’ont pas encore été décrites, la sous-famille compterait déjà près de 300 espèces.
La phylogénie du groupe se montre assez stable à travers les différentes versions qui ont été publiées jusqu’à présent (Robillard et Desutter-Grandcolas 2004 ; Nattier et al. 2011 ; Vicente et al. 2017) (figure 2). On y distingue cinq tribus monophylétiques, objet de révisions taxonomiques et d’enrichissements régulier, ce qui conduit notamment à la découverte de nouveaux genres et de nouvelles espèces (eg. Robillard et al., 2014 ; Jaisawara 2018, 2019).
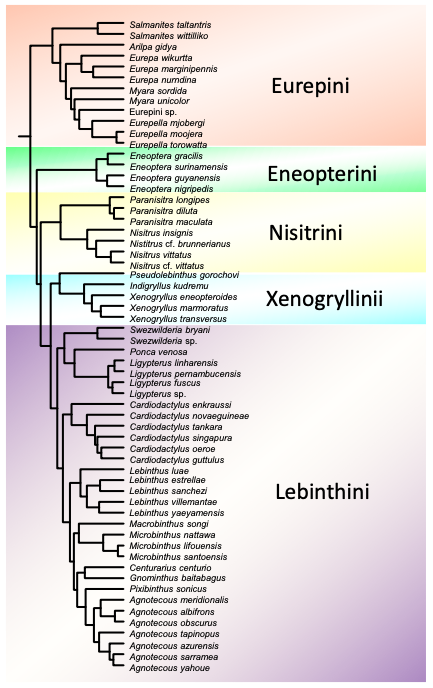
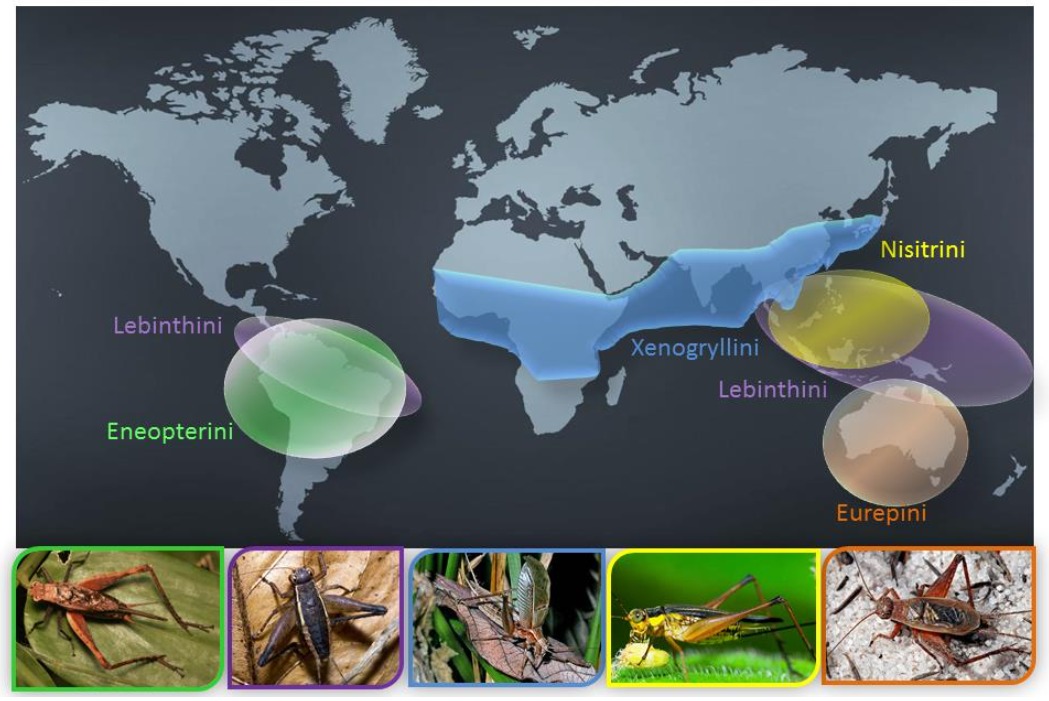
Ces tribus montrent une grande cohérences avec la répartition mondiale des Eneopterinae et se distribuent ainsi (figure 3) : 1) la tribu Eurepini, endémique d’Australie, se place en groupe frère du reste de la sous-famille ; 2) divergent ensuite les Eneopterini, endémiques d’Amérique du Sud et d’Amérique centrale ; 3) les Nisitrini comprennent des espèces d’Asie du Sud-Est ; 4) les Xenogryllini sont distribués en Asie continentale et en Afrique subsaharienne ; 5) et les Lebinthini, qui sont les plus diversifiés, sont présents à la fois en Asie et dans les archipels du Pacifique Ouest, mais également en Amérique du Sud.
Diversité des signaux de communication et des mécanismes de production du son
L’étude des mécanismes de production des signaux de communication représente une étape importante pour comprendre le rôle de la communication dans la biologie des espèces, mais aussi pour appréhender son rôle dans l’évolution.
Des modes de communication divers sont connus chez les grillons, car ces insectes utilisent à la fois des signaux acoustiques, vibratoires, phéromonaux, visuels et tactiles. La communication intraspécifique à longue distance est cependant quasi exclusivement assurée par les signaux acoustiques, les autres modes de communication intervenant à courte distance, principalement lors de la reproduction.
De par son rôle, le chant d’appel a généralement une longue portée. Il est émis de manière répétée durant la phase d’activité du mâle, ce qui représente parfois des heures de chant consécutives. Ce chant assure un rôle dans la reconnaissance spécifique avant l’accouplement (barrière précopulatoire) et possède ainsi le plus souvent des caractéristiques propres à chaque espèce. Le chant d’appel est à la fois mieux connu (enregistrements facilités par son intensité et son émission fréquente) et plus distinct (paramètres de reconnaissance spécifique) que le reste du répertoire, c’est pourquoi il est le plus propice aux analyses comparatives. Les autres chants du répertoire des espèces interviennent à plus courte distance dans le cadre d’interactions entre le mâle et la femelle (chant de cour, chant inter-copulatoire, chant de garde) ou entre mâles (chant d’agressivité).
Le chant des grillons est émis par le mâle uniquement mais il est perçu chez les deux sexes par deux paires de tympans situés sur les tibias des pattes antérieures (figure 4). Le mécanisme de stridulation a été étudié en détail durant les dernières décennies, principalement chez quelques espèces de la sous-famille des Gryllinae (Gryllus bimaculatus, Acheta domesticus, Teleogryllus oceanicus) (e.g. Bennet-Clark, 1989; Elliott & Koch, 1985; Koch et al. 1988; Montealegre-Z et al. 2009). Ces études, et en particulier les plus récentes qui ont recours à des techniques de vibrométrie laser et de mesure des mouvements des ailes à haute vitesse, ont permis d’affiner la connaissance du mécanisme de production du son et des contraintes qui s’y exercent. A partir de ces connaissances, il est possible d’analyser des mécanismes qui diffèrent des espèces modèles, tant par la structure que par le fonctionnement.
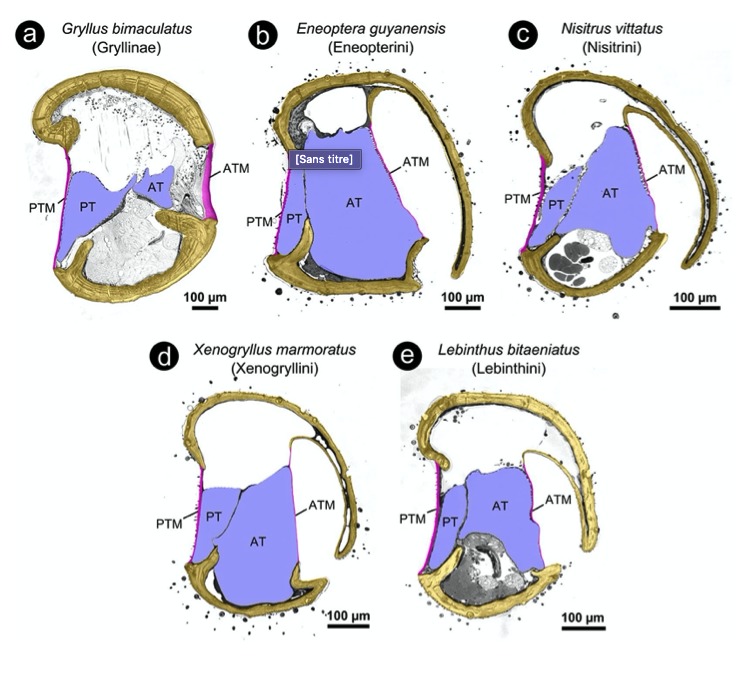
Une grande partie des précédents travaux de bioacoustique sur les grillons Eneopterinae a ainsi consisté à explorer la diversité de leurs chants d’appel en tenant compte du contexte phylogénétique et du système de production du son (Robillard & Desutter-Grandcolas 2011: Robillard et al. 2013, 2015).
Parmi les conclusions tirées de ces travaux, les Eneopterinae présentent une grande diversité rythmique que l’on retrouve chez d’autres groupes de grillons [un aperçu de cette diversité peut être écoutée sur le site de la sonothèque du muséum : https://sonotheque.mnhn.fr/?q=Gryllidae&start=100.
Un autre aspect méconu de l’évolution de la communication acoustique chez les grillons est sa disparition pure et simple chez un nombre important de lignées de ces insectes. Des telles pertes de communication acoustique issues de convergences évolutives sont connues chez les Eneopterinae, à tel point que chaque tribu au sein de la sous-famille en compte un exemple différent. Chez certaines lignées, la faculté à produire des sons disparait mais les ailes et la capacité à voler persistent, comme chez le genre Swezwilderia ; chez d’autres les ailes sont entièrement perdues, comme chez Paranisitra, tandis que chez l’espèce Pseudolebinthus lunipterus, c’est à la fois l’appareil stridulatoire et les tympans auditifs qui ont été perdus (Salazar et al. 2020) au sein d’un genre énigmatique d’espèces africaines produisant des signaux à hautes fréquences à l’aide d’élytres fortement modifiés (Robillard et al. en prép) (figure 5).

Jusqu’à présent, la principale originalité bioacoustique de ces grillons est cependant qu’ils ont développé à plusieurs reprises une communication acoustique à hautes fréquences, parfois ultrasonore, ce qui est supposé être à l’origine d’une radiation adaptative chez la tribu Lebinthini (Robillard & Desutter-Grandcolas 2004a). En 2004, quand cette tribu a été érigée, on ne disposait d’un enregistrement acoustique que pour quatre espèces sur la vingtaine alors connues. L’analyse de ces premières données révéla que ces espèces utilisaient des signaux à hautes fréquences, et que, contrairement aux autres grillons, leur fréquence dominante correspondait à un harmonique de la fréquence fondamentale (Robillard & Desutter-Grandcolas, 2004a; Robillard, Grandcolas & Desutter-Grandcolas, 2007).
Aujourd’hui les Lebinthini constituent la tribu d’Eneopterinae qui a le plus augmenté en nombre de taxons au cours des deux dernières décennies, puisque d’une quinzaine d’espèces pour trois genres, ils sont passés à près de 150 espèces réparties dans 19 genres (davantage si l’on compte les taxons encore non décrits). Très vite, il s’est avéré que toutes les nouvelles espèces découvertes appartenant à ce clade produisaient des signaux à hautes fréquences. Ainsi, au fil des descriptions taxonomiques, on a pu documenter chez les Lebinthini des signaux dont la fréquence dominante du chant peut être le premier, le second ou le troisième pic harmonique, avec des valeurs de fréquences dépassant de loin la limite des ultrasons (20 kHz).
Le record de plus haute fréquence connue pour un chant de grillon est ainsi détenu par l’espèce Pixibinthus sonicus Anso & Robillard de Nouvelle-Calédonie, qui émet un long trille constitué de milliers de syllabes à une fréquence avoisinant 30 kHz (Anso et al. 2016) [pour « l’écouter » : https://sonotheque.mnhn.fr/?q=pixibinthus.
Découverte d’un nouveau système de communication
Le système de communication des grillons est principalement connu à travers l’étude approfondie de quelques espèces archétypes de la sous-famille Gryllinae, qui utilisent des chants à basses fréquences et à partir duquel on extrapole des généralités sur l’ensemble du groupe en dépit de la diversité morphologique et acoustique avérée. L’archétype du système de communication des grillons est donc le suivant (figure 6A) :
Le mâle, statique, émet un chant d’appel à basse fréquence (environ 5 kHz) ; en réponse à l’appel du mâle, la femelle se déplace et s’oriente à l’aide du son uniquement (phonotaxie) jusqu’à finalement trouver le mâle. D’un point de vue neurologique, la perception du chant est opérée par un neurone auditif appelé AN1 sensible aux basses fréquences. Chez ces espèces, les stimuli à hautes fréquences (>10 kHz) sont perçus par un autre neurone auditif (AN2) et provoquent un réflexe de fuite immédiat en lien avec la prédation par les chauves-souris, car certaines utilisent leurs signaux d’écholocation (ultrasons) pour repérer leurs proies (e.g. Weber & Thorson 1989, Wyttenbach et al.1996). Autrement dit, il est assez surprenant que les Lebinthini utilisent comme signaux de communication intraspécifique des signaux généralement perçus par les femelles grillons comme des signaux de prédateurs. C’est ce constat qui a été à la base des recherches visant à comprendre comment ces grillons communiquaient à l’aide de ces signaux particuliers.
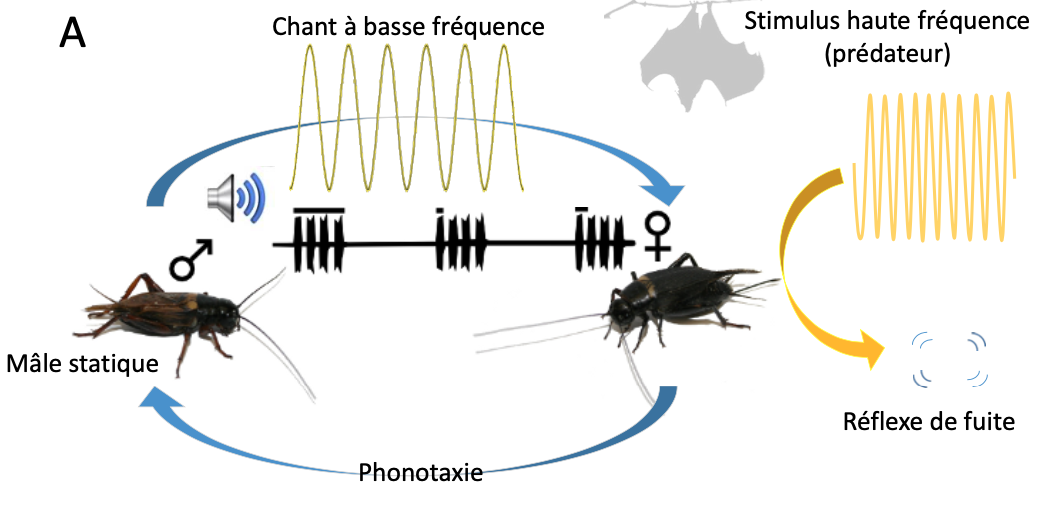
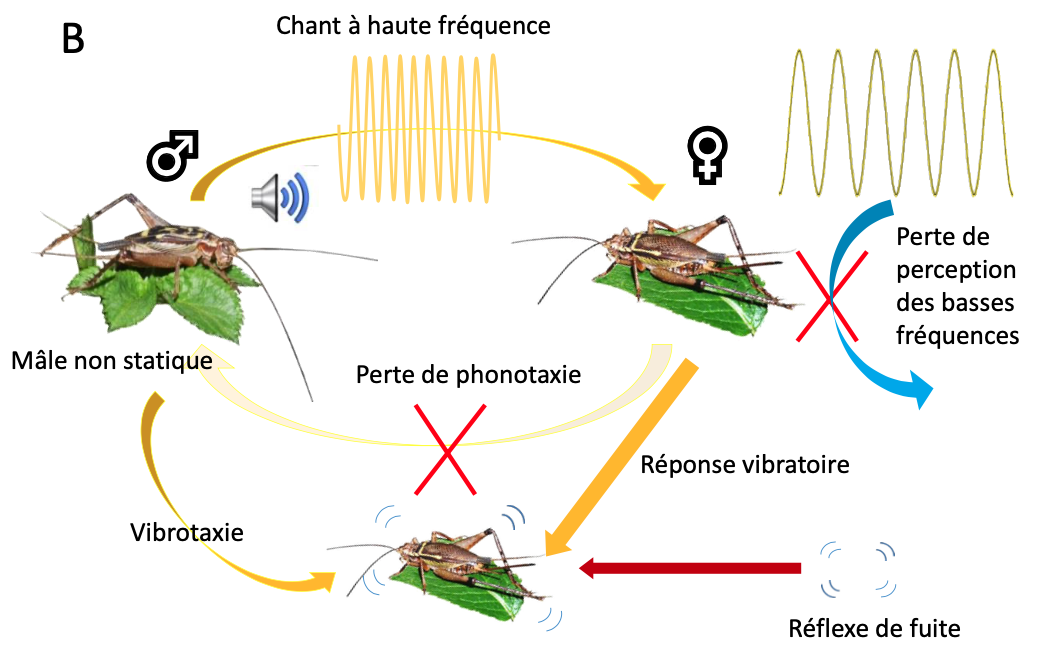
Des travaux menés grâce à un réseau de collaborations internationales multidisciplinaires permettent de commencer à comprendre ce qui était en jeu. Ces études, qui se poursuivent toujours, ont mis à jour un nouveau système de communication chez ce grillon (figure 6B). Il a probablement été acquis par l’exploitation sensorielle du réflexe de fuite existant chez les autres grillons, une situation évolutive rarement rencontrée (Hofstede et al. 2015).
De façon remarquable, le signal induisant la fuite – le son à hautes fréquences – aurait été incorporé dans le système de communication intraspécifique pour former un nouveau système de communication totalement original : le mâle non statique émet son chant à hautes fréquences tout en explorant la végétation autour de lui (vidéo 3) ; de son côté, la femelle, qui a perdu la perception des basses fréquences, ne s’oriente pas vers le mâle lorsqu’elle entend le chant d’appel à hautes fréquences (absence de phonotaxie) ; en revanche, elle émet une réponse vibratoire qui guide le mâle jusqu’à elle à travers le substrat végétal (vidéo 4).
Ce système de communication est supposé avoir joué un rôle majeur dans la diversification des Lebinthini. Or, il repose sur l’acquisition d’un unique trait partagé par tous ces grillons : les élytres des mâles ont acquis la faculté d’émettre de plus hautes fréquences en amplifiant l’un des harmoniques du spectre de fréquences généré par la stridulation, un phénomène appelé « saut d’harmonique ».
L’exploration taxonomique des Lebinthini permet de caractériser chaque étape du système et sa diversité. Initialement décrit chez trois espèces, le nouveau système des Lebinthini a été observé chez beaucoup d’autres espèces grâce à l’enregistrement systématique des chants d’appel lors des études menées sur le terrain.
Conclusion
L’exemple de grillons Eneopterinae permet de démontrer que la taxonomie et l’histoire naturelle dans son ensemble sont primordiales dans l’étude de l’évolution, à la fois pour reconstruire les relations phylogénétiques à tous les niveaux, pour retracer l’histoire biogéographique des lignées, et pour explorer la diversité des traits des taxons. Des pans entiers de la diversité du vivant se dissimulent encore bien trop souvent derrière les espèces modèles ou archétypes que l’on croit « bien connus », en particulier chez les insectes dont la diversité est immense.
Vidéo de Lebinthus bitaeniatus
L’auteur
Maître de conférences au Museum National d’Histoire Naturelle de Paris (MNHN) à l’Institut de Systématique, Evolution, Biodiversité (ISYEB), Tony est également rédacteur en chef du Journal of Orthoptera Research (JOR) et responsable des éditions du MNHN. |
Bibliographie
- Anso, J., Barrabe, L., Desutter-Grandcolas, L., Jourdan, H., Grandcolas, P., Dong, J. & Robillard, T. (2016) : Old lineage on an old island: Pixibinthus, a new cricket genus endemic to New Caledonia shed light on Gryllid diversification in a hotspot of biodiversity. PLoS ONE, 1, e0150920 (lien)
- Morley, R.J. (2007) : Cretaceous and Tertiary climate change and the past distribution of megathermal rainforests. Tropical rainforest responses to climatic changes (ed. by M.B. Bush and J. Flenley), pp. 1–31. Praxis publishing, Chichester (lien)
- Robillard, T. & Su, Y. N. (2018) : New lineages of Lebinthini from Australia (Orthoptera: Gryllidae: Eneopterinae). Zootaxa, sous presse (lien)
- Song, H., Amedegnato, C., Cicliano, M.M., Desutter-Grandcolas, L., Heads, S.W., Huang, Y., Otte, D., Whiting, M.F. (2015) : 300 million years of diversification: elucidating the patterns of orthopteran evolution based on comprehensive taxon and gene sampling. Cladistics, doi: 10.1111/cla.12116 (lien)
- Ter Hofstede, H., Schooneich, S., Robillard, T. & Hedwig, B. (2015) : Evolution of a communication system by sensory exploitation of startle behavior. Current Biology, 25, 3245–3252 (lien)
- Vicente, N., Kergoat, G.J., Dong, J., Yotoko, K., Legendre, F., Nattier, R., Robillard, T. (2017) : In and out of the Neotropics : historical biogeography of Eneopterinae crickets. Journal of Biogeography, in press (lien)

 Tony Robillard
Tony Robillard


