Par Flora Borne
Les adhésifs d’origine biologique (bioadhésifs) représentent une source d’innovation pour la création de nouveaux matériaux respectueux de l’environnement et de la santé.
Le bioadhésif le plus connu est celui qui permet à la moule de s’accrocher aux rochers. Avant de se « coller », ce mollusque produit un ensemble de filaments formant le byssus. L’extrémité des filaments du byssus est composée majoritairement de six protéines appelées mfp (mussel foot protein) (Zeng et al., 2015). Ce sont ces protéines qui permettent à la moule de demeurer fixée en milieu aqueux et salé à une diversité de substrats naturels tels que des rochers, du bois ou d’autres organismes marins mais aussi à des substrats non naturels tels que le métal ou le plastique.
Les propriétés adhésives sont dues à la présence de DOPA (l-3,4-dihydroxyphénylalanine) en grande quantité dans certaines protéines mfp. La DOPA, que l’on retrouve aussi dans les adhésifs d’autres mollusques marins forme des liaisons chimiques différentes avec une grande diversité de substrats.
La colle de la moule a inspiré le développement de nouveaux matériaux adhésifs dont certains sont aujourd’hui commercialisés. C’est le cas d’un hydrogel utilisé en culture cellulaire pour attacher des cellules à une surface (Corning® Cell-Tak™). De nouveaux matériaux adhésifs riches en DOPA pourraient bientôt être utilisés dans le milieu médical pour accélérer la réparation des tissus lésés (Chen et al., 2017).
Les insectes produisent des substances adhésives variées tout au long de leur vie pour des fonctions diverses (Betz, 2010). Par exemple, le criquet se déplace sur des surfaces verticales grâce à la présence de structures en forme de griffes, combinée à la production d’une colle au bout de ses pattes (Wang et al., 2015; Vötsch et al., 2002). La puce mâle a des antennes collantes pour maintenir son partenaire lors de l’accouplement (Rothschild and Hinton, 1968).
Propriétés chimiques
Chez Drosophila melanogaster, le mâle libère une substance collante dans l’appareil reproducteur de la femelle pendant l’accouplement pour prévenir un deuxième accouplement avec un autre partenaire (Avila et al., 2011). Les coléoptères du genre Stenus utilisent un organe (labium), une sorte de « langue » pour attraper leur proie un peu à la manière d’un caméléon. A l’approche d’une proie, ce staphylin déploie son labium au bout duquel une substance collante capture la proie (Betz and Kôlsch, 2004). Le ver à soie, chenille du Bombyx du murier, produit des filaments de soie qui collent entre eux et à un substrat pour construire un cocon. Enfin, les femelles du Coléoptère Chrysomélidé Crioceris asparagi produisent une colle pour attacher leurs œufs à la surface des feuilles (Voigt and Gorb., 2010) (figure 1).

Les bioadhésifs produits par les insectes résultent souvent du mélange de composés de différentes natures : protéiques, lipidiques, glucidiques. Ils sont produits par des glandes plus ou moins spécialisées dans la production de ces substances. Chez les coléoptères Staphylinidés du genre Stenus, la colle du labium est produite par des glandes spécialisées présentes dans la tête et composée de protéines et de lipides. Chez le Bombyx du murier, la soie est synthétisée par les glandes labiales produisant également de la salive. La soie est composée de deux protéines : la fibroïne qui forme les filaments de soie et la séricine qui cimente les filaments entre eux (Betz, 2010).
La drosophile produit aussi un bioadhésif qui lui permet de s’attacher à un substrat. Alors que ces petites mouches sont omniprésentes dans les laboratoires de recherche, ce phénomène d’attachement et les propriétés de cette colle sont restés inexplorés jusqu’à aujourd’hui.
Au cours de sa vie, la drosophile passe par différents stades larvaires puis par un stade de nymphe (pupe chez les diptères) pendant lequel l’individu effectue sa métamorphose avant de devenir un organisme adulte. Vers la fin de leur dernier stade, les larves arrêtent de se nourrir et cherchent un endroit favorable à leur métamorphose. Une fois celui-ci trouvé, l’animal s’arrête etses glandes salivaires sécrètent une colle, composée principalement de huit protéines appelées Sgs1, Sgs3, Sgs4, Sgs5, Sgs5bis, Sgs7, Sgs8 et Eig71Ee.
Les protéines Sgs1, Sgs3, Sgs4 et Eig71Ee sont fortement glycosylées, c’est-à-dire que des sucres sont liés aux protéines. Ces protéines font partie de la famille des mucoprotéines qui ont la particularité de former des gels en présence d’eau et se retrouvent dans la composition des mucus (salive, mucus nasal, …). Cette propriété est due au fait que les mucoprotéines sont composées à plus de 4% de sucre. La colle de drosophile comprend 40 % de sucres et 60 % de protéines (Korge et al., 1977).
Les protéines Sgs4, Sgs5, Sgs5bis, Sgs7 et Sgs8 ne comportent pas de sucre et ne font pas partie d’une famille de protéines particulière. Cette colle, un liquide transparent, est excrété par l’animal en quelques secondes et s’étale tout de suite entre l’individu et le substrat. La larve effectue quelques mouvements péristaltiques (une sorte de vague de contractions musculaires allant de l’extrémité antérieure à l’extrémité postérieure), ce qui permet à la colle de se répartir sur son tégument. Après quelques secondes, la larve s’immobilise et entre en métamorphose (Fraenkel and Brookes, 1953). Au contact de l’air, la colle sèche en quelques minutes. Ce phénomène est peut-être dû à l’évaporation des molécules d’eau présentes dans la colle.
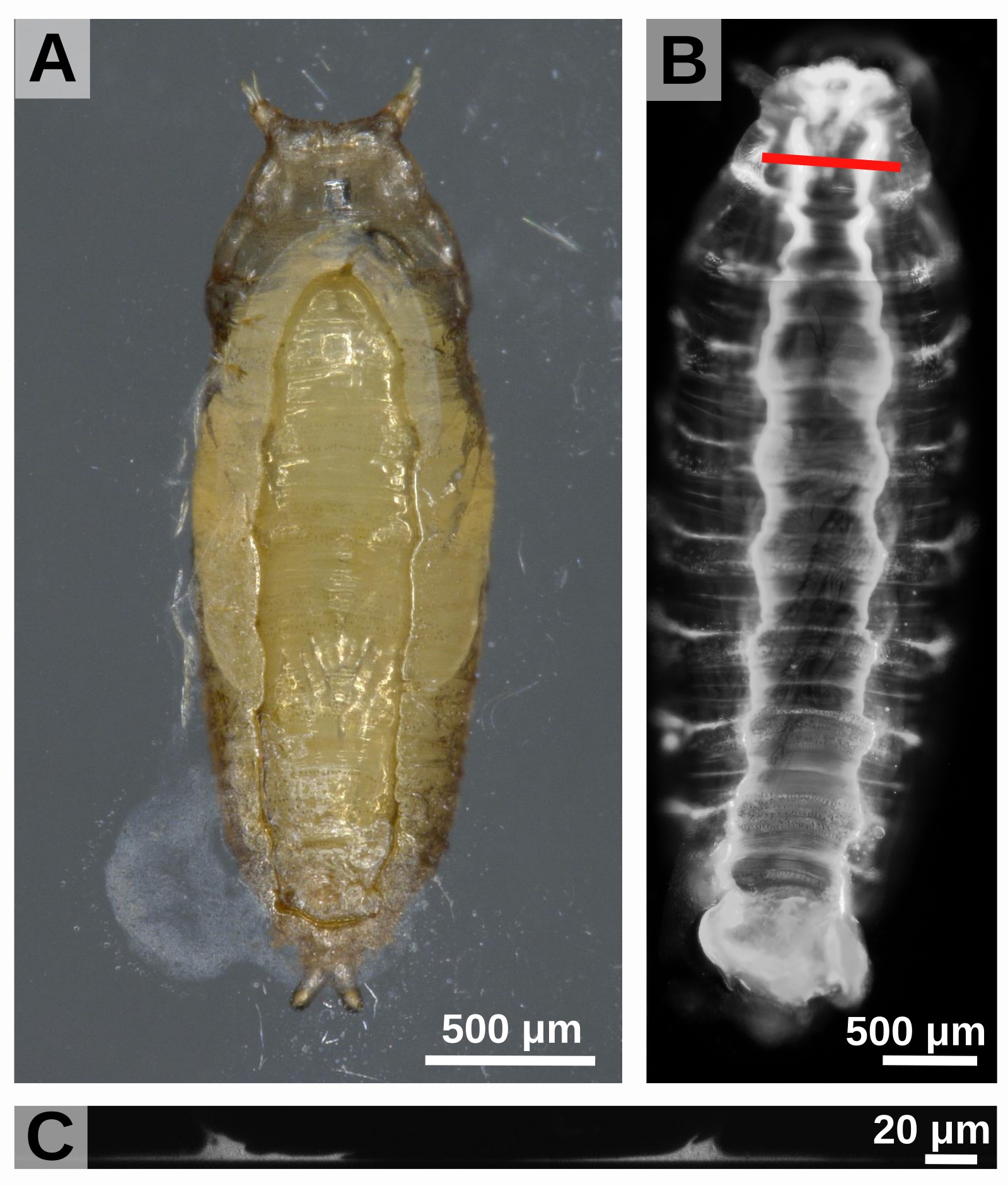
La pupe reste alors collée à son substrat pendant la métamorphose (environ 4 jours chez Drosophila melanogaster). Ensuite, la mouche perce l’ une enveloppe de cuticule qui la protège, celle-ci restant collée au substrat. Dans la nature, les pupes sont collées à des feuilles, des fruits mais aussi à des cailloux ou à d’autres individus (figure 2).

A notre connaissance, aucune étude n’a été réalisée jusqu’à présent pour connaître la fonction de la colle des drosophiles, même si plusieurs hypothèses ont été proposées.
Par exemple, il a été envisagé que cette colle pourrait empêcher la pupe d’être déplacée par l’eau ou le vent de façon à ce qu’elle reste dans un endroit protégé, à l’abri des prédateurs, dans des conditions de température et d’humidité favorables. Cette colle pourrait également limiter la prolifération de bactéries ou des moisissures à sa surface. Une autre possibilité est que l’adhésion de la pupe aide mécaniquement l’adulte à émerger de la pupe.
L’équipe « Évolution et Génétique » dont je fais partie (Institut Jacques Monod, Paris), utilise la drosophile comme un modèle d’étude pour comprendre comment des variations génétiques ont permis à des espèces de s’adapter à leur environnement. La colle des drosophiles représente un bon trait de caractère pour étudier l’évolution génétique : c’est un système simple car elle n’est composée que de huit protéines et elle pourrait avoir une fonction importante pour que l’individu survive dans son environnement (protection contre la prédation ou contre la pluie, le vent, …).
Pour mieux comprendre comment la colle permet aux individus de s’attacher à des substrats divers dans des environnements variés, une première étude a porté sur l’évolution des huit gènes codant les protéines de colle (Da Lage et al., 2019). Ces protéines sont formées de l’enchaînement d’acides aminés. Les mucoprotéines Sgs1, Sgs3, Sgs4 et Eig71Ee ont la particularité de contenir un motif de 5 à 7 acides aminés répété le long de la chaîne protéique.
L’étude a montré que ce motif changeait en fonction des espèces de drosophiles et que le nombre de motifs contenus dans une protéine changeait au sein d’une même espèce. Elle a aussi mis en évidence des gains et des pertes de gènes fréquents entre espèces de drosophiles. Par exemple, le gène Sgs7 est présent en deux copies chez D. santomea et seulement en 1 copie chez D. melanogaster. Il est possible que ces différences dans les gènes entraînent des modifications des propriétés de la colle et participent à l’adaptation des populations de mouches à différents environnements. C’est ce que notre laboratoire cherche à déterminer en se focalisant sur quelques mutations particulières.
Enfin, cette analyse des gènes de la colle a montré que leur évolution est plus rapide que celle de la majorité des autres gènes présents dans le génome, ce qui suggère que les propriétés de la colle changent rapidement au cours de l’évolution, probablement en lien avec l’adaptation des individus à leur milieu.
Une colle forte universelle
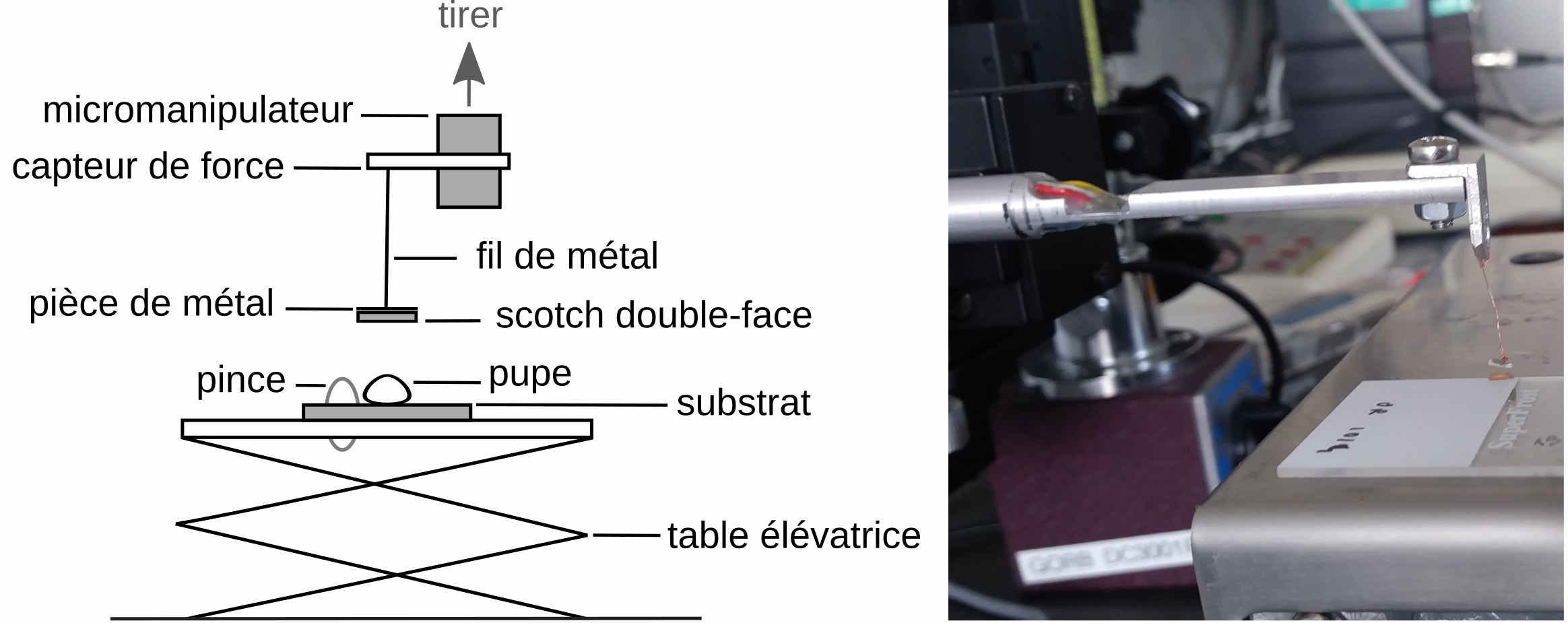
Pour aller plus loin dans l’analyse de cette colle, une deuxième étude a permis de caractériser ses propriétés adhésives (Borne et al., 2020). Nous avons mis en place un protocole permettant d’estimer sa force d’adhésion. Le principe est simple : laisser l’animal s’accrocher au substrat puis tirer sur la pupe jusqu’à ce qu’elle se détache, et enregistrer la force nécessaire à ce décollement. Pour tirer sur chaque pupe, nous avons utilisé du scotch double face collé à un bout de métal et relié à un capteur de force par un fil métallique. Une fois la pupe collée au scotch, le capteur de force a été remonté à une vitesse constante grâce à un micromanipulateur automatisé jusqu’à ce que la pupe se décolle (figure 3). Afin de comparer l’efficacité de cette colle avec d’autres colles, nous avons divisé la force obtenue par la surface de contact entre la pupe et le substrat pour obtenir une mesure de la contrainte exprimée en Pascal (Pa).
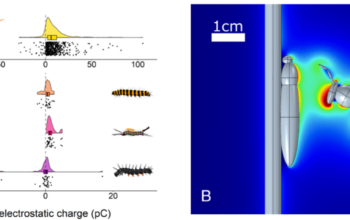
Nous avons ainsi pu mesurer que la contrainte nécessaire à appliquer à la pupe pour la décoller d’une lame de verre est de l’ordre de 200 kPa. Cette contrainte est faible par rapport à celle d’une colle forte industrielle du genre Super Glue (de l’ordre de 10 MPa) ou à la colle des moules (300 à 1 000 kPa environ). Cependant, la force mesurée est forte si on la ramène à l’échelle de l’animal : pour décoller une pupe, il faut lui appliquer une force correspondant à 15 500 fois son poids. Nous avons testé l’adhésion sur 11 substrats différents, notamment des lames de verre recouvertes de différentes molécules pour leur donner des propriétés chimiques et électriques variées. Nous avons observé que la pupe adhérait de façon équivalente à des surfaces hydrophiles (attirant les molécules d’eau), hydrophobes (repoussant les molécules d’eau). Tous les substrats que nous avons testés sont polarisables : ils ont la capacité de réorganiser leurs charges positives et négatives en présence d’un champ électrique de manière à créer un pôle positif et un pôle négatif.
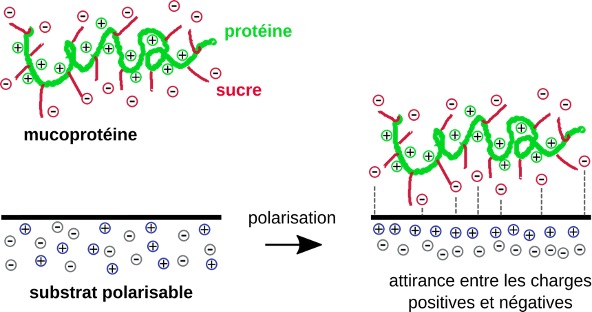
Nous avons par ailleurs observé que les pupes n’adhéraient quasiment pas au téflon, un matériau non polarisable. Or, dans les mucoprotéines de la colle de drosophile, les acides aminés des protéines sont chargés positivement et les sucres liés aux protéines le sont négativement. La polarisabilité du substrat en présence des charges des mucoprotéines pourrait alors expliquer le phénomène d’adhésion (figure 5). Les charges positives et les charges négatives s’attirent : c’est un phénomène courant que l’on retrouve dans le cas de l’électricité statique (par exemple, lorsque l’on frotte un ballon de baudruche à un pull ou aux cheveux). Dans le cas de la colle de drosophile, en présence des sucres chargés négativement des mucoprotéines, le substrat pourrait se polariser et le pôle positif formé dans le substrat serait attiré par les charges des sucres (possible de faire un schéma). Nos expériences ont également montré que les pupes adhéraient aussi bien à des surfaces rugueuses qu’à des surfaces lisses.
Nous avons aussi caractérisé la surface de contact entre le substrat et la pupe. La colle qui s’étale entre le substrat et la partie ventrale de la pupe forme une couche d’une épaisseur de 0 à 20 µm. La surface de contact a une forme ovale liée à la forme de la pupe (figure 4 ci-dessus). Lorsque l’on détache la pupe mécaniquement, une rupture s’opère au sein de la colle, laissant une partie de la colle sur la pupe et l’autre sur le substrat (figure 6).

Conclusion
Les drosophiles produisent une colle permettant d’attacher l’animal durant la métamorphose. Les gènes codant les protéines de cette colle évoluent rapidement entre espèces et même au sein d’une espèce, ce qui suggère que cette colle a une fonction importante pour que l’animal survive dans son environnement. De plus, cette colle permet de supporter 15 500 fois le poids de l’animal et adhère avec la même force à des substrats variés. La colle de drosophile est donc universelle !
L’analyse de ses propriétés adhésives jusqu’alors inconnues et des gènes associés pourrait permettre à terme de développer de nouveaux adhésifs.
Flora Borne
|
Bibliographie
- Avila, F.W., Sirot, L.K., LaFlamme, B.A., Rubinstein, C.D. & Wolfner, M.F. (2011) : Insect seminal fluid proteins: identification and function. Annual review of entomology, 56, pp.21-40 (lien)
- Bauer, T. & Pfeiffer, M. (1991) : ‘Shooting’springtails with a sticky rod: the flexible hunting behaviour of Stenus comma (Coleoptera; Staphylinidae) and the counter-strategies of its prey. Animal Behaviour, 41(5), pp.819-828 (lien)
- Betz, O. (2010) : Adhesive exocrine glands in insects: morphology, ultrastructure, and adhesive secretion. In Biological adhesive systems (pp. 111-152). Springer, Vienna (lien)
- Betz O, & Kölsch G. (2004) : The role of adhesion in prey capture and predator defence in arthropods. Arthropod Struct Dev. 33(1):3-30. doi: 10.1016/j.asd.2003.10.002. PMID: 18089020 (lien)
- Borne, F., Kovalev, A., Gorb, S. & Courtier-Orgogozo, V. (2020) : The glue produced by Drosophila melanogaster for pupa adhesion is universal. Journal of Experimental Biology, 223(8) (lien)
- Chen, W., Wang, R., Xu, T., Ma, X., Yao, Z., Chi, B. & Xu, H. (2017) : A mussel-inspired poly (γ-glutamic acid) tissue adhesive with high wet strength for wound closure. Journal of Materials Chemistry B, 5(28), pp.5668-5678 (lien)
- Da Lage, J.L., Thomas, G.W., Bonneau, M. & Courtier-Orgogozo, V. (2019) : Evolution of salivary glue genes in Drosophila species. BMC evolutionary biology, 19(1), p.36 (lien)
- Fraenkel, G. & Brookes, V.J. (1953) : The process by which the puparia of many species of flies become fixed to a substrate. The Biological Bulletin, 105(3), pp.442-449 (lien)
- Korge, G. (1977) : Larval saliva in Drosophila melanogaster: production, composition, and relationship to chromosome puffs. Developmental biology, 58(2), pp.339-355 (lien)
- Pérez‐Rigueiro, J., Viney, C., Llorca, J. & Elices, M. (2000) : Mechanical properties of single‐brin silkworm silk. Journal of Applied Polymer Science, 75(10), pp.1270-1277 (lien)
- Rothschild, M. & Hinton, H.E. (1968) : Holding organs on the antennae of male fleas. In Proceedings of the Royal Entomological Society of London. Series A, General Entomology (Vol. 43, No. 7‐9, pp. 105-107). Oxford, UK: Blackwell Publishing Ltd.
- Voigt, D. & Gorb, S. (2010) : Egg attachment of the asparagus beetle Crioceris asparagi to the crystalline waxy surface of Asparagus officinalis. Proceedings of the Royal Society B: Biological Sciences, 277(1683), pp.895-903 (lien)
- Vötsch, W., Nicholson, G., Müller, R., Stierhof, Y.D., Gorb, S. & Schwarz, U. (2002) : Chemical composition of the attachment pad secretion of the locust Locusta migratoria. Insect biochemistry and molecular biology, 32(12), pp.1605-1613 (lien)
- Wang, L., Johannesson, C.M. & Zhou, Q. (2015) : Effect of surface roughness on attachment ability of locust Locusta migratoria manilensis. Wear, 332, pp.694-701 (lien)
- Zeng, H., Lu, Q., Yan, B., Huang, J., Li, L. & Liao, Z. (2015) : Mussel Adhesives. Bioadhesion and biomimetics: from nature to applications. Pan Stanford Publishing, Singapore, pp.49-84 (lien)


 Depuis le lycée, je suis passionnée par la théorie de l’évolution permettant d’expliquer la grande diversité du vivant. J’ai continué mes études en biologie et j’ai choisi de travailler sur les insectes lors de ma thèse et notamment sur les drosophiles à l’Institut
Depuis le lycée, je suis passionnée par la théorie de l’évolution permettant d’expliquer la grande diversité du vivant. J’ai continué mes études en biologie et j’ai choisi de travailler sur les insectes lors de ma thèse et notamment sur les drosophiles à l’Institut 


Bonjour.
Passionnant et d’une grande qualité, comme à chaque fois !
Un grand merci pour votre article qui devrait intéresser le CEEBIOS (à moins qu’ils ne soient déjà au courant…)
Guillaume
Nature Formation Bretagne