Les yeux (la vision), dans leur diversité de forme et de structure, permettent à un organisme, quel qu’il soit (invertébrés et vertébrés), de collecter l’énergie lumineuse (photons), de la convertir en énergie électrique qui sera ensuite transmise au cerveau via des neurones où elle sera analysée et interprétée pour donner naissance à une représentation mentale de l’environnement à l’animal lui permettant de se déplacer, de repérer une proie ou un partenaire sexuel.
Cependant, l’oeil des arthropodes est différent de celui des vertébrés tant au niveau de son anatomie que de son mode de fonctionnement. Cette série de trois articles essaie d’apporter une synthèse générale sur la vision chez les insectes : 1) Anatomie et structure des yeux ; 2) Vision et perception du mouvement ; 3) Physiologie des récepteurs et mécanismes de régulation de la sensibilité à la lumière.
I. Transduction de l’énergie lumineuse en énergie électrique
La conversion d’un signal lumineux en énergie électrique puis en message nerveux implique un mécanisme appelé phototransduction. Ce processus fait intervenir des récepteurs protéiques photosensibles : les pigments visuels, appelés rhodopsines. Chez les insectes, ces protéines se rencontrent dans de petites structures spécialisées : les chromophores, elles même présentent dans le rhabdomère des ommatidies (lire cet article).
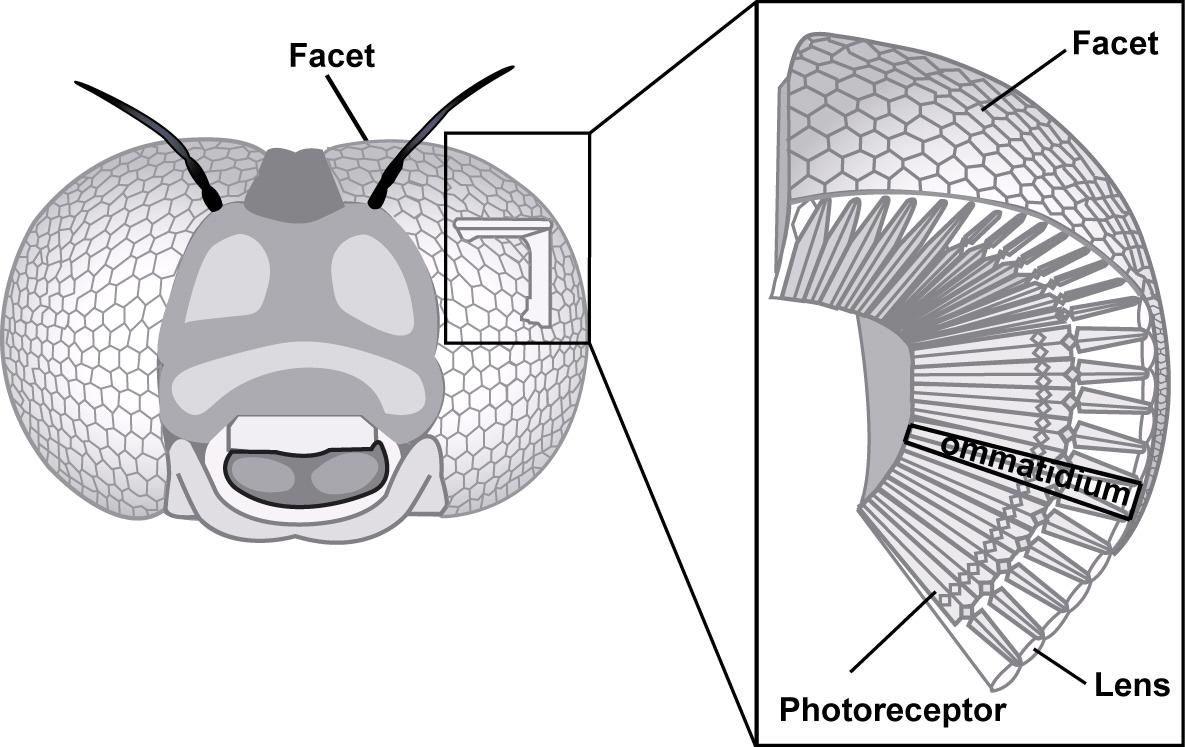
Par exemple, chez la drosophile (Drosophila melanogaster), 500 à 2000 molécules de rhodopsines sont présentent dans chacune des 40 000 microvilli que contient un rhabdomère d’une ommatidie.
Lorsqu’un photon (particule lumineuse) est absorbé par une molécule de rhodopsine, une cascade complexe d’événements chimiques entraine une dépolarisation (changement de charge électrique) de la membrane d’une cellule nerveuse (neurone).
La probabilité pour qu’un photon rencontre une molécule de rhodopsine dépend de la longueur du rhabdomère : ainsi, avec une longueur de 80µm, le rhabdomère de la drosophile absorbe 26% de la lumière contre 100% chez la libellule. Chez d’autres espèces, nocturnes ou évoluant dans la pénombre, un tapetum* (surface réfléchissante) renvoie la lumière, tel un miroir, une deuxième fois vers le rhabdomère, augmentant ainsi la probabilité de rencontre d’un photon avec une molécule de rhodopsine et donc la sensibilité de l’organe visuel à la lumière.
*Tapetum : le même principe se retrouve chez les yeux de vertébrés nocturnes comme les chats, leurs yeux reflétant la lumière des phares d’une voiture par exemple.
II. Adaptation aux changements de luminosité
Les cycles nycthéméraux entrainent de grandes fluctuations importantes de luminosité entre le jour et la nuit : 4×10.20 photons par mètre carré et par seconde en journée contre 10.10 photons durant la nuit (variation d’un facteur 40 milliards !). Afin de pallier cette contrainte environnementale, les insectes ont développé de multiples adaptations situées à deux niveaux : 1) Régulation de la quantité de lumière atteignant les photorécepteurs ; 2) Modification de la sensibilité des photorécepteurs.
II.1. Régulation de la quantité de lumière atteignant les photorécepteurs
La quantité de lumière qui atteint le rhabdomère est régulée par le mouvement des pigments dans les cellules, mouvement parfois associé à la modification anatomique des ommatidies. Cette adaptation se retrouve en majorité dans des yeux composés de type « superposition » (lire cet article) (Illustration 1 ci-dessous).
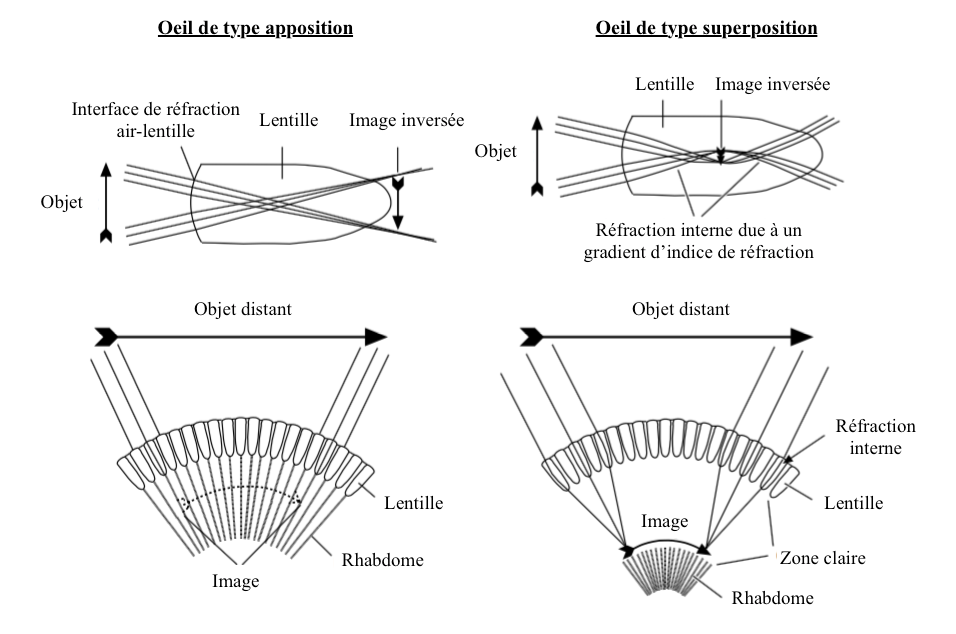
- Yeux de types superposition
Les adaptations se situent à deux niveaux :
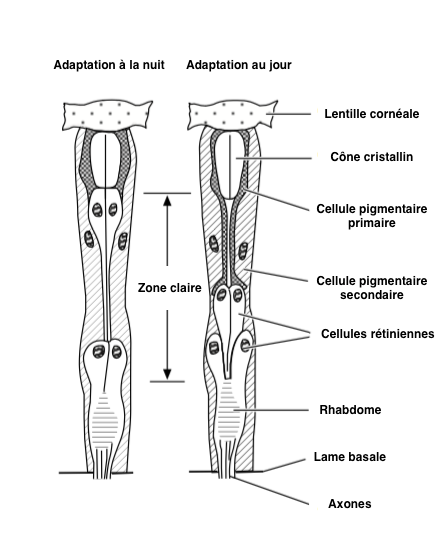
– Pigments : dans un environnement obscur, les pigments sont situés dans la zone distale des cellules pigmentaires, permettant ainsi aux photons de se propager entre les ommatidies : zone claire (Illustration 2 ci-contre – cliquer dessus pour agrandir). A l’inverse, en présence d’une forte intensité lumineuse, les pigments se déplacent vers le centre des cellules afin de limiter l’entrée de lumière en diminuant la quantité de photons pénétrant dans l’ommatidie. A ce moment, le fonctionnement de l’oeil est similaire à celui de type « apposition », où chaque ommatidie fonctionne indépendamment des autres (lire cet article).
Un procédé similaire existe dans nos yeux, le cristallin se ferme ou s’ouvre plus ou moins en fonction de l’intensité lumineuse présente dans l’environnement.
– Cellules photoréceptrices : l’adaptation au changement de luminosité se réalise par l’extension et la compression du cône cristallin, cantonnant le pigment aux parties périphériques de l’ommatidie. En présence d’une forte luminosité, les cellules photoréceptrices sont courtes et les cellules pigmentaires primaires s’étendent sous la lentille, ces déplacements peuvent représenter près de 15µm.
Les adaptations à une variation de luminosité requièrent parfois plusieurs minutes, voire davantage. Chez les fourmis Camponotus, les premiers changements interviennent 15 minutes après un changement d’intensité lumineuse pour se finir 2 heures après. Il existe une grande variété de tempo entre les espèces. Ainsi, chez les papillons de nuit (hétérocères) du genre Cydia (des Carpocapses), le processus complet, d’une durée de 1 heure, débute 1h30 avant le crépuscule ou l’aurore pour que l’adaptation soit terminée 30 min avant le changement total de luminosité.
L’intensité lumineuse perçue est également dépendante de l’habitat dans lequel l’insecte évolue. Par exemple, le coléoptère cavernicole du genre Zopholas perçoit une luminosité de magnitude 5 fois plus faible que des espèces diurnes de la même famille (Tenebrionidae), comme le genre Tenebrio.
- Yeux de type apposition
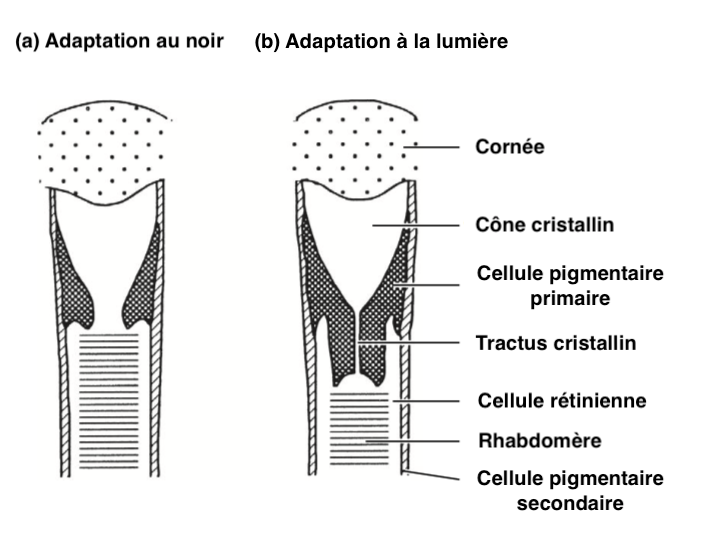
Des mouvements pigmentaires comparables aux yeux de type superposition sont observés dans ceux de type apposition.
Par exemple, chez la fourmi du genre Camponotus, les cellules pigmentaires primaires se contractent lorsque la luminosité augmente, comprimant le cône cristallin, formant un tractus cristallin étroit entouré de cellules pigmentaires primaires (Illustration 3 ci-contre). Ce rétrécissement diminue l’entrée de la lumière et seule la lumière arrivant dans l’axe de l’ommatidie atteint le rhabdomère. Chaque ommatidie est régulée de manière indépendante par rapport aux autres.
II.2. Modification de la sensibilité des photorécepteurs
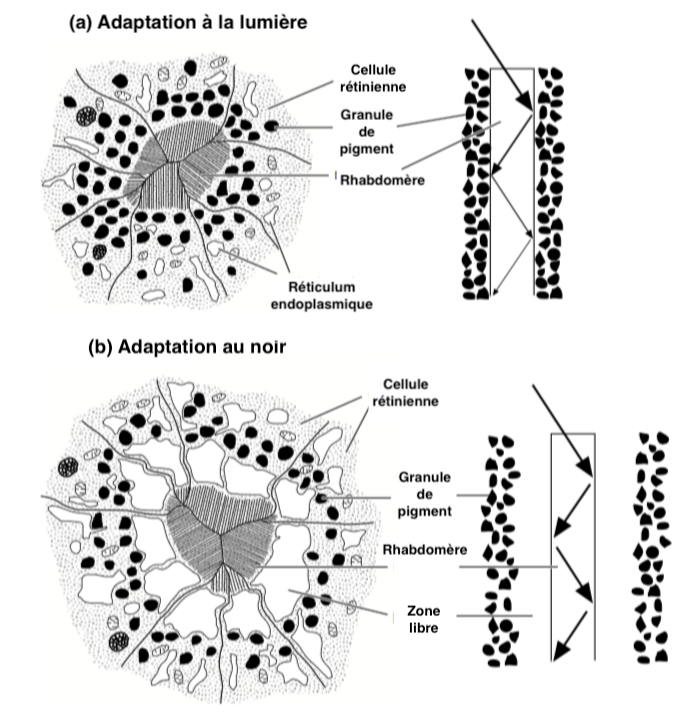
La régulation de la sensibilisation des récepteurs s’opère, dans les yeux de type apposition, par un changement structurel des cellules photoréceptrices. Leur structure varie selon la disponibilité lumineuse absorbée par les molécules de rhodopsines.
Des granules de pigments absorbants sont présents à l’intérieur des cellules réceptrices entourant l’intérieur des microvilli du rhabdomère (Illustration 4 ci-dessous). Dans la clarté, les granules pigmentaires migrent vers la surface interne du rhabdomère et absorbent la lumière circulant le long de ce dernier, diminuant ainsi la quantité de lumière et l’intensité lumineuse reçues par les photorécepteurs. Dans l’obscurité, le processus s’inverse : les pigments absorbants migrent vers la périphérie.
Les mouvements de ces pigments, contrairement à ceux situés dans les cellules pigmentaires, sont quant à eux rapides : quelques secondes à peine suffisent par exemple chez les diptères (mouches) et les lépidoptères (papillons).
III. Sensibilité spectrale et vision chromatique
Les cellules photoréceptrices possèdent une gamme de sensibilité (profil Gaussien) à des longueurs d’onde comprises entre 330 et 640 nm (voir figure ci-contre). La longueur d’onde maximale dépend de la composition de la séquence en acides aminés de la protéine d’opsine.
Les ommatidies sont caractérisées selon la présence de certains types de récepteurs :
- Type I : 1 récepteur aux UV et au bleu
- Type II : 2 récepteurs aux UV
- Type III : 2 récepteurs au bleu
L’étant ancestral des photorécepteurs chez les Ptérygotes (insectes ailés) semble être une sensibilité aux UV, au bleu et au vert. Ces types de récepteurs se retrouvent dans une grande proportion des ommatidies. Certaines espèces possèdent 6 récepteurs différents au vert. Ainsi, des hyménoptères (guêpes, abeilles et bourdons) et des lépidoptères des genres Vanessa ou Mandura sont qualifiés de tri chromatiques : capacité à percevoir 3 couleurs.
Chez les diptères, il existe deux autres types d’ommatidies : « pâle » et « jaune », composées de 6 récepteurs (R1 à R6) couvrant le spectre de 300 à 600 nm qui correspond à une combinaison d’opsines et de pigments sensibles et absorbants les UV.
Chez de nombreux insectes, la proportion de différents pigments visuels varie selon la fonction que joue la vision. Par exemple, chez les abeilles, les ommatidies en position dorsale sont sensibles essentiellement aux UV et au bleu, alors que celles en position ventrale le sont au vert. Cette configuration se retrouve chez de nombreuses espèces volantes : l’oeil serait en fait constitué pour équilibrer l’insecte durant le vol par maintien de l’horizon au centre de la vision, ciel (bleu) et sol (vert). Il existe également des variations entre les sexes. Chez le papillon Lycaena rubidus, les femelles possèdent des ommatidies dorsales sensibles à des longueurs d’onde de 568 nm, absentes chez les mâles.
Plusieurs espèces de lépidoptères, d’odonates (libellules) et possiblement de quelques coléoptères et hyménoptères possèdent plus de 3 types de photorécepteurs sensibles à la couleur avec par exemple une sensibilité maximale pour le rouge ou pour le violet. Cette perception est rendue possible par une augmentation de la diversité de types d’opsines (duplication de gènes par exemple) ou par l’utilisation de filtres contrôlant la quantité de lumière atteignant les pigments, voire par une combinaison de ces deux stratégies.
La diversité spectrale de la réception visuelle peut être assurée au sein des cellules photoréceptrices de deux manières : 1) Posséder la même molécule d’opsine et 3 filtre pigmentaires différents entourant le rhabdomère, 2) Posséder 5 molécules d’opsines différentes et un filtre péri-rhabdomal, comme chez le papillon Papilio xuthus.
La sensibilité au rouge est obtenue par la présence d’une opine sensible à des longueurs d’onde proche de 575 nm, la même sensibilité que les récepteurs humains (565 nm). En règle générale, la sensibilité d’un récepteur à une couleur est directement liée à un type d’opsine.
Comme chez les diptères, les photorécepteurs de P. xuthus sont disposés en couches afin que la lumière atteignant les cellules photoréceptrices des couches inférieures soit filtrée par celles des couches supérieures. Chez d’autres insectes, la lentille est colorée de telle sorte que les rhabdomères reçoivent une lumière filtrée monochromatique (constituée d’une seule longueur d’onde). Par exemple, de nombreuses espèces de mouches possèdent à la surface de leurs yeux composés des lignes verticales ou horizontales de couleurs variables : mâle de la famille des Dolichopodidae, mouches de la famille des Tabanidae (taons) ou encore Hermetia illucens (Stratiomyidae) (voir photos ci-dessous). Ainsi, les ommatidies d’un même oeil composé recevant un même profil lumineux seront stimulées différemment. Ce mécanisme permet une vision polychromatique tout en n’ayant qu’un seul type d’opsine : en d’autres termes, des photorécepteurs identiques peuvent générer des sensibilités spectrales différentes.
Percevoir son environnement en couleur offre la possibilité d’interagir de manière plus complexe avec celui-ci : recherche de partenaire sexuel, phototaxie (déplacement en fonction de la lumière), oviposition (comportement de ponte), détection de prédateurs… Par exemple, des espèces d’hyménoptères, de lépidoptères ou de diptères ont pu être entrainées à associer des couleurs avec des comportements (vidéo ci-dessous). Aussi, il a été démontré chez des abeilles et des guêpes que les insectes possèdent également la capacité à discriminer une forme pas sa couleur.
De nombreuses espèces d’insectes privilégient certaines couleurs dans la recherche de nourriture, ce comportement pouvant être modifié par l’apprentissage et l’expérience. Par exemple, les insectes phytophages ne sont pas uniquement attirés par des sources lumineuses vertes, mais également par des sources jaunes. Les abeilles sont quant à elles attirées par des sources lumineuses de violettes à bleues, une réponse évolutive au fait que les fleurs reflétant de telles couleurs contiennent davantage de nectar.
IV. Discrimination du plan de vibration (sensibilité de polarisation)
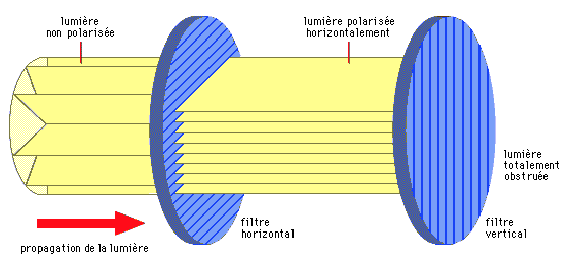
Les ondes lumineuses vibrent dans un plan perpendiculaire à l’axe dans lequel elles se dirigent (illustration 5 ci-dessous). Ces plans de vibration peuvent être distribués sur les 360° entourant l’axe de direction. Lorsque toutes les ondes lumineuses vibrent dans un plan spécifique, la lumière est dite polarisée.
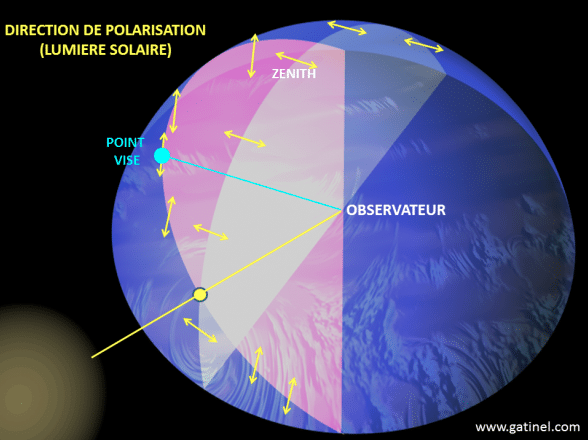
Par exemple, la lumière bleue provenant du ciel est polarisée : le degré de polarisation et le plan de polarisation maximale dépendent de la position du soleil, et ne sont donc pas les même dans les différentes parties du ciel (illustration 6 ci-contre). La détection de ces paramètres permet de déterminer la position du soleil, même lorsque celui-ci n’est pas visible. Certains insectes utilisent ces informations pour se diriger, notamment les insectes sociaux comme les abeilles (genre Apis) ou les fourmis du genre Cataglyphis qui recherchent de la nourriture puis reviennent à la colonie. Chez des insectes comme les Odonates (libellules) et les Diptères (mouches), la capacité à percevoir la lumière polarisée permet de maintenir une navigation stable et constante.
La perception du plan de polarisation est possible grâce à la présence de molécules pigmentaires photosensibles orientées dans un axe spécifique et situées dans les microvilli des rhabdomères. L’activation survient (absorption maximale) lorsque la lumière vibre dans le même plan que ces molécules (Illustration 7 ci-dessous).
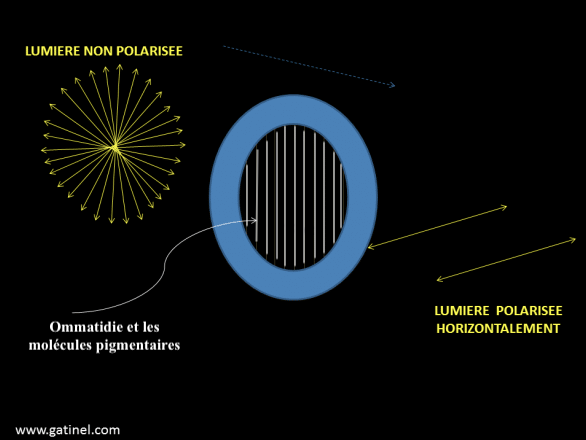
Dans les ommatidies, le rhabdomère est le plus souvent courbé (forme convexe de l’oeil composé), il ne peut donc y avoir de plan, d’absorption spécifique. La sensibilité de polarisation dépendra donc d’une orientation uniforme des molécules de pigments visuels dans un rhabdomère. Chez les fourmis et les abeilles, ainsi que chez d’autres insectes sensibles au plan de polarisation, des rhabdomères droits sont présents uniquement dans un petit groupe d’ommatidies situé le long du bord dorsal de chaque oeil. Ces ommatidies constituent à peine 6% du total des ommatidies chez la fourmis Cataglyphis et 2,5% chez les abeille du genre Apis. La stimulation des cellules photoréceptrices a lieu lorsqu’une majorité de molécules pigmentaires sont parallèles au plan de polarisation.
Le fonctionnement de ce système demeure encore lacunaire. L’hypothèse suggère qu’en balayant le ciel, l’insecte est capable de faire correspondre ces récepteurs de polarisations aux plans de polarisation du ciel. Lors de la réorientation, le motif du ciel correspondrait à l’entrée mémorisée. Une carte mentale pouvant réaliser ce genre de comparaison a été localisée dans le corps central du cerveau de criquets acridiens.
Source :
– The Insects : Structure & Function (5ème édition, 2013) – Edition : S.J. Simpson & A.E. Douglas – Cambridge University Press
– Encyclopedia of Insects : Vincent H. RESH & Ring T. CARDE, Academic Press-2009
– Tibbetts E. A. & Izzo A. (2010) : Social punishment of dishonest signalers caused by mismatch between signal and behavior – Current Biology, 20(18):1637-1640 (lien)
Recommandation d’ouvrages sur cette thématique
– Evolution of the Insects (David Grimaldi & Michael S. Engel – Edition : Cambridge University Press – 772 pages – 16 mai 2005)
– The Insects: An Outline of Entomology (P.J. Gullan & P.S. Cranston – Edition : Wiley-Blackwell – 624 pages – 5ème édition : 6 août 2014)
– The Insects: Structure and Function (R.F. Chapman & Stephen J. Simpson – Edition : Cambridge University Press – 959 pages – 5ème édition : 12 novembre 2012)
– Encyclopedia of Insects (Vincent H. Resh & Ring T. Cardé – Edition : Academic Press – 1024 pages – 2ème édition : 22 juillet 2009)