Par Benoît GILLES
Des régions du monde, isolées géographiquement des autres continents depuis des millions d’années, ont permis l’apparition d’espèces, tant animales que végétales, uniques, rares et incroyables.
La Nouvelle-Zélande est sans doute l’une de ces contrées les plus intéressantes. Plusieurs espèces emblématiques ont vécu et vivent toujours sur ce territoire. Par exemple, le moa, disparu il y a à peine 1500 ans avec l’arrivée des humains, était le plus grand oiseau connu (famille des Dinornithidae). Des squelettes ont permis d’estimer que ces animaux pouvaient mesurer plus de 3,6m de haut et peser près de 240kg. Un autre oiseau, le kiwi (Apteryx mantelli), le plus petit représentant de la famille des ratites (autruches, émeus, nandous et casoars), est en voie de disparition (découvrez également les phasmes de Nouvelle-Zélande).
Mais connaissez-vous les weta?
Je vous invite ici à partir à la rencontre de ces incroyables insectes.
I) Généralités
Les weta sont des Orthoptères, ordre regroupant les grillons, les sauterelles et les criquets, appelés ainsi en langage Maori. Ils appartiennent à la famille des Anostostomatidae, caractérisée notamment par son dimorphisme sexuel : les mâles possèdent des mandibules de grande taille, mais aussi, les adultes n’ont pas d’ailes et possèdent sur leurs tibias postérieurs des éperons (épines) défensifs (voir illustration 1).
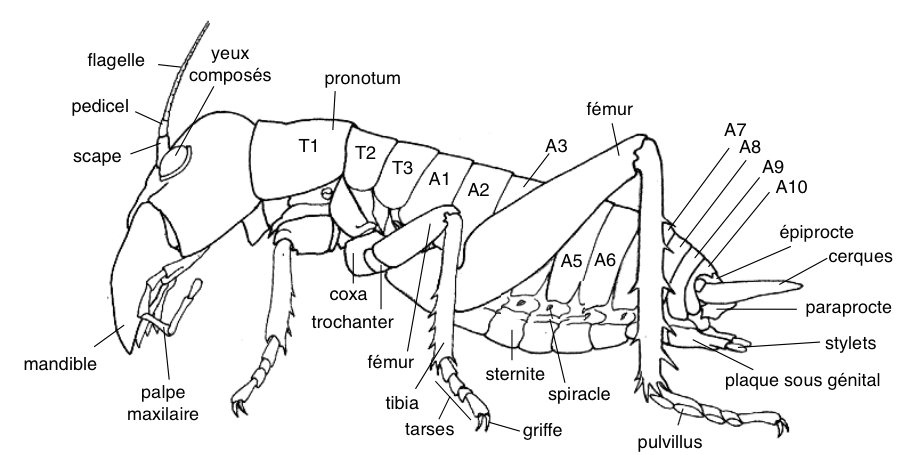
Les Anostostomatidae, apparus au Crétacé (80-65 millions d’années) sur le Gondwana*, sont aujourd’hui principalement présents sur l’hémisphère sud : Australie, Afrique du sud, Amérique du sud et Inde, continents résultant de la fragmentation du Gondwana par la tectonique des plaques.
* il y a 300 millions d’années, tous les continents étaient rassemblés en un continent unique : la Pangée. Puis, ce continent a commencé à se dissocier (200 millions d’années), au nord par l’Eurasie (Amérique du nord, Europe et Asie) et au sud par le Gondwana (Afrique, Amérique du Sud, Inde et Australie).
L’isolement de la Nouvelle-Zélande de l’Australie et des autres continents depuis le Crétacé, la transgression marine de l’Eocène (24 millions d’années) et l’apparition de chaines montagneuses au cours des 5 derniers millions d’années (Pliocène) ont permis l’émergence d’une grande diversité d’espèces endémiques de ces insectes.
La Nouvelle-Zélande abrite 56 espèces, classés en 5 genres et regroupées en 3 catégories sur des critères morphologiques et écologiques. Des études récentes en génétiques et moléculaires ont reconsidéré cette classification et la phylogénie de ces espèces : voir le paragraphe sur la phylogénie.
- « Ground Weta » (weta terrestres) : 9 espèces du genre Hemiandrus
- « Tusked Weta » (weta à défenses) : 1 espèce du genre Anisoura et 2 espèces du genre Motuweta
- « Giant Weta » (weta géants) : 7 espèces du genre Hemideina et 11 espèces du genre Deinacrida
La topographie de la Nouvelle-Zélande offre une grande diversité d’habitats et de niches écologiques exploités spécifiquement par une ou plusieurs espèces de weta. Chaque espèce s’est ainsi adaptée à un milieu particulier dont l’aire de répartition peut s’étendre d’une région de quelques hectares à l’ensemble des iles (voir carte 1 et 2 du prochain paragraphe).
Isolée des autres continents avant l’apparition des mammifères, la faune indigène a évolué sans la présence de prédateurs et de compétiteurs mammifères. L’isolement insulaire et l’absence de mammifères ont favorisé une tendance vers le gigantisme chez de nombreuses espèces. Ce processus semble se produire lorsque divers facteurs se combinent : niches écologiques laissées vacantes, ressources alimentaires abondantes et facilement accessibles, absence de prédateurs rapides (endothermes comme les mammifères). Les animaux concernés (oiseaux, reptiles, mollusques ou encore insectes), n’ayant pas besoin de se déplacer pour s’alimenter et fuir le danger, transfèrent les coûts énergétiques liés à ces activités vers un gain de taille et de masse.
Ainsi, certaines espèces de weta, comme Deinacrida heteracantha, peuvent mesurer plus de 80mm de long et peser près de 45g, soit le poids de 2 souris domestiques ! Les weta sont ainsi considérés comme les insectes les plus gros de la planète (lire article sur les records de taille). Le record de poids est détenu par une femelle de cette espèce retenue en captivité ayant atteint 75g.
Cependant, la situation a changé avec les colonisations successives de la région par les hommes. L’installation des Polynésiens, il y a environ 1000 ans, a été accompagnée de l’introduction des premiers rats (Rattus exulans), puis d’autres espèces comme le rat norvégien (Rattus norvegicus), le rat commun (Rattus rattus), les chats et autres mustélidae (fouine, belette, loutre…) sont arrivées avec les européens au cours de ces derniers siècles.
Face à cette nouvelle concurrence et ce nouveau type de prédation, de nombreuses espèces d’oiseaux, de reptiles et d’insectes se sont retrouvées vulnérables. Les mammifères comme les rats, endothermes (au métabolisme rapide et constant), ont rapidement pris le dessus sur les espèces de weta au métabolisme plus lent. La dégradation et la destruction des habitats par les activités anthropiques se sont additionnées, provoquant ainsi la disparition de certaines espèces.
II) Biogéographie
Auparavant, toutes les espèces se partageaient l’ensemble des habitats de la Nouvelle-Zélande, certaines avec des répartitions plus large que d’autres selon les types d’habitats auxquels elles étaient inféodées. Les aires de répartition se superposaient et se connectaient les unes aux autres. Depuis l’arrivée des hommes et de leurs cortèges d’espèces de mammifères prédateurs, la distribution d’un grand nombre de ces espèces a régressé dangereusement au point qu’elles ont quasiment disparu. De toutes petites populations reliques ont toutefois survécu sur de minuscules iles isolées ou des sites éloignés peu accessibles.
Cartes de présence des espèces (Source : Trewick S.A. & Morgan-Richards M. – 2004)
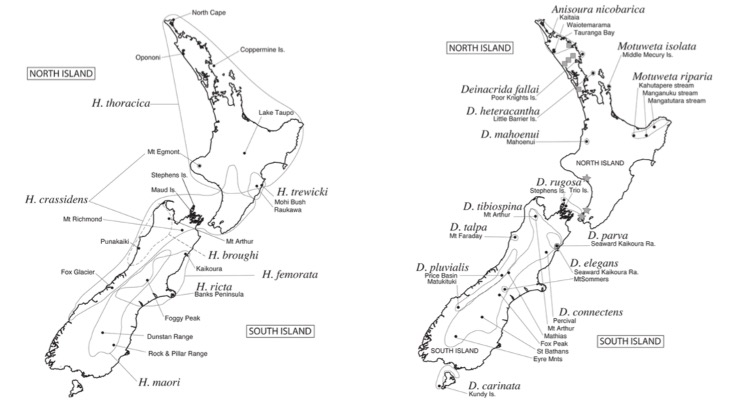
Bien qu’elles aient également souffert de la modification de leur environnement, les espèces du genre Hemideina sont les plus communes de Nouvelle-Zélande. Elles peuvent encore se rencontrer dans les zones anthropisées et même en milieu urbain. L’espèce Hemideina ricta possède toutefois l’aire de distribution la plus réduite, limitée à la péninsule de Banks (voir carte 1).
Les espèces du genre Deincrida, Anisoura, et Motuweta occupent quant à elle des zones préservées de quelques hectares pour certaines d’entres elles. Par exemple, l’espèce Deinacrida heteracantha, la plus imposante (80mm et 45g), ne se rencontre actuellement qu’au nord de la Nouvelle-Zélande, sur l’ile Little Barrier, la moins habitée. Tout proche d’elle, l’ile Middle Mercury abrite sur seulement 13 hectares une autre espèce en voie de disparition : Motuweta isolata (voir photo 1 au prochain paragraphe). Au sud, l’espèce D. carinata n’est présente que sur l’ile de Kundy et au centre, D. rugosa, sur trois iles de l’archipel Stephens (voir carte 2 ci-dessus). L’espèce D. mahoaenui, découverte en 1962 par l’anglais John Charles Watt (1936-2006), ne survit que sur une zone inférieure à 240 hectares et fait l’objet d’un programme de conservation. Une autre espèce, la plus récemment découverte : Motuweta riparia, vit sur les pentes rocheuses près des cours d’eau des régions de Kahutapere, Manganuku et Mangatutara. Cette espèce, en raison des difficultés d’accès de son habitat, n’est sans doute pas si rare.
III) Ecologie
L’écologie des espèces de la famille des Anostostomatidae de Nouvelle-Zélande est différente de celle des espèces d’Australie et de Nouvelle-Calédonie. Elles sont phytophages, nocturnes et s’alimentent sur les arbustes et les arbres tandis que celles d’Australie sont détritivores et se nourrissent sur le sol.
De plus, les weta de Nouvelle-Zélande évoluent dans des environnements tempérés et subalpins alors qu’en Nouvelle-Calédonie et en Australie, les Anostostomatidae vivent dans des forêts tropicales humides et sont absents des régions tempérées.
Nous nous intéresserons ici aux plus grandes espèces de weta : le groupe des « Tusked Weta » (weta à défenses) : genre Motuweta et Anisoura, et les « Giant Weta » (weta géants) : genre Hemideina et Deinacrida (se reporter au paragraphe précédent) (voir album photo en fin d’article).
III) 1. « Tusked weta » : weta à défenses
Ces espèces sont appelées ainsi car les mâles possèdent des excroissances particulièrement impressionnantes sur leurs mandibules formant des défenses recourbées vers l’avant à la manière de celles des éléphants (voir photo 1 ci-dessous).
Issus de ce processus évolutifs en lien avec la compétition sexuelle, ces appendices sont utilisés lors de combats avec des congénères pour l’accès aux femelles durant la période de reproduction.
- Anisoura nicobarica est l’espèce la plus petite de tous les weta : 20-23mm. Les individus, nocturnes, s’alimentent sur le sol de matières végétales et animales en décomposition (détritivores de type charognard). Le jour, ils se réfugient dans des trous dans des troncs et les tiges des arbustes et des arbres, la tête vers l’extérieur afin de pouvoir présenter leurs mandibules à tous intrus. Lors de sa mue, l’insecte n’est plus protégé par une cuticule rigide (lire cet article) : il obstrue alors l’entrée du trou avec un mélange de salive et de sciure de bois. L’espèce se rencontre en milieu forestier mais également dans des environnements plus anthropisés. Elle partage les même habitats que H. thoracica (voir carte 1).
-

Photo 1 : Mâle adulte de l’espèce Motuweta isolata (Source : Mary Morgan-Richards & Steve Trewick) Motuweta isolata et Motuweta riparia sont deux espèces proches dont la radiation est récente (séparation de leur ancêtre commun). M. isolata est la plus grande des deux : 70mm et 20g contre 40mm et 4,5g pour la seconde (voir photo 1). Toutes deux vivent dans des cavités au sol dont elles bouchent l’entrée la journée et lors de la mue, elles s’alimentent la nuit. Les femelles peuvent utiliser plusieurs terriers répartis sur une surface de 20m2. Leur régime alimentaire est semblable à celui de A. nicobarica. M. isolata ne vit que dans les forêts côtières de l’ile Middle Mercury et, bon grimpeur, se nourrit dans la végétation. L’obstruction du trou se fait à l’aide d’un mélange de terre et de salive. M. riparia, l’espèce la plus récemment décrite, est quant à elle inféodée à des habitats rocheux particulièrement inaccessibles proches de cours d’eau (moins de 3m). Les populations ne sont sans doute pas rares, mais leur observation est difficile. Les individus se nourrissent de végétation sur le sol. Le trou est fermé par un mélange de limon et de salive. Cette espèce peut sauter dans l’eau pour fuir une menace. Leur cycle de développement se déroule sur 3 ans, 2 hivers sous forme juvénile et le troisième comme adulte.
III) 2. « Giant Weta » : les weta géants
Les weta géants concernent les espèces des genres Hemideina et Deinacrida, regroupées en fonction de leur écologie.
III) 2. a) Les Hemideina
- Les Hemideina arboricoles : H. thoracica, H. trewicki, H. crassidens et H. femorata
Ces quatre espèces, mesurant 40-60mm, sont les plus communes de Nouvelle-Zélande : elles se rencontrent dans les jardins et autres milieux anthropisés.
Ces espèces vivent dans des cavités en forme de tunnel dans les troncs qu’elles ne creusent pas elles mêmes mais soit par des larves de Ochrocydus hutoni, un coléoptère de la famille des Cerambycidae, soit par des chenilles du papillon : Aenetus virescens (famille des Hepialidae). Des cavités naturelles peuvent également convenir. Contrairement aux espèces précédentes, les Hemideina arboricoles pénètrent dans la cavité la tête en avant, exposant ainsi les éperons de leurs tibias postérieurs aux intrus.
Toutes ces espèces sont strictement phytophages (feuilles, fruits et fleurs). Des invertébrés peuvent occasionnellement être intégrés à leur régime. Aucune plante-hôte spécifique n’est privilégiée, des espèces tant indigènes qu’exotiques peuvent convenir. Cependant, une majorité d’individus est trouvée sur les espèces végétales suivantes : la manuka (Leptospermum scoparium), la kanuka (Kunzea ericoides), la ngaio (Myoporum laetum) et la mahoe (Melicytus ramiflorus).
Les individus demeurent dans les arbres tout au long de leur vie : seules les femelles descendent au sol pour pondre.

Il existe un important dimorphisme sexuel entre mâles et femelles. Les mâles, plus imposants que les femelles, possèdent une tête et des mandibules hypertrophiées : ces traits morphologiques entrent dans la compétition sexuelle et ont donc été sélectionnés au cours de l’évolution. De tels caractères augmentent les chances des mâles d’accéder à un site riche en ressources, de conquérir des femelles et d’obtenir un meilleur succès reproducteur (Fitness) (voir photo 2).
Leur distribution géographique est fonction de l’altitude et du type de végétation. Par exemple, H. crassidens se rencontre entre 0 et 1100m et H. thoracica à des altitudes supérieures à 1100m. Des zones de chevauchement existent vers 800-900m.
- Hemideina terrestres : H. ricta et H. maori
Ces deux espèces vivent dans des régions ouvertes, dépourvues de couvert végétal. Elles se protègent le jour dans des cavités naturelles, ou creusées par des lézards ou d’autres animaux, dans un sol constitué de terre ou de rochers.
Elles s’alimentent la nuit de végétaux et présentent un dimorphisme sexuel.
Leurs aires de répartition se superposent en grande partie (voir carte 1 ci-dessus), H. ricta privilégiant les hautes altitudes (>800m) et H. maori les zones en dessous de 450m. Les deux espèces sont proches phylogénétiquement, leur ancêtre commun ayant divergé récemment (lire paragraphe sur la phylogénie).
III) 2. b) Les Deinacrida
Les weta du genre Deinacrida ont une durée de vie de 3 ans, l’état adulte ne survenant qu’au cours du troisième hiver. Les trois cohortes (catégorie d’âge) cohabitent ainsi en permanence. Les femelles pondent dans le sol à l’automne à l’aide de leur ovipositeur (cirques allongés formant un « sabre », aussi appelé scape).
- Deinacrida arboricoles : D. fallai, D. heteracantha et D. mahoenui
Ces trois espèces sont les plus grandes de Nouvelle-Zélande. Certains individus de D. heteracantha peuvent atteindre 75mm et 45g (voir photo 3). Arboricoles et phytophages, elles se rencontrent uniquement dans des habitats forestiers où les individus utilisent la structure végétale durant la journée pour se camoufler dans la végétation.
D. heteracantha ne survit plus que sur une surface d’à peine 3083 hectares sur l’ile Little Barrier où les rats ont été éradiqués en 1980. L’aire de distribution de D. fallai est également insulaire et se limite à l’ile Poor Knights : aucune preuve de la présence de cette espèce sur les grandes iles de Nouvelle-Zélande n’a été rapportée. Son environnement, dépourvu de toute dégradation et de prédateurs comme les rats, permet encore à D. fallai de prospérer.
La troisième espèce, D. mahoenui, est quant à elle présente dans une petite localité de la grande ile du nord (voir carte 2 et photo 4). Sa population se maintient dans une zone envahie par une plante exogène : le jonc de Barbarie (Ulex europaeus) dont la végétation dense lui offre protection et nourriture. Les protecteurs de la nature se retrouvent ainsi face à un paradoxe où l’élimination d’une espèce envahissante peut aboutir à la perte d’une espèce indigène en voie de disparition.
Les juvéniles de ces trois espèces sont sédentaires contrairement aux adultes. Les larves de D. mahoenui peuvent par exemple réaliser la totalité de leur cycle de développement sur une cité d’un volume de 1 à 3 m3 seulement. Les adultes, quant à eux, sont capables de se déplacer sur plus de 30m durant la nuit, notamment les mâles à la recherche de partenaires sexuels. La journée, ils restent camouflés aussi bien dans les arbres et arbustes qu’au niveau du sol sous des écorces. Les épiphytes (plantes se développant sur d’autres) fournissent également des refuges aux adultes et parfois à des juvéniles en fin de développement. Les cavités sont rarement utilisées en raison de leur taille imposante qui les empêche d’y accéder.

- Deinacrida « Montain-Bluff » : D. elegans
En plus de sa coloration caractéristique : bleu-gris, avec des lignes rouges, noires et blanches sur les pattes, cette espèce se distingue des autres par son habitat particulièrement rocheux (falaise) sans végétation et de haute altitude (800-1700m). La roche doit être stable et offrir des cavités pour permettre aux individus d’y entrer durant la journée. L’espèce est présente dans deux régions : Seawaer Kaikoura et Mont Sommers (Voir carte 2).
D. elegans ne possède pas de comportement défensif comme peuvent l’avoir les autres espèces. Menacé, l’individu saute et se laisse rouler en repliant ces pattes. Cet environnement abrupte demeure même dangereux, car des individus morts en bas des falaises ont pu être retrouvés probablement suite à des chutes.
- Deinacrida du détroit de Cook : D. rugosa et D. parva
Ces deux espèces sont très similaires. Les faibles variations morphologiques et caryotypiques (chromosomiques) ne permettent pas de séparer les différentes populations en deux espèces distinctes.
Comme leur nom l’indique, D. rugosa (et D. parva) sont facilement reconnaissables à la texture rugueuse de la cuticule de leurs tergites (éléments cuticulaires dorsaux de l’abdomen) et de leur thorax, ainsi que par leur couleur brun-ocre, voire paille (voir photo 5). D. rugosa est la plus grande des deux espèces : 32g pour les femelles contre 14,5g pour celles de D. parva.

Elles se rencontrent dans des habitats herbeux (prairies) composés de buissons sur lesquels elles grimpent pour se nourrir la nuit, regagnant le jour leur cavité dans le sol ou sous les pierres. Les individus ont un comportement thigmotaxique (recherche d’un contact avec un objet, une plante ou une pierre par exemple).
Le territoire des mâles est le plus souvent proche de celui des femelles, celles-ci s’accouplant avec de nombreux mâles sur une période de plusieurs mois. Les individus sont sédentaires durant plusieurs jours, voire une semaine, ne s’éloignant pas plus d’un mètre de leur terrier. Après cette période, ils partent sur un nouveau site (50m) pour renouveler le cycle. Les juvéniles réalisent une migration nycthémérale (jour et nuit) entre la végétation et le sol.
Ces deux espèces semble privilégier les cours d’eau des bassins versants au climat alpin et subalpin à des altitudes comprises entre 900 et 1300m.
Elles ont souffert de la présence des rats. Un important programme de conservation (suppression des rats et du bétail) a été entrepris de 1986 à 1989 pour restaurer la communauté écologique typique de la forêt côtière originelle. Une population importante de D. rugosa a cependant survécu sur l’ile Mana malgré la présence de rats.
- Deinacrida alpins du sud-ouest : D. pluvialis et D. talpa
Ressemblant aux espèces du genre Hemideina (cuticule lisse et pigmentation brune), elles habitent les environnements subalpins, herbeux et à fortes précipitations.
Avec une morphologie similaire, ces espèces se distinguent par 1) leur taille : D. pluvialis est plus grande que D. talpa, 54mm et 49mm respectivement ; 2) leur habitat : D. pluvialis privilégie les zones rocheuses tandis que D. talpa les substrats que les individus peuvent creuser pour s’y abriter la tête la première pour bloquer l’entrée avec leurs tibias postérieurs à éperons ; 3) l’altitude de leur habitat : D. pluvialis se rencontre entre 700 et 1700m et D. talpa autour de 1200-1300m.
- Deinacrida de l’ile du sud : D. connectens, D. tibiospina et D. carinata
Ce groupe d’espèces est caractérisé par l’absence d’un organe stridulatoire sur le deuxième termite abdominal (plaque cuticulaire dorsale) et par la présence d’épines sur la face dorsale du fémur. Contrairement aux espèces précédentes, leur cuticule est finement rugueuse.

D. connectens est la plus grande des trois (45mm). De couleur grisâtre, avec des pattes blanches, elle se rencontre en zone montagneuse, sur les pentes arides, rocheuses et dépourvues de végétation à des altitudes s’étendant de 770m à plus de 3600m (voir photo 6). Elle possède l’aire de répartition la plus large de tous les weta géants (voir cartes ci dessus). Nocturnes, les individus passent la journée à l’abris sous les roches.
Cantonnée au Mont Arthur (voir carte 2), D. tibiospina évolue principalement en milieu herbeux entre 1000 et 1500m d’altitude. Avec une taille moyenne de 33mm et 7g, l’espèce est la plus petite du groupe. Sa coloration, généralement plus foncée que D. connectens et tirant sur le brun-rougeâtre, lui permet de se camoufler dans les basses végétations durant la journée.
D. cariant n’est connue que d’une seule localité (ile Kundy). Les connaissances sur son habitat demeurent encore incertaines. Elle mesure en moyenne 40mm pour 6g, ce qui en fait la plus légère du groupe.
IV) Phylogénie
L’éclatement du Gondwana* au Crétacé (80-65 millions d’années), suivi par la séparation de la Nouvelle-Zélande de l’Australie (24 millions d’années), la transgression marine de l’Eocène et la formation de la chaine montagneuse (5 millions d’années) ont engendré une forte pression de sélection sur les écosystèmes et les organismes vivants de Nouvelle-Zélande, favorisant ainsi l’émergence de lignées uniques et d’espèces endémiques comme celles de la famille des Anostostomatidae.
Cette région offre un modèle d’étude intéressant pour comprendre les mécanismes de l’évolution et notamment de la complexité de l’histoire évolutive des weta.
La classification de ces espèces reposait dès lors sur des caractères morphologiques. Or, l’avénement d’outils modernes de génétique moléculaire, ces dernières années, a permis de soulever de nombreuses incohérences.
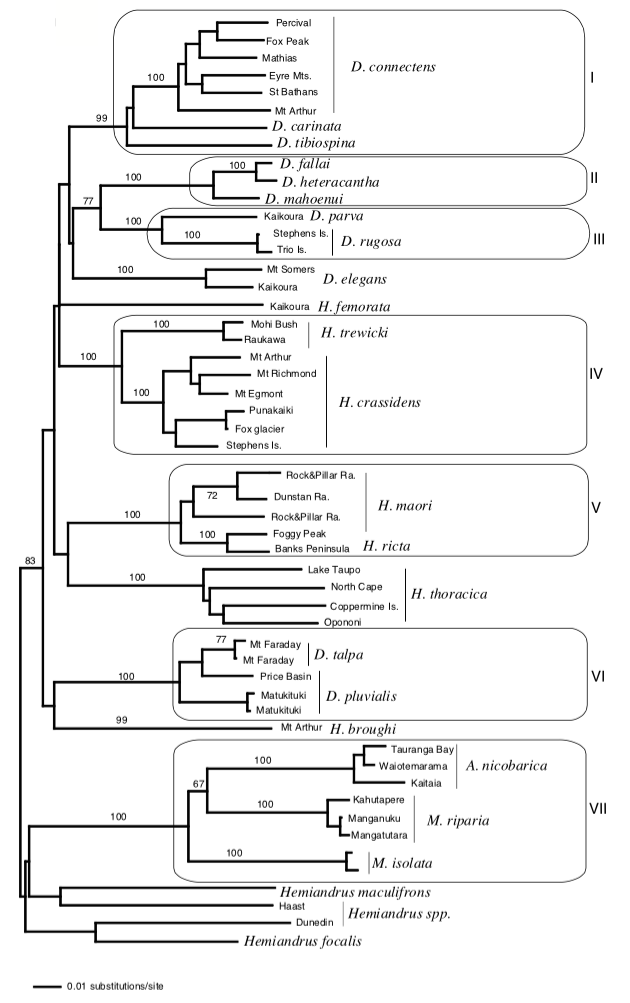
Ainsi, P.M. Johns (1997) proposait que les espèces des genres Anisoura et Motuweta (weta à défenses) soient apparentées aux deux autres genres de weta géants : Hemideina et Deinacrida. L’analyse de l’ADN mitochondrial de ces espèces pas Steven A. Trewick et Mary Morgan-Richards en 2004, a montré, au contraire, que ces deux lignées n’étaient pas apparentées. Il s’avère également que les genres Anisoura et Motuweta ne sont pas proches du genre Hemiandrus (voir illustration 2). La morphologie identique (mandibules hypertrophiées) de ces espèces ne repose pas sur un ancêtre commun mais provient d’un processus synaptomorphique : apparition d’organes homologues de manière indépendante entre plusieurs lignées non apparentées (exemple : ailes des oiseaux et des mammifères). Afin de préciser la place des weta à défenses dans l’arbre phylogénétique, de nouvelles analyses génétiques doivent être entreprises et comparées avec des espèces d’autres genres présents en Australie et en Nouvelle-Calédonie.
Leur étude indique, dans un second temps, que les genres Hemideina et Deinacrida (sous-famille des Deinacridinae) sont apparentés et sont issus d’un même ancêtre commun : ligne monophylétique. La diversification de ces genres en de nombreuses espèces (radiation) coïncide avec l’apparition de la chaine montagneuse alpine au Pliocène (7-2 millions d’années). Cette radiation a été rapide où six lignées ont pu être identifiées : 1) H. broughi/D. pluvialis/D. talpa ; 2) D. mahoenui/D. heteracantha/D. fallai ; 3) D. parva/D. rugosa ; 4) H. crassidens/H. trewicki ; 5) H. maori/H. ricta ; 6) D. connectens/D. tibiospina/D. carinata (voir illustration 3 et 4).
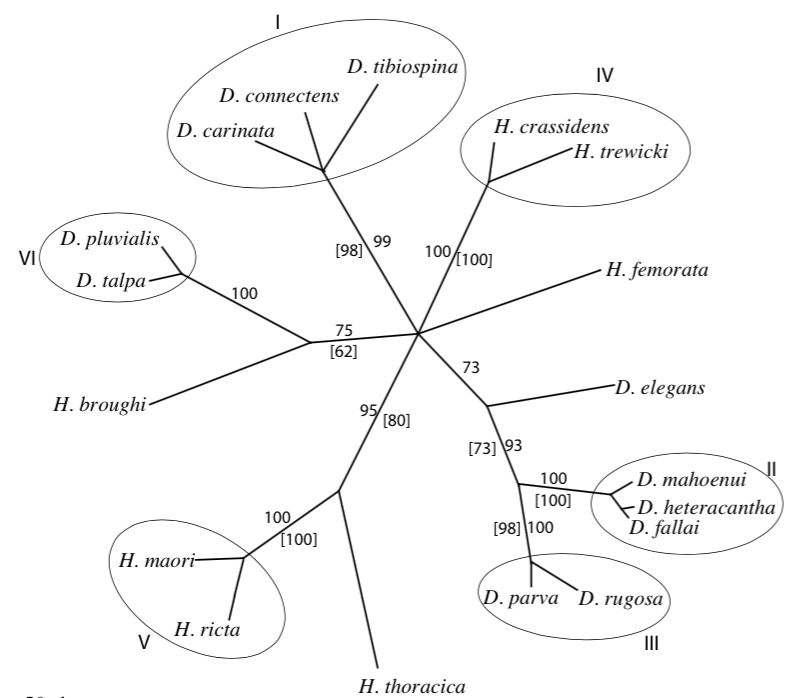
Ce résultat confirme la classification morphologique et écologique présentée précédemment.
La forte diversité génétique existante entre ces espèces permet de suggérer que la radiation entre ces deux genres est ancienne. La radiation entre les weta à défenses (Anisoura et Motuweta), les Hemiandrus et ceux de la sous-famille des Deinacridinae remonte au Miocène (24 millions d’années), donc avant la séparation de la Nouvelle-Zélande et de l’Australie.
Les résultats d’une seconde étude menée par l’équipe de R.C. Pratt en 2008 révèle, de manière plus générale, que la famille des Anostostomatidae s’apparente à celle des Gryllacrididae et des Stenopelmatidae. Aussi, le plus surprenant, est que l’ensemble des espèces de la famille des Anostostomatidae ne soient pas issues d’un ancêtre commun : lignée polyphylétique (voir illustration 4 ci-dessous).
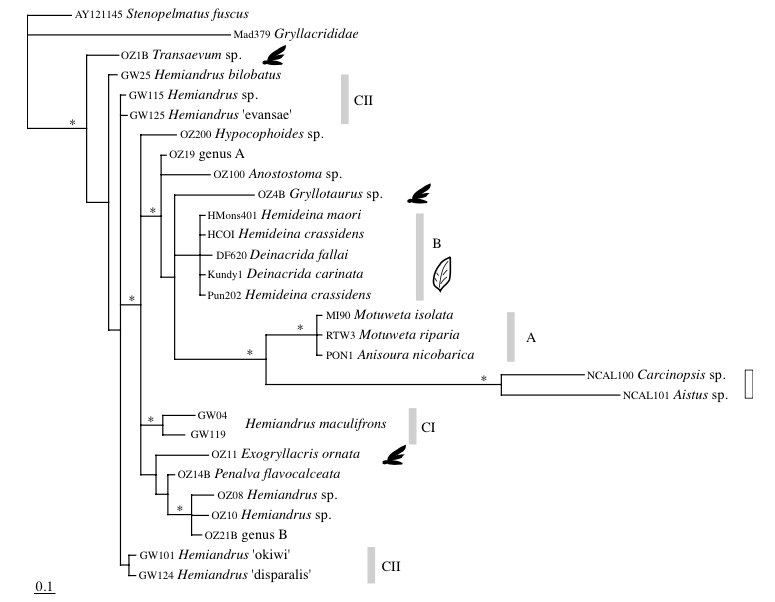
L’étude montre que le genre Hemiandrus est également polyphylétique.
A l’issu de ces recherches, il semble nécessaire de revoir entièrement la classification de cette famille. En effet, certaines espèces non apparentées sont regroupées dans un même genre et, à l’inverse, des espèces apparentées sont intégrées dans des genres différents.
L’histoire évolutive de ces insectes demeurent à ce jour incomplète. L’hypothèse est que les weta se soient diversifiés et aient évolué en prenant possession de niches écologiques laissées vacantes par l’absence de mammifères. Le processus de radiation ayant abouti à l’émergence de toutes ces espèces n’a pas son équivalent chez les vertébrés.
Je tiens à remercier Mary Morgan-Richards – Steve Trewick – Corinne Watts – Danny Thornburrow de m’avoir fait parvenir de si belles photos directement de Nouvelle-Zélande!
Source :
– The Biology of wetas, king crickets and their allies – Ed. Laurence H. Field – 2001
– Morgan-Richards M. & Gibbs G.W. (2001) : A phylogenetic analysis of New Zealand giant and tree weta (Orthoptera : Anostostomatidae – Deinacrida and Hemideina) using morphological and genetic characters. Invertebrate Taxonomy, 15:1-12 (lien)
– Trewick S.A. & Morgan-Richards M. (2004) : Phylogenetics of New Zealand’s tree, giant and tusked weta (Orthoptera : Anostostomatidae) : evidence from mitochondrial DNA. Journal of Orthoptera Research, 13(2) : 185-196 (lien)
– Pratt R.C. Morgan-Richards M. & Trewick S.A. (2008) : Diversification of New Zealand weta (Orthoptera : Ensifera : Anostostomatidae) and their relationships in Australia. Philosophical Transactions of the Royal Society, 363:3427-3437 (lien)
– Watts C. & Thornburrow D. (2011) : Habitat use, behavior and movement patterns of a threatened New Zealand giant weta : Deinacrida heteracantha (Anostostomatidae : Orthoptera). Journal of Orthoptera Research, 20(1):127-135 (lien)
Recommandation d’ouvrages sur cette thématiques :
– The Biology of Wetas, King Crickets and Their Allies (Ed. Laurence H. Field – 2001)
– Peti Futé Nouvelle Zélande (Edition Broché – 21 octobre 2014)
– NZ Wild Life : Introducing the Weird and Wonderful Character of Natural New Zealand (Steve Trewick – 25 juin 2014 – Edition : Penguin NZ)





