Par Thomas Becking
La bactérie Wolbachia pipientis est un symbiote intracellulaire (endosymbiote : il ne vit que dans les cellules de son hôte) (Figure 1) particulièrement commun rencontré chez une vaste gamme d’hôtes invertébrés. Elle doit son nom au fait qu’elle a été découverte pour la première fois chez le moustique Culex pipiens par Simeon B. Hertig et Marshall Wolbach en 1924. Il s’agit d’une alphaprotéobactérie gram-négative de la famille des Rickettsiales.
Si elle a été découverte dès le début du XXème siècle, elle resta longtemps considérée comme appartenant à un genre rare de bactéries, ayant de faibles interactions avec leurs hôtes. Ce n’est qu’à partir du début des années 1990, conjointement avec le développement des approches d’indentification moléculaire (et notamment le développement de la PCR – Polymerase Chain Reaction), que cette bactérie a été identifiée chez un grand nombre d’insectes, et, plus largement chez, un grand nombre d’arthropodes (Figure 1A). Une méta-analyse estime même que cette bactérie pourrait être présente chez plus de 65% des espèces d’insectes : cette estimation en fait d’ailleurs la bactérie intracellulaire la plus présente sur terre, infectant au moins 1 millions d’espèce d’insectes (Werren et al., 2008). Au total, elle est présente chez des nématodes et plus de 40% des arthropodes : chez près de 66% des espèces d’insectes mais aussi chez les chélicérates et chez les crustacés.
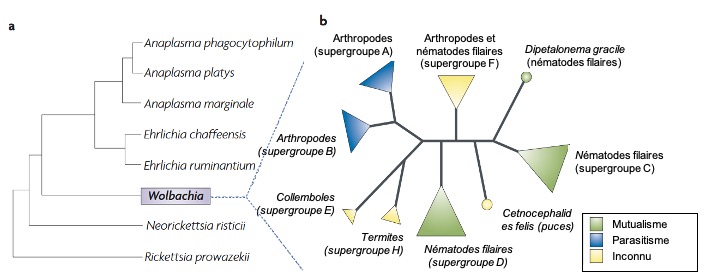
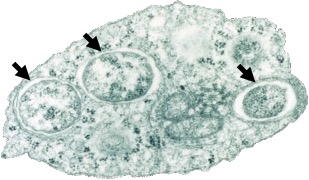
La transmission de Wolbachia s’effectue essentiellement par voie ovocytaire, ce qui signifie qu’elle doit coloniser les cellules de la lignée germinale pour être transmise. Cependant, les phylogénies des différentes souches de Wolbachia et de ses hôtes ne sont pas congruentes, suggérant que des transferts horizontaux de la bactérie se sont produits au cours de l’évolution (Shoemaker et al., 2002). Ces transferts ont pu s’effectuer naturellement par ingestion, par parasitisme ou même par contact direct. En plus de sa présence dans les tissus germinaux, selon l’hôte considéré, cette bactérie intracellulaire est susceptible d’occuper d’autres tissus de la lignée somatique. Plusieurs études in vivo ont décrit sa présence de dans le système nerveux, le système digestif ou encore dans l’hémolymphe d’insectes et d’isopodes terrestres notamment (Dittmer et al., 2014).
L’ubiquité cellulaire et tissulaire de Wolbachia associée à sa proximité avec le cytoplasme (Figure 2) de son hôte expliquerait le fort impact de cette bactérie sur les traits d’histoire de vie de ses hôtes, ainsi que les conséquences phénotypiques qui en découlent.
Un parasite de la reproduction
Pour la majorité de ses hôtes arthropodes, Wolbachia est considérée comme un parasite de la reproduction. L’association entre Wolbachia et ses hôtes paraît être de longue date, compte tenu du nombre d’hôtes touchés par cette bactérie, ainsi que de l’âge présumé de cet endosymbiote, estimé à plus de 200 millions d’années. En effet, la bactérie a développé plusieurs stratégies lui permettant d’accroître son taux de transmission dans les populations hôtes (Cordaux et al., 2011). Si d’autres bactéries endosymbiotiques sont connues pour perturber la reproduction de leur hôte, Wolbachia est à ce jour la seule capable d’induire les 4 types de manipulations de la reproduction connus : 1) l’incompatibilité cytoplasmique ; 2) le male-killing ; 3) la parthénogenèse thélytoque ; 4) la féminisation de mâles génétiques en femelles phénotypiques fonctionnelles.
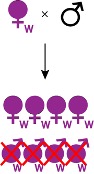
- Incompatibilité cytoplasmique (IC), premier effet connu de Wolbachia, observée à la fois chez les insectes, les chélicérates et les crustacés, constitue la manipulation de la reproduction la plus répandue et supposée la plus ancestrale induite par Wolbachia. Chez les insectes, l’IC reste le mécanisme le mieux décrit et le plus documenté, se retrouvant à la fois chez des espèces de Coléoptères, de Diptères, d’Hémiptères, d’Hyménoptères, de Lépidoptères ou encore d’Orthoptères. Parmi les quatre effets connus de Wolbachia, il s’agit par ailleurs du seul à ne pas induire de biais de sex-ratio. Les femelles infectées par la bactérie disposent d’une meilleure valeur sélective que les femelles non infectées, ce qui favorise la propagation du symbiote dans les populations infectées. Les femelles porteuses de Wolbachia peuvent ainsi avoir une descendance viable en s’accouplant avec des mâles infectés ou non, tandis que les femelles asymbiotiques avortent lorsqu’elles se reproduisent avec des mâles infectés (Figure 3) (Yen & Barr, 1973).
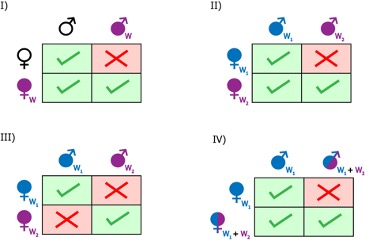
- Males killing : cet effet a pour conséquence la mort ciblée des embryons mâles (Figure 4). Il est observé chez 5 ordres d’insectes mais aussi chez des acariens. Cette manipulation est considérée comme avantageuse pour les femelles de la descendance car elles obtiennent ainsi les ressources allouées théoriquement à leurs frères, avec une possibilité de consommer ces frères morts dans le cas d’hôtes cannibales. Il s’agit d’un male killing qualifié de précoce car ce processus est induit au cours de l’embryogenèse, si ce n’est lors des premiers stades du développement larvaire (Kageyama et al., 2012).
- Parthénogenèse thélytoque : dans le cas d’insectes (Hyménoptères, Thysanoptères) et de quelques acariens ayant un déterminisme du sexe haplo-diploïde, Wolbachia est capable d’induire une parthénogenèse thélytoque (Huigens & Stouthamer, 2003). Pour cela, la bactérie peut induire la diploïdisation des œufs non-fécondés qui se développent ainsi en femelles (Figure 5). Cette diploïdisation peut s’effectuer selon trois modalités distinctes : par l’absence de ségrégation des chromatides lors de l’anaphase (comme chez les guêpes appartenant au genre Trichogramma), par la fusion des 2 cellules filles issues de la première division mitotique (comme chez la guêpe Muscidifurax uniraptor), par des perturbations au niveau méiotique aboutissant à la formation d’œufs diploïdes (comme c’est le cas chez l’acarien Brevipalpus phoenicis).
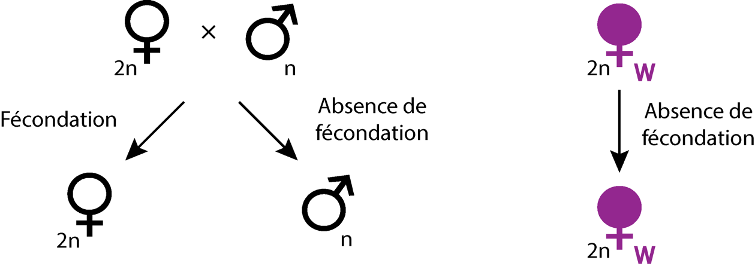
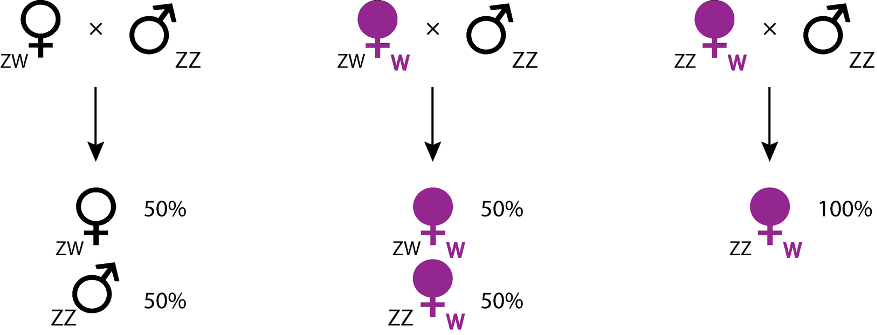
- Féminisation des mâles : un autre effet spectaculaire de Wolbachia est la féminisation des mâles génétiques en femelles fonctionnelles (Figure 6). Celle-ci est rencontrée chez des souches infectant des Hémiptères (chez la cicadelle Zyginidia pullula) ainsi que des Lépidoptères (notamment chez le papillon Eurema hecabe), mais aussi chez des espèces appartenant aux Crustacés : les cloportes (voir ci-dessous). La féminisation a été découverte tout d’abord chez le cloporte commun Armadillidum vulgare (Martin et al., 1973), avant d’être établie dans d’autres espèces d’isopodes terrestres (chez Armadillidum nasatum, Porcellionides pruinosus et Oniscus asellus). Elle est de plus suspectée chez de nombreuses autres espèces d’isopodes.
L’hypothèse d’une bactérie symbiotique féminisante a été proposée dès les années 1940 avec l’observation d’individus intersexués (partageant des caractères à la fois mâles et femelles) dans des populations naturelles d’A. vulgare. La combinaison entre des observations de forts biais de sex-ratio en faveur des femelles et la mise en place de lignées matrilinéaires (suivies de mères en filles) ont permis une investigation plus précise, jusqu’à permettre une observation par microscopie électronique d’une bactérie intracytoplasmique en 1973.
Une « pandémie » qui sauve des vies ?
Depuis plusieurs années, diverses études ont révélé que Wolbachia pouvait être utilisée en lutte biologique afin de limiter la propagation de maladies humaines, dont les vecteurs principaux seraient les moustiques (notamment appartenant à l’espèce Culex pipiens, ou encore au genre Adedes). En effet, ces derniers sont connus comme étant des vecteurs majeurs de la propagation de maladies telles que la dengue, la virose du Nil occidental, la fièvre jaune, le Chikungunya ou encore l’infection Zika (Gould et al., 2017).
Plusieurs études ont démontré que Wolbachia pouvait non seulement diminuer la réplication de certains rétrovirus présents au sein de leurs hôte moustiques, mais en plus potentiellement diminuer le stock d’individus fertiles au sein de population de moustiques, notamment de par l’IC qu’elle peut induire. La combinaison de ces 2 aspects a d’ailleurs conduit à des essais pilotes réussis entraînant la réduction des tailles de population de moustiques, ainsi que le remplacement des populations de moustiques infectés afin qu’ils ne puissent plus transmettre de pathogènes (Bourtzis et al., 2014).
Ainsi, la compréhension des interactions entre Wolbachia et son hôte ouvre ainsi des perspectives dans la lutte biologique contre les agents pathogènes transmis par les insectes, véritable enjeu de santé publique.
Des hôtes aussi chez les cloportes
Les isopodes terrestres (communément appelés « cloportes ») (Figure 7) ont été étudiés depuis déjà de nombreux siècles, puisqu’Aristote (IVème siècle avant J.-C.) les classait parmi le groupe des insectes. Ils ne seront considérés comme appartenant aux crustacés qu’à partir du XVIIIème siècle par Cuvier, qui en dénombre alors 7 espèces dans son essai Mémoire sur les cloportes terrestres. Les cloportes sont classés au sein des isopodes, un ordre particulièrement important en nombre et en diversité d’espèces, puisque plus de 10 000 sont décrites. Si leur position phylogénétique au sein des Pecarida (crustacés dits « supérieurs ») demeure sujette à débat, l’ordre est considéré majoritairement comme un ordre monophylétique.

C’est au sein des isopodes que se retrouve le sous-ordre des Oniscidea, auquel appartient l’ensemble des cloportes. Les Oniscidea constituent un groupe remarquable de crustacés puisqu’il s’agit du seul comptant exclusivement des espèces terrestres. Ce sous-ordre présente donc un intérêt évolutif particulier puisqu’il illustre l’adaptation des crustacés à la vie terrestre. Actuellement, si près de 3 700 espèces de cloportes sont connues, la richesse spécifique des Oniscidea est estimée entre 5 000 et 7 000 espèces. Il s’agit d’un sous-ordre quasi ubiquiste, puisque les isopodes terrestres sont présents dans presque la totalité des écosystèmes à l’exception des pôles et des régions de haute altitude (aucune espèce n’est recensée au-delà de 4 800 mètres).
La grande majorité des isopodes terrestres sont des espèces gonochoriques, comportant donc des individus mâles et femelles.
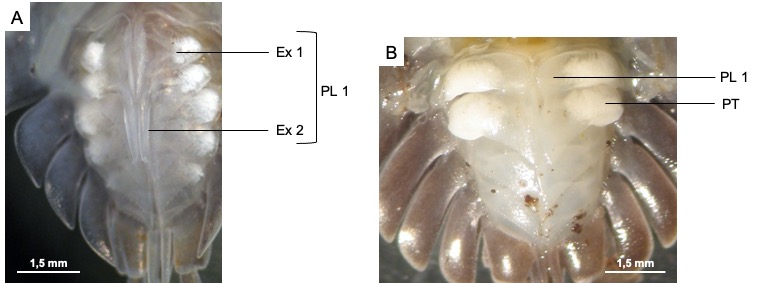
Les mâles disposent de deux paires de pléopodes différenciés en organes copulateurs, sous la forme de deux paires d’endopodites (Figure 8). La première paire est différenciée en stylets copulateurs tandis que la deuxième paire forme une gouttière accolée à la première paire d’endopodites, permettant l’écoulement du sperme.
Les femelles disposent de deux ouvertures génitales, situées à la base de la 5ème paire de patte, qui permettent l’acheminement du sperme vers l’oviducte.
La différenciation sexuelle chez le cloporte
Chez les cloportes, le seul effecteur connu de la cascade de différenciation sexuelle est l’hormone androgène, responsable du développement en mâle. Cet effecteur est d’ailleurs le dernier de la cascade de différenciation sexuelle. Il s’agit d’une hormone circulante, principalement sécrétée par la glande androgène (Figure 9A) située à l’extrémité de chaque utricule des gonades mâles. Les isopodes terrestres mâles comptent ainsi six glandes androgènes (trois par gonade). Les individus naissent sexuellement indifférenciés et se différencient au cours d’une fenêtre temporelle restreinte. En l’absence de l’hormone androgène, un phénotype femelle se développe par défaut (Charniaux-Cotton, 1959).
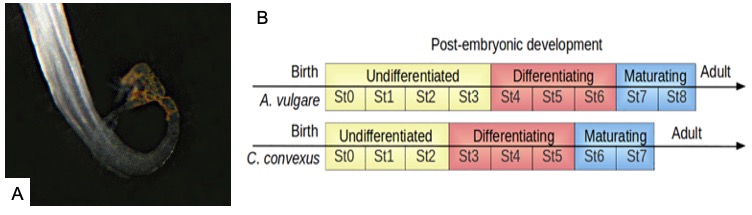
A titre d’exemples, chez le cloporte commun A. vulgare, la différenciation sexuelle débute à partir de la 4ème mue post-natale (Figure 9B) [71–73] tandis qu’elle débute à partir de la 3ème mue chez Cylisticus convexus (Figure 9B) et dès la 2nde mue chez Helleria brevicornis. Ces quelques exemples illustrent la diversité observée dans la chronologie de la différenciation sexuelle des isopodes terrestres.
Cette différenciation sexuelle particulière (différenciation hormone-dépendante des mâles ; existence d’une fenêtre temporelle de différenciation) permet de manipuler expérimentalement le phénotype sexuel des individus. En effet, il est possible d’induire le développement de femelles génétiques en mâles phénotypiques fonctionnels (ces individus sont alors qualifiés de « néo-mâles ») par l’injection de glande androgène au cours des premières étapes de la différenciation sexuelle.
Le déterminisme du sexe des Oniscidae
Comme chez de nombreux organismes, la base du déterminisme du sexe des cloportes est génétique. Les différentes études menées au cours du XXème siècle ont montré que la plupart des espèces d’isopodes terrestres suivait un déterminisme hétérochromosomique du sexe (i. e. mâles et femelles disposent de chromosomes sexuels différents). Ainsi les deux systèmes d’hétérogamétie (XY/XX comme pour les Mammifères, et ZZ/ZW comme pour les Oiseaux) ont été rapportés chez les Oniscidea, parfois au sein d’un même genre (exemple d’A. vulgare [ZZ/ZW] et d’A. nasatum [XY/XX]) (Juchault & Legrand, 1979), voire au sein d’une même espèce (exemple de Porcellio dilatatus dilatatus [XY/XX] et P. d. petiti [ZZ/ZW]).
Les premiers travaux effectués sur le déterminisme du sexe des isopodes terrestres ont consisté à établir les systèmes d’hétérogamétie suivant deux méthodes.
La première méthode basée sur des études cytogénétiques (par observation directe des chromosomes) a permis, dans certains cas, de révéler directement quel est le sexe hétérogamétique (grâce aux différences morphologiques des chromosomes sexuels chez certaines espèces). Cependant, l’analyse caryotypique est le plus souvent complexe et peu informative, compte tenu du grand nombre de petits chromosomes généralement présents chez de nombreuses espèces de crustacés, et notamment chez les Oniscidea. Les chromosomes sexuels ont malgré tout pu être identifiés par cette approche chez quelques espèces d’isopodes terrestres (Mittal & Pahwa, 1981).
La seconde méthode, originale, permet de déterminer le sexe hétérogamétique chez les isopodes terrestres en se basant sur l’analyse du sex-ratio de la descendance obtenue par croisement entre des néo-mâles phénotypiques (qui sont en fait des femelles génétiques transformées expérimentalement en mâles phénotypiques) avec des femelles génétiques (XX) (Becking et al., 2017).
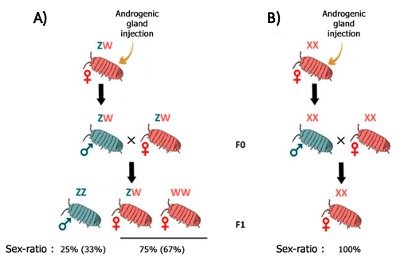
Cependant, les informations concernant la diversité des systèmes d’hétérogamétie rencontrés chez les cloportes demeurent encore largement parcellaires, puisque les systèmes l’hétérogamétie ne sont connus que chez 14 espèces d’isopodes terrestres (sur plus de 3 700 espèces actuellement décrites) (Figure 11) (Becking et al., 2017).
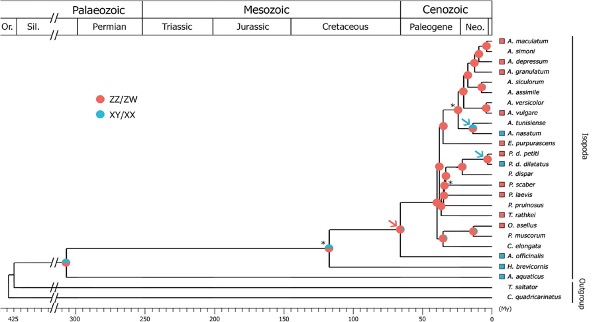
La distribution discontinue des systèmes d’hétérogamétie connus dans l’arbre des isopodes (Figure 11) suggère que des changements de mécanismes se sont produits de façon récurrente au cours de l’évolution de ces taxons. Ainsi, une étude suggère qu’au moins 3 transitions entre mécanismes XY/XX et ZZ/ZW ont eu lieu au cours de l’évolution des cloportes (dont l’apparition est estimée à environ 115 millions d’années), et ce à partir de l’étude de 23 espèces. Si ce nombre de transition est rapporté à l’ensemble des espèces décrites, près de 480 transitions de système de chromosomes sexuels seraient alors survenues au cours de l’évolution des Oniscidea.
Les auteurs de cette étude ont d’ailleurs estimé par une approche probabiliste que jusqu’à 13 transitions pouvaient être survenues à partir des 23 espèces testées. Si ce nombre est extrapolé à l’ensemble des espèces d’isopode terrestre, plus de 2 000 transitions seraient alors survenues au cours de l’évolution des cloportes (à titre de comparaison, aucune transition n’a été observée chez les Mammifères en près de 180 millions d’années). Ainsi, ces informations (bien que fragmentaires à l’échelle des Oniscidea) laissent présager une grande variabilité des systèmes de déterminisme du sexe.
Le clade des isopodes terrestres constitue donc une excellente opportunité d’étude de l’évolution des systèmes d’hétérogamétie, et donc de mieux comprendre non seulement la diversité des mécanismes de déterminisme du sexe rencontrée chez ces espèces mais aussi les forces évolutives qui en sont responsables. La question est donc de savoir quels facteurs pourraient expliquer une telle variabilité et une telle labilité des mécanismes de déterminisme du sexe chez les Oniscidea : le facteur majeur actuellement suspecté s’avère être la bactérie présentée précédemment, Wolbachia.
Conflits génétiques et conséquences sur le déterminisme du sexe des cloportes
L’élaboration de modèles mathématiques a permis de poser pour hypothèse que la féminisation induite par Wolbachia pourrait entraîner, à l’échelle évolutive, des changements récurrents de systèmes d’hétérogamétie via l’existence de « conflits génétiques ». L’association isopodes terrestres/Wolbachia représente le modèle historique ayant permis la découverte de la féminisation. Cette dernière est susceptible de causer de nombreux conflits génétiques, ce qui rend cette association parfaitement adéquate pour l’étude des transitions de systèmes de chromosome sexuel.
Des conflits entre deux éléments génétiques apparaissent lorsque ces éléments subissent des pressions de sélections opposées. Ainsi l’augmentation de la valeur sélective (ou fitness) d’un élément déclenche la diminution de la valeur sélective de l’autre élément. Les Wolbachia féminisantes, et donc perturbateurs du sex-ratio, sont potentiellement responsables de tels conflits. La bactérie favorise les femelles dans les populations infectées et augmente ainsi leur nombre. Les mâles constituent alors le sexe rare. Ainsi les gènes codant pour la fonction mâle sont favorisés par la sélection, contrebalançant le biais de sex-ratio en faveur des femelles et permettant ainsi le retour à un sex-ratio équilibré (dit « équilibre de Fisher » – Fisher, 1930).
De tels conflits s’observent dans des lignées maternelles d’A. vulgare, où des mâles génétiques ZZ sont convertis en femelles phénotypiques fonctionnelles par l’action de Wolbachia, induisant des sex-ratios biaisés en faveur des femelles. En effet, si les femelles génétiques (ZW) produisent 50% de femelles (elles aussi ZW), les portées issues d’individus ZZ féminisées seront typiquement composées de 80% à 90% de femelles ZZ (car féminisées). Si les 2 types de femelles (ZW et ZZ infectées par Wolbachia) ont une fécondité similaire, alors les modèles théoriques prédisent la disparition des femelles génétiques ZW, ce qui est confirmé par l’analyse de données empiriques (Juchault et al., 1980). Dans un tel cas, puisque tous les individus ont un génotype ZZ, le sexe n’est alors déterminé que par la présence ou l’absence de la bactérie. Le déterminant du sexe n’étant plus nucléaire (le chromosome W ayant disparu) mais cytoplasmique (Wolbachia), il est alors possible de parler de « déterminisme cytoplasmique du sexe ». Cette situation, qui provoque d’importants biais de sex-ratio en faveur des femelles, est donc propice à l’évolution de facteurs rétablissant un sex-ratio équilibré.
Un autre perturbateur du sex-ratio, d’origine nucléaire, a aussi été mis en évidence chez certaines lignées d’A. vulgare. Cet élément génétique, appelé « élément f », constitue tout comme Wolbachia un facteur féminisant. A l’époque de sa découverte, il a été proposé que ce facteur puisse résulter de l’intégration d’une partie du génome de Wolbachia dans le génome d’A. vulgare. Ce n’est que plus de 30 ans plus tard que cette hypothèse a été validée, grâce à l’utilisation de technologies de séquençage à haut débit (Leclercq et al., 2016). En effet, il a été démontré que plus de 80% du génome de Wolbachia s’était intégré au sein du génome d’A. vulgare avec un impact fonctionnel direct puisque le chromosome portant cet insert bactérien a la même fonction qu’un nouveau chromosome W (Figure 12)
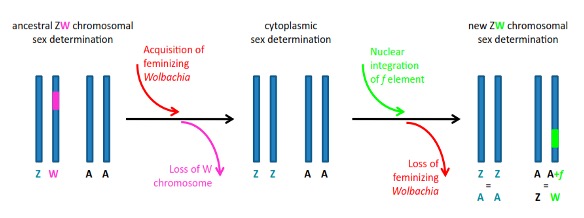
A partir des différents facteurs identifiés chez A. vulgare, un scénario a été élaboré pour expliquer l’évolution dynamique des mécanismes du sexe chez cette espèce. Selon ce scénario, des Wolbachia féminisantes se disperseraient dans des lignées maternelles à hétérogamétie femelle. Les mâles féminisés ZZ envahiraient progressivement la population et remplaceraient les femelles ZW (qui à terme disparaitraient). La population ne serait donc plus composée que de mâles et de femelles ZZ (le sexe n’étant déterminé que par la présence ou par l’absence de la bactérie). Ce scénario prévoit que Wolbachia transfère une part de son génome à l’hôte, générant ainsi l’élément f. Le biais de sex-ratio induit par Wolbachiaou par l’élément f favoriserait ensuite la sélection d’un gène autosomique masculinisant, afin de rétablir un sex-ratio équilibré. La fixation de cet allèle masculinisant dans les populations n’est possible que si le coût de cet allèle est très faible/nul pour son hôte [86]. Ce gène pourrait ainsi constituer un nouveau chromosome sexuel Y, permettant l’établissement d’un système hétérogamétique mâle. A l’inverse, la fixation de l’élément f donnerait naissance à un nouveau chromosome W.
Conclusion
En généralisant ce scénario à l’ensemble des isopodes terrestres, les conflits génétiques entre le compartiment nucléaire hôte et le compartiment cytoplasmique bactérien pourraient donc avoir induit des changements récurrents des déterminants génétiques du sexe chez l’hôte. Ces déterminants seraient régulièrement relocalisés sur différentes paires d’autosomes, et génèreraient constamment de nouveaux chromosomes sexuels, expliquant ainsi la diversité des chromosomes sexuels ainsi que les nombreuses transitions observées au cours de l’évolution des Oniscidea (Figure 5).
Un tel turnover de système de déterminisme du sexe soulève aussi la question du rôle de Wolbachia dans la divergence et la spéciation de ses hôtes. Les chromosomes sexuels peuvent jouer un rôle clé dans l’évolution phénotypique ainsi que dans la spéciation. Par exemple, ces derniers sont souvent porteurs de gènes liés au choix de partenaire ou encore dans l’isolation comportementale, et ce chez une large variété d’organismes tels que chez certaines espèces de poissons (Kitano et al., 2009) ou d’oiseaux (Pryke, 2010). La question de savoir si ces gènes ont suffisamment de temps pour s’accumuler ou s’exprimer de manière sexuellement biaisée sur les chromosomes sexuels chez les cloportes demeure une question totalement ouverte aujourd’hui. Plus globalement, il serait passionnant d’évaluer la contribution des Wolbachia féminisantes comme élément déclencheur de turnovers de chromosomes sexuels par rapport aux mécanismes de spéciation, générant la diversité des espèces de cloporte retrouvées à travers le monde.
L’auteur
J’ai été fortement sensibilisé aux processus de maladies émergentes, mais aussi aux conséquences de l’anthropisation sur le milieu naturel et sur les espèces qui l’habitent. Mes travaux de thèse en biologie évolutive se sont ensuite focalisés sur l’étude des interactions entre isopodes terrestres et la bactérie Wolbachia, et sur les conséquences de ces interactions sur le génome de l’hôte – Laboratoire Ecologie et Biologie des Interactions (EBI) – Université de Poitiers. Page web : https://www.researchgate.net/profile/Thomas_Becking |
Bibliographie
- Becking T ; Giraud I ; Raimond M ; Moumen B ; Chandler C ; Cordaux R, et al. (2017) : Diversity and evolution of sex determination systems in terrestrial isopods. Sci Rep. 7: 1084 (lien)
- Bourtzis K ; Dobson SL ; Xi Z ; Rasgon JL ; Calvitti M ; Moreira LA et al. (2014) : Harnessing mosquito–Wolbachia symbiosis for vector and disease control. Acta Trop. 132: S150–S163 (lien)
- Charniaux-Cotton H (1959) : Etude comparée du développement post-embryonnaire de l’appareil génital et de la glande androgène chez Orchestia gammarella et Orchestia mediterranea (Crustacés Amphipodes). Auto-différenciation ovarienne. Bull Soc Zool Fr. 1959;84: 105–115
- Cordaux R ; Bouchon D & Grève P (2011) : The impact of endosymbionts on the evolution of host sex-determination mechanisms. Trends Genet TIG. 27: 332–341 (lien)
- Dittmer J ; Beltran-Bech S ; Lesobre J ; Raimond M ; Johnson M ; Bouchon D. (2014) : Host tissues as microhabitats for Wolbachia and quantitative insights into the bacterial community in terrestrial isopods. Mol Ecol. 23: 2619–2635 (lien)
- Fisher RA. (1930) : The Genetical Theory of Natural Selection: A Complete Variorum Edition. OUP Oxford
- Gould E ; Pettersson J ; Higgs S ; Charrel R & de Lamballerie X (2017) : Emerging arboviruses: Why today? One Health Amst Neth. 4: 1–13 (lien)
- Huigens M & Stouthamer R (2003) : Parthenogenesis Associated With Wolbachia. Insect Symbiosis. CRC Press. pp. 247–266 (lien)
- Juchault P & Legrand J-J (1979) : Analyse génétique et physiologique de la détermination du sexe dans une population du Crustacé Isopode Oniscoïde Armadillidium nasatum. Arch Zool Expérimentale Générale. 120: 25–43
- Juchault P ; Legrand J-J & Mocquard J-P (1980) : Contribution à l’étude qualitative et quantitative des facteurs contrôlant le sexe dans les populations du Crustacé Isopode terrestre Armadillidium vulgare Latr. I. La population de Niort (Deux-Sèvres). Arch Zool Exp Gén. 121: 3–27 (lien)
- Kageyama D ; Narita S & Watanabe M (2012) : Insect Sex Determination Manipulated by Their Endosymbionts: Incidences, Mechanisms and Implications. Insects. 2012;3: 161–199 (lien)
- Kitano J ; Ross JA ; Mori S ; Kume M ; Jones FC ; Chan YF ; et al. (2009) : A role for a neo-sex chromosome in stickleback speciation. Nature. 461: 1079–1083 (lien)
- Leclercq S ; Thézé J ; Chebbi MA ; Giraud I ; Moumen B ; Ernenwein L ; et al. (2016) : Birth of a W sex chromosome by horizontal transfer of Wolbachia bacterial symbiont genome. Proc Natl Acad Sci. 15036–15041 (lien)
- Martin G ; Juchault P & Legrand JJ (1973) : Mise en évidence d’un micro-organisme intracytoplasmique symbiote de l’oniscoide Armadillidium vulgare Latr. dont la présence accompagne l’intersexualité ou la féminisation totale des mâles génétiques de la lignée thélygène. C R Acad Sci Paris. 276: 2213–2216
- Mittal OP & Pahwa S (1981) : Germ cell chromosomes in two species of terrestrial isopods from India. Experientia. 1981;37: 343–345
- Pryke SR (2010) : Sex chromosome linkage of mate preference and color signal maintains assortative mating between interbreeding finch morphs. Evol Int J Org Evol. 64: 1301–1310 (lien)
- Shoemaker DD ; Machado CA ; Molbo D ; Werren JH ; Windsor DM & Herre EA (2002) : The distribution of Wolbachia in fig wasps: correlations with host phylogeny, ecology and population structure. Proc Biol Sci. 269: 2257–2267 (lien)
- Werren JH ; Baldo L & Clark ME. (2008) : Wolbachia: master manipulators of invertebrate biology. Nat Rev Microbiol. 6: 741–751 (lien)
- Yen JH & Barr AR (1973) : The etiological agent of cytoplasmic incompatibility in Culex pipiens. J Invertebr Pathol. 22: 242–250 (lien)

 Intéressé depuis longtemps par l’écologie et sensible à la Nature ainsi qu’aux organismes qui la composent, mes travaux de recherches se sont focalisés sur l’étude des interactions entre hôte et microorganismes, et ce par des approches physiologiques, génétiques ou encore bio-informatiques. J’ai ainsi étudié les conséquences d’Aphanomyces astaci (Oomycète responsable de la “peste de l’écrevisse”) sur son hôte : l’écrevisse.
Intéressé depuis longtemps par l’écologie et sensible à la Nature ainsi qu’aux organismes qui la composent, mes travaux de recherches se sont focalisés sur l’étude des interactions entre hôte et microorganismes, et ce par des approches physiologiques, génétiques ou encore bio-informatiques. J’ai ainsi étudié les conséquences d’Aphanomyces astaci (Oomycète responsable de la “peste de l’écrevisse”) sur son hôte : l’écrevisse.


