Par Benoît GILLES
Avec près de 100 000 espèces décrites, le règne des champignons constitue l’un des groupes les plus diversifiés des eucaryotes (organismes cellulaires à noyaux) et ayant conquis l’ensemble des écosystèmes terrestres et aquatiques. Ce nombre représente une infime fraction de la diversité connue estimée, quant à elle, entre 1,5 millions et 5 millions d’espèces.
Une des propriétés des champignons est leur propension à former des interactions intimes avec d’autres groupes d’organismes tant animaux que végétaux : 21% des espèces sont associées à des algues (lichens) et 8% entretiennent des relations symbiotiques avec des végétaux (mycorhizes).
Les organismes n’entretenant aucune association fongique sont rares, voire inexistant. Les champignons sont de ce fait des acteurs essentiels dans le maintien des équilibres des écosystèmes.
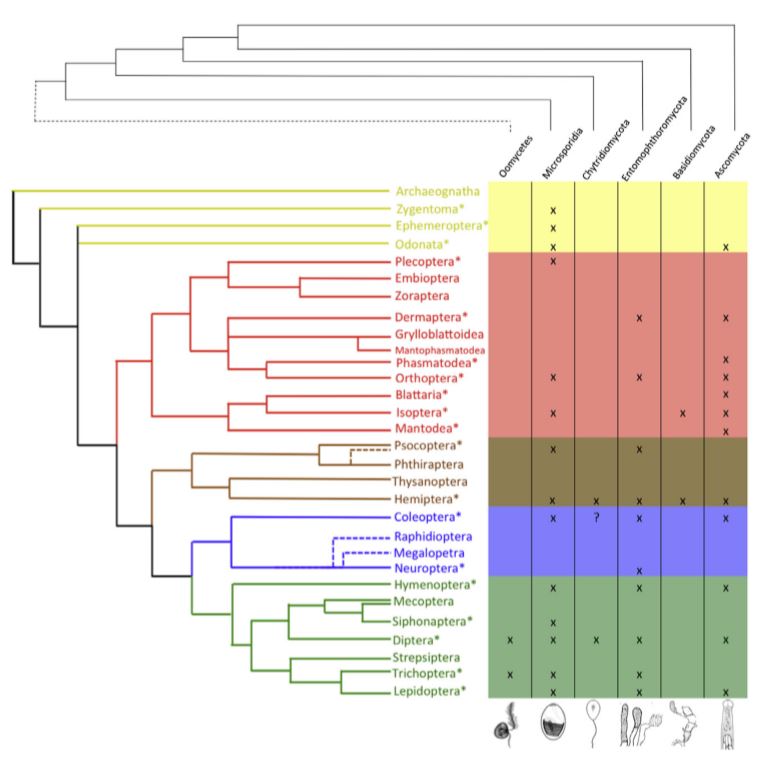
Les insectes, avec plus de 1,1 millions d’espèces décrites, représentent, quant à eux, le groupe d’organismes eucaryotes le plus diversifié. Ils sont connus pour entretenir des relations avec de nombreux taxons de champignons notamment de type 1) endosymbiotiques mutualistes intervenant dans la nutrition (fourmis champignonnistes par exemple) ; 2) commensales ; 3) pathogènes avec des effets prononcés sur les populations.
L’étude des relations entre champignons entomopathogènes et les insectes reste l’une thématique de l’entomologie les moins bien étudiées et offrant probablement l’un des plus grands réservoirs d’espèces fongiques à découvrir.

La première difficulté que rencontre les champignons entomopathogènes est de pénétrer le corps du futur insecte hôte recouvert d’un exosquelette composé en grande partie de chitine. Une fois dans l’organisme, le type développement des champignons dépend du groupe auquel il appartient : formation d’hyphes (succession d’articles composant le mycélium) semblables à celles des levures et multiplication par bourgeonnement (Metarhizium et Beauveria – Hypocrales – Ascomycota), production de protoplastes (fusion des cellules par perte de la membrane externe) (Entomophthoromycota) ou de des filaments non cloisonnés (forme d’hyphes) (Oomycota, Chytridiomycota ou des espèces du genre Entomophthora).
La majorité des champignons entomopathogènes tuent leur hôte avant l’émission des spores (équivalent de la graine chez les plantes) : Hémibiotrophes. D’autres espèces sporulent quant à elle alors que l’hôte demeure en vie (phylum des Entomophthoromycota) : biotrophes.
Dans le milieu aquatique, la transmission à l’hôte est effectuée de manière active, les spores (zoospores) sexuées possèdent un flagelle les rendant mobiles (Chytriodiomycota et les Oomycota par exemple). Les spores peuvent être également de type mitotique asexué, relâchées passivement dans l’environnement, ils sont appelés conidies quel que soit le taxon.
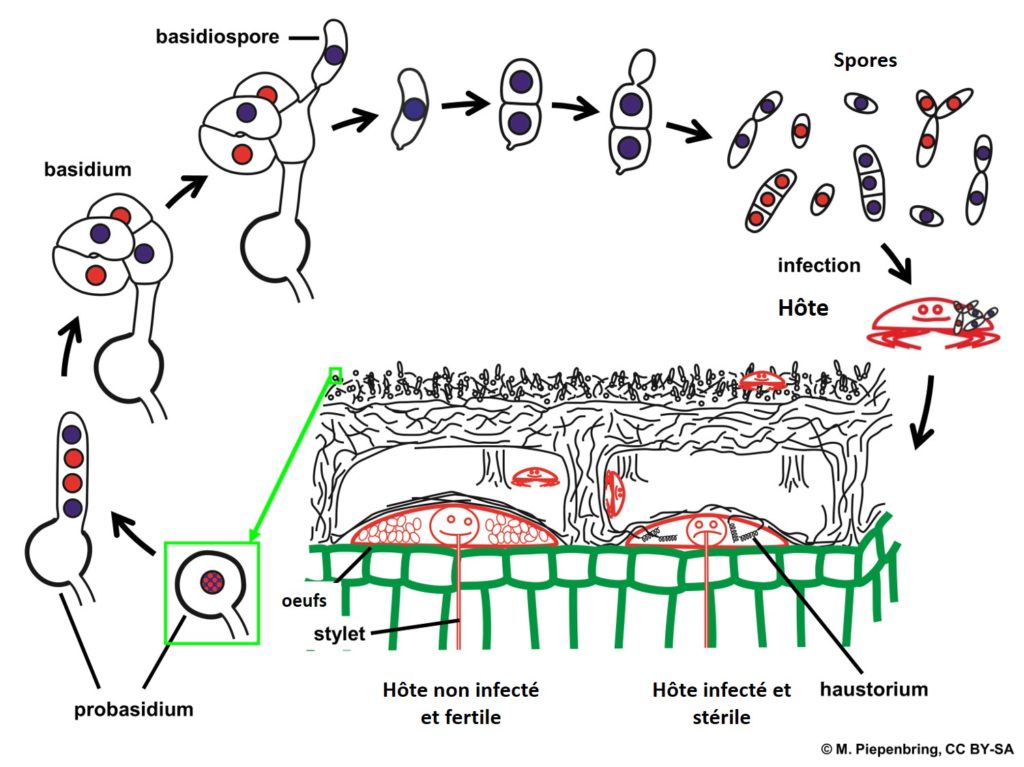
Les spores sont nommées en fonction du groupe auquel ils appartiennent : zygospores (Zygomycètes), basidiospores (Basidiomycètes) et ascospores (Ascomycètes) (figure 1 ci-dessus).
La morphologie et le comportement de germination des spores interviennent dans la systématique et la classification des différents groupes de champignons.
Principaux groupes des champignons entomopathogènes
- Oomycètes
- Microsporidies
- Chytridiomycètes
- Zygomycètes
- Basidiomycètes
- Ascomycètes
1. Oomycètes
1.1. Généralités
Considérées parmi les champignons pour leurs similitudes écologiques et morphologiques avec les champignons, des études phylogénétiques (2006) ont confirmées que les Oomycètes étaient associés au groupe des Stramenophila, un groupement d’organismes morphologiquement divers comme les Hyphochtriomycota et les Labyrinthulomycota.

Les Oomycètes possèdent des caractères biologiques spécifiques comme des spores à paroi épaisse (oospores) possédant deux flagelles (biflagélé), un flagelle en guirlande dirigée vers l’avant et un second plus court dirigé vers l’arrière (figure 1B). Au niveau cellulaire, ils présentent des mitochondries à crêtes tubulaires contrairement à celles des champignons qui présentent des crêtes aplaties en forme de plaque. De plus, leurs parois cellulaires contiennent de la cellulose contre de la chitine chez les champignons (matériaux constituant également l’exosquelette des insectes).
Les Oomycètes sont des parasites et des saprophytes (se nourrissant de tissus morts et de matières organiques). En tant qu’agents pathogènes, les Oomycètes sont capables d’infecter un large éventail d’hôtes tels que les algues, les plantes, les protistes, les champignons, les arthropodes (photo 1 ci-contre) et les vertébrés y compris les humains. Certains genres sont des agents phytopathogènes bien connus comme les membres du genre Phyphthora : agent responsable de la famine irlandaise de la pomme de terre, également à l’origine de la mort subite du chêne qui affecte actuellement des millions d’arbres. Les Oomycètes infectent aussi des arthropodes marins comme le homard et les crevettes.
1.2. Espèces entomopathogènes
Les Oomycètes entomopathogènes sont au nombre de 12 espèces réparties en six genres : Lagenidium (L. giganteum), Leptolegnia (L. caudata et L. chapmanii), Pythium (P. carolinianum, P. sierrensis et P. flevoense), Crypticola (C. clavulifera, C. entomophaga), Couchia (C. amphora, C. linnophila et C. circumplexa) et Aphanomyces (A. laevis).
Les Oomycètes ont été identifiées uniquement chez des larves aquatiques de Diptères des genres suivants : Aedes, Anopheles, Chironomus, Culex, Forcipomyia, Glyptotendipes, Mansonia, Ochlerotatus, Pentaneura, Polypedilum, Tendipes et Uranotaenia.
Un seul un cas d’infections chez une espèce autre qu’un Diptère a été décrit chez Crypticola entomophaga (Thrichoptera) dont les larves sont également aquatiques.
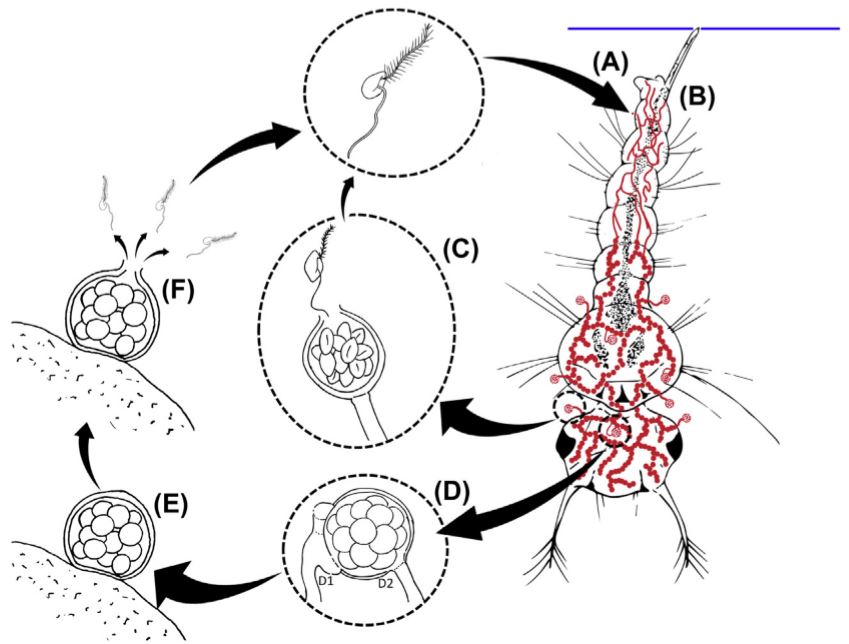
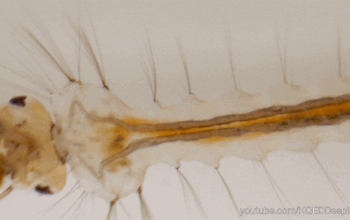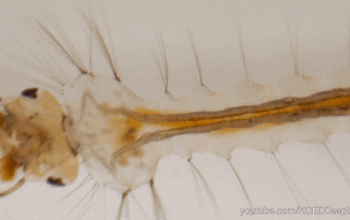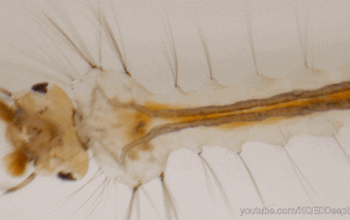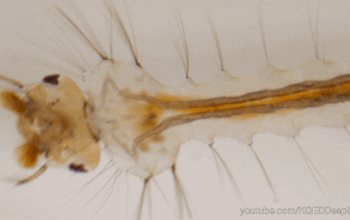
L’espèce d’Oomycètes la plus connue et étudiée est L. giganteum, un parasite facultatif des larves de moustiques (figure 1 ci-contre). Des études ont décrit que le comportement de nage des zoospores vers la surface de l’eau était davantage associé à la forme cellulaire et au centre de gravité qu’à une réponse sensorielle.
D’autres genres comme Leptolegnia, Pythium, Crypicola et Aphanomyces ont cependant peu fait l’objet d’intérêts scientifiques.
Les espèces Leptolegnia caudata et L. chapmanii ont par exemple été isolées de larves de moustique Aedes aegypti, vecteur de la fièvre jaune dont le cycle de vie dont le cycle de vie a été particulièrement bien décrit. Des tests d’infestations chez des Odonata, des Trichoptera, des Coleoptera, des Plecoptera et des Cladocera ont été entrepris sans succès suggérant une spécificité du pathogènes envers les Diptères.
Les espèces du genre Pythium se retrouvent principalement sous forme d’organismes vivant dans le sol ou d’agents pathogènes des plantes. Seules trois espèces sont connues pour infecter des larves d’insectes.
Concernant Aphanomyces, bien que quelques cas d’épizooties ont été signalées, peu d’études ont été publiées sur ce genre.
2. Microsporidies
2.1. Généralités
Traditionnellement, les Microsporidies sont classées dans le phylum des « parasites sporozoaires » (parasites d’organismes pluricellulaires). U nombre croissant d’études soutiennent l’hypothèse selon laquelle les Microsporidies seraient plutôt des champignons parasites endocellulaires.
La caractéristique la plus remarquable de ce groupe est la taille des spores compris entre 1 et 40µm agissant comme une seringue injectant son matériel protoplasmique dans l’hôte au niveau de l’apex à la manière d’un « retournement du doigt d’un gant ».
La gamme d’hôtes de la plupart des espèces de Microsporidies est relativement restreinte : animaux domestiques, poissons, amphibiens, reptiles, oiseaux et mammifères.
2.2. Espèces entomopathogènes
Les Microsporidies sont un groupe d’agents pathogènes comprenant 143 genres avec plus de 1 200 espèces, dont 69 genres infectant, à ce jour, 12 ordres d’insectes. La majorité (42 genres) infectent des Diptères, 5 genres des Ephéméroptères et des Coléoptères, 4 genres des Lépidoptères, 3 genres des Trichoptères, les Orthoptères, les Odonates et les Siphonaptères étant infestés par 2 genres, les Hyménoptères, les Thysanoures et les Isoptères par un seul genre.
Le groupe le plus commun est celui du genre Amblyospora pouvant infecter 79 espèces de mouches réparties en 8 genres. Le cycle de vie de Amblyospora est complexe nécessitant un hôte copépode intermédiaire et deux générations de moustiques afin de réaliser entièrement son cycle.
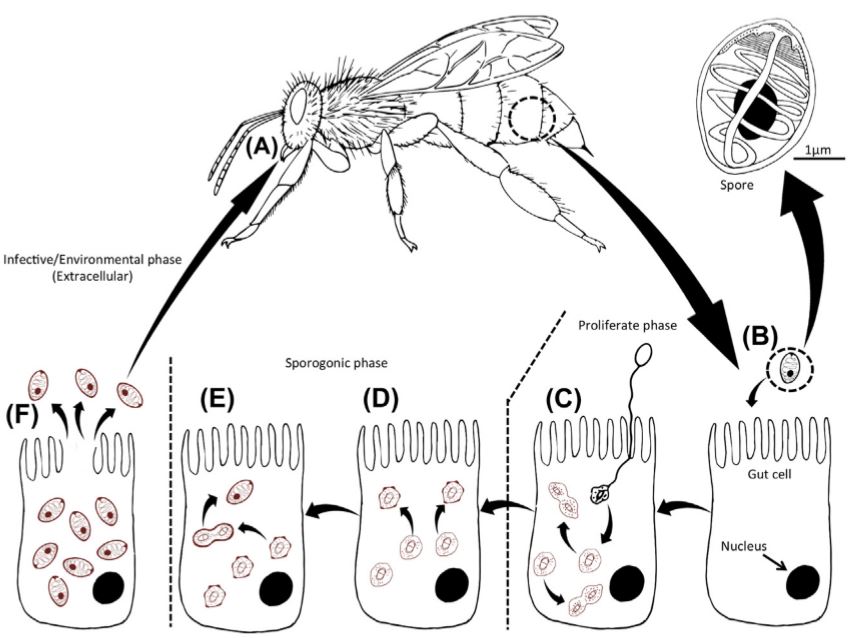
Un autre groupe important parmi les Microsporidies est le genre Nosema (figure 2 ci-dessous). Certains auteurs le considèrent comme le plus largement distribué et étant responsable de la majorité des infections microsporidiennes chez les espèces de Lépidoptères. En infectant les abeilles, les espèces N. bombycis et N. ceranae sont à l’origine d’impacts écologiques et économiques majeurs. La contamination se fait par l’ingestion de spores par des abeilles adultes qui vont ensuite rejoindre puis pénétrer les cellules épithéliales de l’intestin moyen des hôtes. La libération dans l’environnement de nouvelles spores infectieuses se fait avec les excréments, spores qui seront à leur tour ingérées par d’autres abeilles. La structure de la paroi cellulaire des spores est composée de 3 couches leur permettant de résister aux conditions de l’environnement.
3. Chytridiomycètes
3.1 Généralités
Le groupe des Chytridiomycètes est considéré comme la lignée divergente la plus ancienne avec les champignons (Dévonien inférieur : 400 millions d’années). Chytridiomycota est le seul taxon parmi les champignons à posséder des cellules mobiles durant son cycle de vie. Ces zoospores mobiles et aquatiques sont équipées d’un seul flagelle dirigé vers l’arrière : évolution convergente avec les Oomycètes.
La majorité des Chytridiomycètes sont des organismes saprophytes notamment dans les eaux douces et les sols humides, mais aussi de certaines espèces marines. Un nombre important d’espèces sont cependant connues pour parasiter des plantes, des animaux, des rotifères, des tardigrades, des protistes ainsi que d’autres champignons. Les cas de parasitisme chez les insectes sont particulièrement rares.
3.2 Espèces entomopathogènes
Les Chytridiomycètes regroupent 4 genres entomopathogènes : Myiophagus (M. ucrainicus), Coelomycidium (C. simulii), Myrmicinosporidium (M. durum) et le genre le plus diversifié Coelommoyces. Les cas d’infections ont été principalement été recensés chez les Diptères.
Le genre Myiophagus a été décrit chez des larves de Diptères et des cochenilles. En 1978, Doberski & Tribe ont signalé l’espèce Catenaria auxiliaris chez des larves de Coléoptères, cependant, les auteurs ne sachant pas si le champignon a colonisé l’insecte après sa mort (saprophytisme) ou si celui-ci a infecté l’insecte de son vivant, C. auxiliaris n’est actuellement pas considéré comme un entomopathogène.
Le genre Coelomycidium est connu pour infecter spécifiquement les mouches de la famille des Simuliidae. Cette pathologie est caractérisée par des larves remplies de sporanges sphériques dans toute la cavité corporelle.
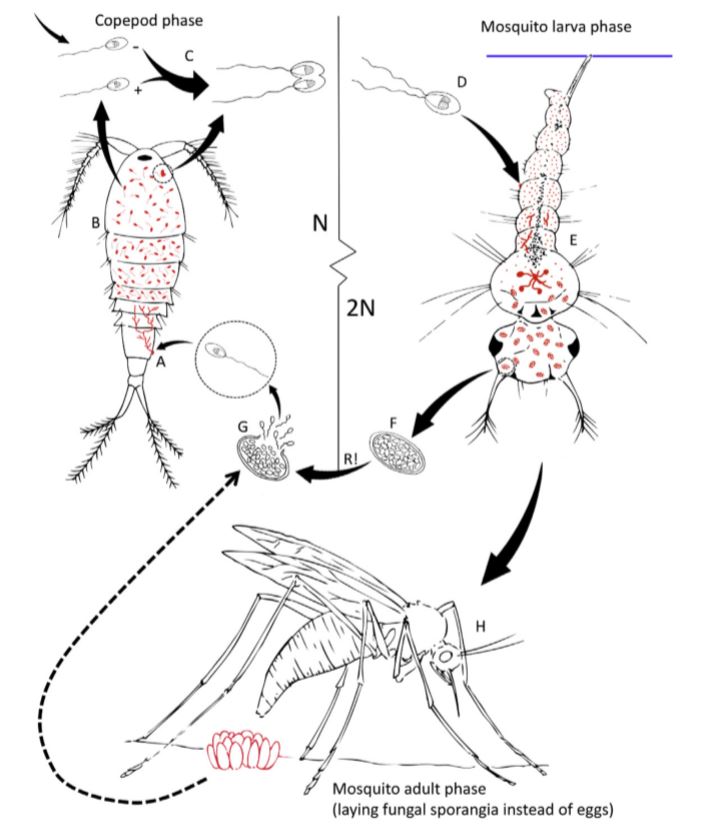
Les espèces de Coelomomyces sont particulièrement bien connues car leurs hôtes sont d’importants vecteurs de maladies humaines (moustiques Anopheles, Culex et Aedes). Les espèces de ce genre peuvent contaminer les œufs, les larves et les adultes.
Chez certaines espèces comme C. phosphorae, un copépode est nécessaire pour achever l’ensemble du cycle de vie (figure 3 ci-contre).
Dans certains cas, le champignon ne tue pas les larves de moustiques, au contraire, il demeure à l’intérieur de l’insecte jusqu’au stade adulte où il colonise les ovaires des femelles. Après le premier repas sanguin de la femelle, les hyphes mûrissent pour devenir des sporanges à l’origine de la production de zoospores. Ainsi, au lieu de pondre des œufs, la femelle « pond » des sporanges remplis de zoospores prêts à infecter de nouvelles larves.
4. Zygomycètes
4.1. Généralités
Le groupe des Zygomycètes est traditionnellement subdivisé en deux classes : les Zygomycètes et les Trichomycètes partageant des caractéristiques communes comme le mycélium cénocytaire (sans septation régulière), la reproduction asexuée et l’absence de cellules à flagelles et de centrioles.
Leur principale caractéristique générale est la production d’une spore de repos à paroi épaisse (zygospore) dans un zygosporange formé après la fusion de deux hyphes spécialisés appelés gamétanges.
Le groupe est écologiquement diversifié et largement distribué, sous forme de saprotrophes dans le sol et les excréments (Kickxellomycotina, Mucoromycotina et Zoopagomycotina), dans le pain, les fruits et les légumes pour certains.

La famille des Zoopagomycotina, également appelée « champignons piégeurs de nématodes », regroupe les espèces mycoparasitaires les plus connues. Celle des Mucoromycotina est quant à elle la plus diverse au sein des Zygomycètes. Sporodiniella umbellata est la seule espèce se rencontrant sur divers insectes comme les Membracidae (Hémiptères s’alimentant de la sève des plantes) (Photo 2).
Les Trichomycètes se rencontrent exclusivement dans les tubes digestifs de divers arthropodes. Cependant, leur présence n’inflige aucun dommage à leur hôte et la nature de leur relation n’est pas entièrement comprise.
L’un des groupes les plus importants de tous les entomopathogènes est celui des Entomophthoramycota. Ils présentent des cellules sporulées (conidiophores) spécialisées reposant sur une croissance de type phototropique positive (en présence de lumière). Les spores sont généralement évacuées de manière active par plusieurs mécanismes différents. Ces pathogènes forment fréquemment des épizooties (maladie frappant l’ensemble d’une population d’une espèce donnée dans une région plus ou moins vaste) tuant un grand nombre d’insectes dans de petites parcelles de forêts ou de systèmes agricoles.
4.2. Espèces entomopathogènes du groupe des Entomophthoramycota
Le taxon des Entomophthoramycota est composé principalement d’agents pathogènes d’insectes, peu infectent d’autres invertébrés, d’algues desmides et de gamétophytes de fougères, certains développent au contraire un mode de vie saprophytes.
Les espèces entomopathogènes sont réparties entre 19 genres : Entomophthora, Conidiobolus, Entomophaga, Erynia, Meristacrum, Neozygites, Strongwellsea, Massospora, Pandora, Eryniopsis (figure 4 ci-dessous), Batkoa, Tarichium, Completoria, Ballocephala, Zygnemomyces, Ancylistora, Ancylistes et Basidiobulus.
Il est difficile d’estimer le nombre d’entomopathogènes existants car nombre de ces genres infectent plusieurs hôtes, et leur taxonomie est en constante évolution. Cependant, une forte diversité morphologique et de stratégies a été décrite au sein de ce groupe.
Les champignons entomophthoroïdes attaquent de manière générale les insectes adultes, d’autres comme E. aquatica, E. conglomerata et Erynia aquatica infectent des larves de moustiques.
La transmission s’effectue par des spores diffusées dans l’environnement de manière active à l’exception d’un seul genre (Massospora) qui libère passivement ces spores alors que l’hôte demeure en vie. D’autres genres comme Strongwellsea et certaines espèces d’Entomophthora, d’Erynia et d’Entomophaga produisent des spores à l’intérieur ou l’extérieur des hôtes avant leur mort. Ces champignons, biotrophiques, ne développent pas de croissance somatique après la mort de l’insecte.
Le cas de Strongwellsea castrans infectant des Diptères Hylemya brassicae et H. platura (Anthomyiidae) sont des exemples classiques de ces situations où la sporulation se produit alors que l’hôte est encore en vie. Les insectes infectés sont caractérisés par la présence d’un large trou circulaire sur le côté latéral de l’abdomen.
C’est l’une des différences majeures avec les champignons hémibiotrophes (Ascomycètes) passant par une phase de parasitisme (biotrophique) et une phase saprophyte à l’intérieur ou à l’extérieur de l’hôte.
Chose surprenante, les insectes infectés peuvent être observés agissant normalement malgré le grand trou dans leur corps et rempli de tissu fongique et de conidiophores (cellules productrices de spores). Les mâles et les femelles ont été décrits comme infectés par S. castrans provoquant la castration et la mort prématurée.
Un autre cas similaire se produit avec Massospora cicadina qui se rencontre chez les cigales (Hémiptères) (figure ci-dessous). Ce champignon déclenche également la sporulation lorsque l’hôte est vivant, engendrant parfois l’effondrement de l’abdomen sous le poids du tissu fongique, voire sa désagrégation totale, ne restant in fine que la tête et le thorax de l’insecte. L’insecte conserve toutefois sa capacité de voler, augmentant ainsi la dispersion des spores dans l’environnement.
Bien que le groupe Mucoromycotina soit le plus grand et le plus diversifié au niveau morphologique des Zygomycètes, une seule espèce est entomopathogène : S. umbellata retrouvé sur des spécimens du genre Umbonia (Hemiptères) en Equateur et des papillons du genre Acraea (Nymphalidae) à Taïwan.
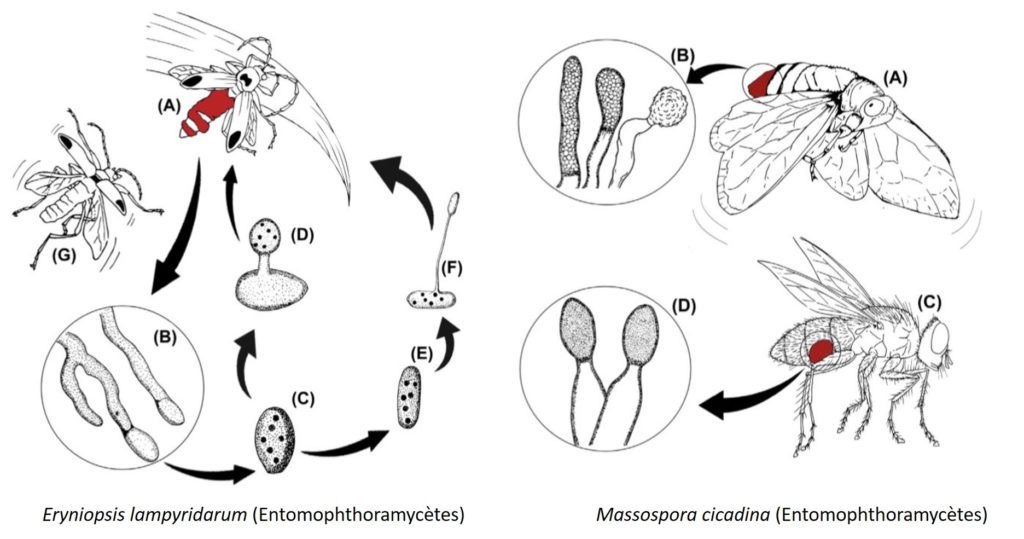
A droite -Cycle de développement de Massospora cicadina – A) dispersion de spores par une cigale vivante infectée dont le corps se désintègre par l’activité fongique – B) cellules productrices de spores (conidiophores) à différents stades de développement – C) mouche présentant un trou sur l’abdomen causé par l’infection fongique – D) conidiophores présentant une spore terminale (Source : Araujo & Hughes, 2016)
5. Basidiomycètes
5.1. Généralités
Ce groupe contient des espèces connues pour les maladies qu’ils provoquent sur des végétaux cultivés : maladie du « charbon », ou de la « rouille ». Les Basidiomycètes se caractérisent par la formation de spores sexuelles (basidiospores) se formant à l’extérieur des cellules reproductrices spécialisées appelées basides. Ces spores sont dans la plupart des cas rejetées de force par des structures spécialisées.
Les Basiodiomycètes présentent certains traits écologiques importants. Ils colonisent le bois mort, décomposant la cellulose et la lignine, agissant également comme des décomposeurs de litière de feuilles sur le sol de la forêt. Les espèces pathogènes des végétaux provoquent d’importants dégâts dans les cultures, mais aussi en environnement forestiers : Armillariella mellea infectant de nombreuses espèces d’arbres et Heterobasidion annosum s’attaquant spécifiquement aux confères. Les espèces pathogènes des animaux comme certaines du genre Nematoctonus sont connues pour parasiter les nématodes.
5.2. Espèces entomopathogènes
Bien que ce phylum soit composé de 31 000 espèces décrites réparties en 1 500 genres, seuls trois d’entre eux sont connus pour infecter les insectes : Fibularhizoctonia infectant les œufs de termites, Uredinella (U. coccidiophaga et U. spinulosa) et Septobasidium (240 espèces) infectant des cochenilles (Hemiptères).
L’ordre des Septobasidiales (Uredinella et Septobasidium) présente une relation particulière et complexe avec leurs hôtes : les Diaspididae (Hemiptera).

Les Diaspididae (cochenilles diaspines – Coccoidea) sont de petits insectes phytophages sédentaires qui passent leur vie entière au même endroit sur une plante, conséquence de leur structure buccale de type suceuse. Pour se protéger, ne pouvant ni se déplacer et ne pouvant survivre sans protection, les juvéniles commencent à sécréter de fins fils de cire blanche qui, dans les 24 premières heures après l’éclosion, formeront une couche protectrice autour de l’insecte. Cependant, les larves demeurent exposées aux facteurs environnementaux.
Toutefois, des champignons du genre Septobasidium, pouvant créer des structures de plus de 20cm composées de tunnels et de chambres, offrent une structure défensive à vie pour les insectes (Figure 5) (photo 3). En contrepartie, le champignon infecte certains individus de la colonie de Diaspididae, provoquant leur nanisme ou la castration. L’atrophie des larves résulte d’une sous-alimentation provoquée par le détournement des nutriments provenant de la sève de la plante hôte par le champignon. Les adultes, également maintenus au réseau fongique par des hyphes, ne peuvent pas quitter le système.
Ce cas fourni un exemple de champignon cultivant des insectes !
Les deux espèces du genre Uredinella (U. spinulosa et U. coccidiophaga) peuvent être différenciées par la forme de leurs spores et du substrat dans lequel elles infectent leurs hôtes : feuilles et tronc pour U. spinulosa et uniquement le tronc pour U. coccidiophaga. Contrairement à Septobasidium qui présente une durée de vie indéfinie, puisque son corps est « renouvelé » à chaque saison par l’infection de nouveaux individus, le genre Uredinella infecte quant à lui uniquement le corps d’un seul insecte, la mort de l’insecte est donc associée à celle du champignon. Les spores sont produites au printemps et atteignent 0,2 à 1,5mm de diamètre.
Un autre cas de parasitisme de Basidiomycètes est celui entre certaines espèces du genre Fibularhizoctonia et des termites souterrains Reticulitermes. Il a été retrouvé parmi les tas d’œufs de ces termites des structures globuleuses (sclérotes) ayant le même diamètre et la même texture que les œufs, imitation telle que les ouvriers s’en occupent comme de leurs propres œufs. Il est suggéré que le champignon soit entretenu par les termites, et qu’il devienne pathogène dès lors que les termites cessent de s’en occuper.
6. Ascomycètes
6.1. Généralités
Le phylum des Ascomycètes est le plus grand groupe du règne des champignons avec plus de 64 000 espèces décrites. La plupart d’entre elles sont filamenteuses, produisant régulièrement des hyphes cloisonnés. Ils se caractérisent par la formation de spores sexuelles (ascospores) dans des structures en forme de sac appelés asques. Leur diversité écologique comprend des décomposeurs, des agents pathogènes de plantes, d’humains et d’animaux, ainsi que des relations mutualistes (lichens par exemple).
La majorité des espèces entomopathogènes possède une phase parasitaire bien développée infectant le corps de l’hôte. De plus, après avoir tué l’insecte, ce groupe est capable de coloniser le cadavre en passant à la nutrition saprophytique (hémibiotrophique), tout en maintenant la croissance de l’hyphe. Ces entomopathogènes seraient apparus et diversifiés dans les premières forêts tropicales humides.
La grande majorité des ascomycètes entomopathogènes forment leurs spores à l’intérieur de structures appelées péithèces.
6.2. Espèces entomopathogènes
Ce groupe comprend de nombreux champignons entomopathogènes (Pleosporales, Myriangiales, Ascosphaerales et ceux plus connus Hypocreales). Pour chacun des taxons, l’insecte meurt avant que le champignon débute sa phase de reproduction.
Ainsi, au sein des Pleosporales, les espèces entomopathogènes appartiennent au genre Podonectria, partageant des aspects inhabituels comme une coloration brillante, infectent des cochenilles, couvrant l’ensemble du corps d’une croûte de coton sur laquelle des spores multiseptées (cloisonnés) sont produits.
Les Myriangiales comprennent un certain nombre d’espèces associées aux plantes et aux cochenilles. Les espèces entomopathogènes présentent une croissance pérenne durant plusieurs années ou au moins jusqu’à la mort de la branche infestée par manque de nourriture. Les insectes hôtes sont remplis et recouverts de mycélium, la reproduction du champignon repose sur la production d’ascospores en absence de conidies (spores asexuées).
Le genre Ascosphaera (30 espèces) constitue un groupe d’agents pathogènes associés aux abeilles. La plupart des espèces sont saprophytes, se nourrissant exclusivement de miel, de cocons, des excréments larvaires ou les matériaux de nids tels que les feuilles, la boue ou la cire d’abeilles. Cependant, certaines espèces sont connues comme agents fongiques attaquant le couvain de nombreuses espèces d’abeilles solitaires et sociales, provoquant une maladie appelée « couvée de craie ».
L’infection survient lorsque la larve ingère des spores fongiques, le champignon se développe ensuite sous forme d’hyphes dans le corps de l’insecte, la tue et diffuse des spores à la surface de la cuticule.
La morphologie des Ascosphaera est particulièrement singulière par rapport à d’autres groupes fongiques. Les ascospores sont contenues dans une seule cellule agrandie formant un kyste brun à brun noirâtre : l’ascome. Leurs spores présentent également une curieuse similitude avec les grains de pollens.

Les Hypocreales englobent des genres importants d’entomopathogènes : Cordyceps, Tolypocladium, Hypocrella, Ophiocordyceps, Moelleriella, Samuelsia et Torrubiella.
Ces champignons sont connus pour infecter des mouches blanches (aleurodes – Aleyrodoidea) et les cochenilles des forêts tropicales, et provoquer des épizooties dans la population hôte. Peu de cas ont cependant été recensés en milieu subtropical.
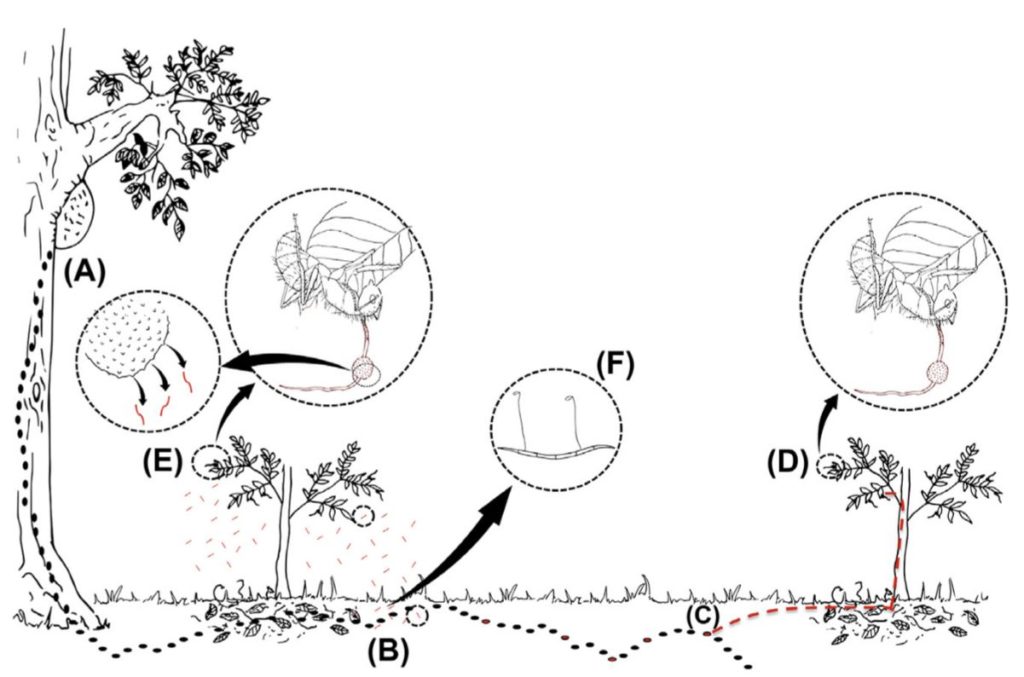
Le genre Ophiocordyceps, en particulier les espèces attaquant les fourmis, est connu pour provoquer d’énormes infestations dans de petites zones appelées cimetières (figure 6 ci-dessus). En effet, l’un des phénomènes les plus fascinants concernant les champignons entomopathogènes est le comportement des fourmis zombies causé par Ophiocordyceps unilateralis. Décrite par Tulasne & Tulasne en 1865, l’espèce manipule de manière adaptative le comportement des fourmis ouvrières, obligeant les insectes à quitter la colonie pour trouver un site offrant un microclimat optimal pour que le champignon puisse produire ces ascospores. Les fourmis meurent en mordant fermement sur le dessous ou le bord d’une feuille, tige, branche, etc. (photo 4 ci-contre). La position que prend l’insecte à sa mort dépend de l’espèce de champignon (figure 7 ci-dessous).

Tableau de synthèse des relations entre hôtes et entomopathogènes associés
Facteurs et mécanismes évolutifs à l’origine d’une diversité des entomopathogènes
La grande majorité des espèces d’entomopathogènes ont été recensées chez des Hemiptères suceurs de sèves. Par exemple, 180 espèces de champignons du genre Ascomycota infectent essentiellement des Hemiptères dont la plupart des cas sont des infections au stade adulte de l’insecte. Le groupe Hypocrellae Aschersonia (92 espèces) sont responsables de plus de la moitié des infections chez les Hemiptères des familles des Coccidae, des Aleyrodidae et des Lecaniidae.
Pourquoi les Hemiptères sont-ils des hôtes privilégiés pour les champignons entomopathogènes ?
Une étude de 2007 suggère que les Hypocreales auraient évolué à partir d’un ancêtre commun se développant au détriment de végétaux. Au cours de l’évolution, plusieurs transferts horizontaux (entre 5 et 8) auraient eu lieu entre la plante et l’insecte se nourrissant de la plante infectée.
Comment cela est-il survenu ?
Les insectes, apparus durant le Dévonien (les premiers fossiles datent de -407 millions d’années), ont connu deux événements majeurs de diversification. L’un, ayant permis l’apparition des principaux ordres d’insectes actuels, s’est produit avec le rayonnement des plantes à graines (spermaphytes) au Permien (-299-251 millions d’années), le second avec l’apparition des plantes à fleurs (angiospermes) au Crétacé inférieur (-130 millions d’années). Au cours de ce deuxième événement de diversification, des pièces buccales en forme de stylets longs et fins capables de créer une forte aspiration de la sève des plantes sont apparus chez un groupe d’insectes dont les descendants forment l’ordre des Hémiptères. Cette innovation a permis à ces insectes d’exploiter une nouvelle niche écologique sans concurrent.
Dans le même temps, certains champignons exploitant les tissus végétaux ont profité de cette proximité avec ces insectes pour effectuer un transfert vers ces derniers et profiter d’une nouvelle niche écologique (-190-150 millions d’années). La contamination avec divers insectes Hemiptères se serait effectuée par contact de proximité sur les végétaux hôtes. En effet, le groupe Hypocrellae Aschersonia présente des spores mitotiques adaptées à la dispersion à courte distance par la pluie sur la surface des feuilles.
Par la suite, le transfert se serait produit entre des insectes phytophages et des espèces qui ne l’étaient pas. Ces changements d’écologie ont donné naissance à trois des familles entomopathogènes les plus importantes : Clavicipitaceae (Hypocrella, Moelleriella, Samuelsia et Metacordyceps), Cordycipitaceae (Cordyceps et Torrubiella) et Ophiocordycipitaceae (Ophiocordycepsly, Tolypocladium). Cette stratégie a sans aucun doute été efficace comme l’illustre la diversité en espèces, la répartition mondiale et l’abondance écologique de ces champignons.
Un autre cas intéressant de diversité inhabituelle d’infections fongiques d’insectes est celui des mouches (Diptères). Bien que le nombre d’espèces concernés soit plus faible que pour les Hemiptères, il est remarquable que les Diptères soient le seul ordre d’insectes présentant des cas d’infestations à tous les stades de développement : œufs, larves, pupes et adultes. Parmi les 6 grands groupes d’entomopathogènes fongiques, seul celui des Basidiomycètes n’enregistre aucune contamination de Diptères.
Pourquoi les mouches sont-elles des hôtes pour les champignons entomopathogènes ?
Une des raisons repose probablement sur le fait que les mouches soient l’ordre des insectes le plus diversifié sur le plan écologique : hématophages, endoparasites et ectoparasites de vertébrés et d’invertébrés, prédateurs de larves et d’adultes d’arthropodes, parasitoïdes, pollinisateurs, phytophages, saprophytes, etc. De plus, les larves se développent dans des environnement aquatiques, semi-aquatiques, terrestres (humus, bois, champignons, etc.). Le fait d’occuper une telle diversité de niches écologiques a exposé les mouches et à augmenter les risques d’infections par des pathogènes fongiques et Oomycètes évoluant dans ces milieux.
Il est cependant remarquable que certaines espèces de mouches puissent être contaminées par 5 ou 6 groupes d’entomopathogènes différents et à tous les stades de développement. Cependant, la diversité d’entomopathogènes s’attaquant aux Diptères demeure faible au vu de la diversité des mouches (plus de 150 000 espèces).
Au-delà des ordres d’insectes évoqués précédemment, les larves de Lépidoptères et de Coléoptères sont également sujettes à des infections par des champignons entomopathogènes (Ascomycètes). Les larves de ces insectes sont principalement infectées par près de 90 espèces des genres Cordyceps et Ophiocordyceps. Les adultes sont quant à eux peu touchés par ces pathogènes, seuls 10 et 11 mentions pour les Lépidoptères et les Coléoptères respectivement.
Quels facteurs favorisent une telle prédominance des infections aux stades larvaires ?
Un certain nombre de traits biologiques différents entre les larves et les adultes peuvent être cruciaux pour expliquer ce schéma : 1) niches écologiques différentes – En tant qu’holométaboles, les stades larvaire et adulte sont séparés sur le plan écologique, occupant des micro-environnements complétement différents, évitant ainsi la concurrence entre les juvéniles et les adultes, 2) prévisibilité dans les échelles de temps – les larves de Coléoptères et de Lépidoptères présentent généralement une mobilité modeste par rapport aux adultes, 3) taux d’alimentation – la larve a besoin de manger de grandes quantités de nourriture et de stocker cette nourriture afin de croître le plus rapidement possible, 4) protection (cuticule) – les larves possèdent une cuticule plus fine et perméable pour croître à un rythme élevé et cela serait impossible d’être contaminé si elles avaient l’exosquelette dur des Coléoptères adultes.
L’autre ordre holométabolique majeur infecté par les Hypocreales est celui des Hyménoptères (abeilles, fourmis et guêpes). La plupart des infections se font durant la phase adulte. La socialité chez un grand nombre d’espèces de cet ordre réduit les risques d’infections fongiques, notamment chez les larves, en raison d’un toilettage constant des larves et entre individus d’une même colonie.
Bibliographie
- Araujo J.P.M. & Hughes D.P. (2016) : Diversity of entomopathogenic fungi : which groupes conquered the insect body ? Advances in Genetics, 94 (lien)



Bonjour et merci pour ce formidable article…
Merci pour ce partage de savoir !
Au plaisir de vous lire de nouveau !
Guillaume
NATURE FORMATION BRETAGNE