Par Julien ROYET
Apparus sur notre planète il y a plus de 3,5 milliards d’années, les micro-organismes co-évoluent depuis avec les animaux qui eux, sont apparus par la suite. De cette cohabitation est née une étroite interdépendance entre les hôtes et les microbes qui les entourent, qui les infectent ou qui leur sont associés. Il est établi que les microorganismes, voire plus particulièrement ceux qui composent le microbiote intestinal (ensemble des micro-organismes vivant dans un environnement spécifique d’un hôte), peuvent influencer de nombreux paramètres biologiques de l’hôte, tels que sa fécondité, son métabolisme ou encore sa physiologie (de Roode & Lefevre, 2012 – Lefevre et al., 2012). Il n’est pas surprenant que les micro-organismes puissent également interagir avec le système nerveux et avoir un impact important sur le comportement des animaux qu’ils infectent. Les interactions entre microorganismes et système nerveux, nombreuses, peuvent être envisagées à différents niveaux.
Pour le meilleur et pour le pire
Si un grand nombre de microbes sont pathogènes et constituent une menace pour la survie de l’animal, d’autres, comme ceux qui composent son microbiote symbiotique, jouent un rôle bénéfique pour l’hôte (Storelli et al., 2011 – Shin et al., 2011). Lorsqu’ils se déplacent dans leur environnement, les animaux ont donc intérêt à distinguer les microorganismes bénéfiques des microorganismes potentiellement nuisibles. Pour cela, des mécanismes permettent, via le système nerveux périphérique, de détecter les composés chimiques produits par les microbes et utiliser cette information sensorielle pour éviter d’être contaminés par ceux qui sont pathogènes (figure 1). Une détection rapide des microorganismes nocifs peut être bénéfique pour l’hôte à bien des égards. En diminuant son exposition à un agent pathogène, un animal augmente ses chances de survie et limite la propagation de la menace à ses congénères et à sa descendance.
De plus, il évite l’activation d’une réponse immunitaire souvent énergiquement coûteuse. Dans d’autres situations, les microorganismes peuvent, au contraire, constituer des sources d’informations précieuses qui indiquent un site favorable pour se nourrir, pour pondre ou pour élever sa descendance. Dans ce dernier cas, la détection par le système nerveux, ne provoque pas la fuite de l’hôte mais favorise au contraire son association avec le microorganisme bénéfique ou inoffensif (Lafferty & Shaw, 2013 – Liu et al., 2017).
Les interactions entre microorganismes et système nerveux peuvent également modifier le comportement de l’hôte infecté (Elya et al., 2018). Si certains de ces changements de comportement sont considérés comme des effets secondaires inhérents à la modulation de l’homéostasie de l’hôte (perte d’appétit, état de somnolence…), des études génétiques démontrent que d’autres effets résultent d’un dialogue moléculaire direct entre le microorganisme et le système nerveux de l’animal. Ils pourraient représenter une réponse immunitaire réduisant les conséquences de l’infection pour l’hôte ou pour sa progéniture :on parle alors d’immunité comportementale.
Enfin dans des cas plus rares, les microorganismes atteignent directement les cellules du système nerveux qu’ils agressent, déclenchant des pathologies comme les méningites, le zona, la maladie de Lyme, etc.
La drosophile peut-elle aider à comprendre les interactions bactéries-neurones ?
Les interactions entre les microorganismes et le système nerveux des animaux sont donc nombreuses et essentielles pour l’hôte comme pour le microorganisme. Si les recherches visant à comprendre ce dialogue inter-espèces sont en plein essor, dans la plupart des cas, les molécules microbiennes, les cellules de l’hôte impliquées et les mécanismes par lesquels les premiers affectent les second demeurent inconnus. L’immense diversité des microbes qui cohabitent avec les animaux et l’extrême complexité du système nerveux des eucaryotes supérieurs tels que les mammifères compliquent énormément la tâche. L’élucidation de la relation de cause à effet entre les interactions hôte-microbe et les changements de comportement peut être facilitée par l’utilisation de modèles animaux relativement simples et sur lesquels les études génétiques sont plus aisées.
Ces dernières années, les études menées sur deux invertébrés, la drosophile (Drosophila melanogaster) et un nématode (Caenorhabditis elegans), ont non seulement permis de mettre en évidence l’étendue insoupçonnée des interactions entre les microorganismes et le système nerveux des animaux, mais ont aussi commencé à révéler la nature des molécules microbiennes perçues par les neurones, le type de neurones qui les détectent et les conséquences comportementales associées à leurs interactions réciproques (Masuzzo et al., 2020).
Nous présentons les résultats récents de notre équipe (Institut de Biologie du Développement de Marseille (IBDM)) sur les interactions entre bactéries et neurones chez la drosophile.
Un modèle d’étude de la réponse immunitaire contre les bactéries
Comme tous les insectes, la drosophile est dépourvue de système immunitaire adaptatif et donc de lymphocytes producteurs d’anticorps. Sa capacité à se défendre contre les infections microbiennes dépend donc d’une immunité, plus ancienne dans l’évolution, appelée immunité innée. Présente aussi chez les mammifères elle se caractérise par la production dans l’hémolymphe des individus infectés, de peptides qui possèdent une activité antibactérienne et vont donc détruire les bactéries infectieuses. Mais comment la mouche détecte-t-elle la présence de ces bactéries et déclenche-t’elle la synthèse de ces peptides ?
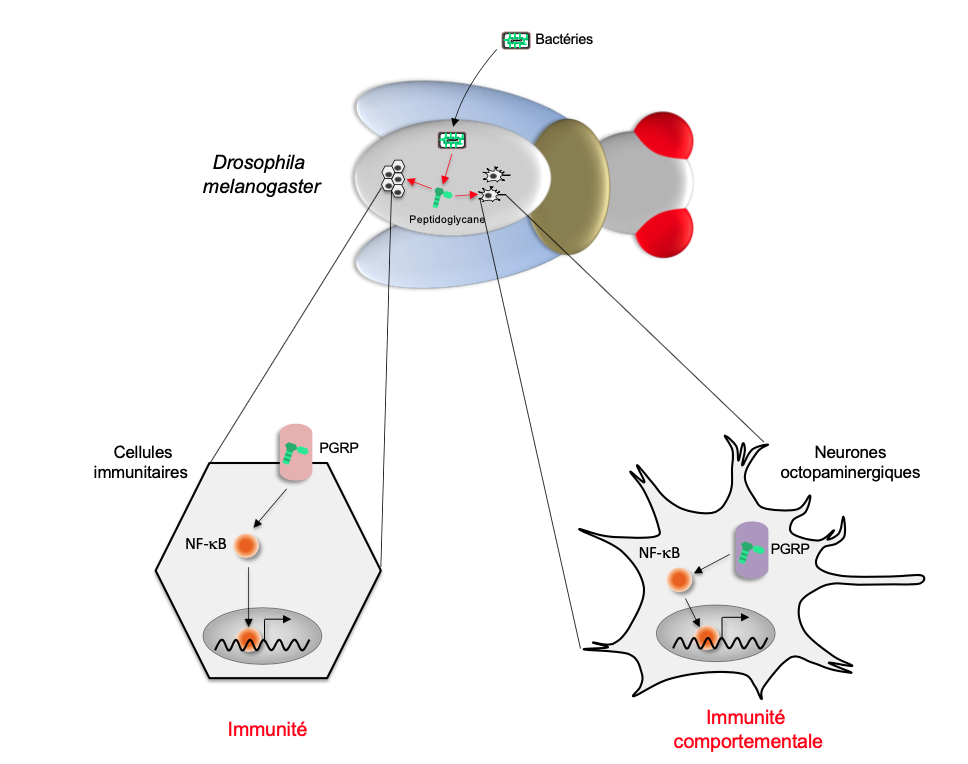
Les travaux de nombreux laboratoires ont démontré que le système immunitaire de la mouche, et sans doute de celui de la grande majorité des invertébrés détecte la présence du Peptidoglycane bactérien (PGN) (Lee et al., 2020) (figure 3). Cette molécule qui constitue une partie importante de la paroi bactérienne, est qui est la cible de nombreux antibiotiques, est reconnue comme molécule du non-soi par des récepteurs de la famille des PGRP (Protéines Réceptrices du Peptidoglycane) exprimés à la surface des cellules immunitaires (Royet et al., 2011). La détection de la présence du PGN bactérien par ces récepteurs déclenche la production par les cellules immunitaire des peptides antimicrobiens, permettant l’éradication de l’infection.
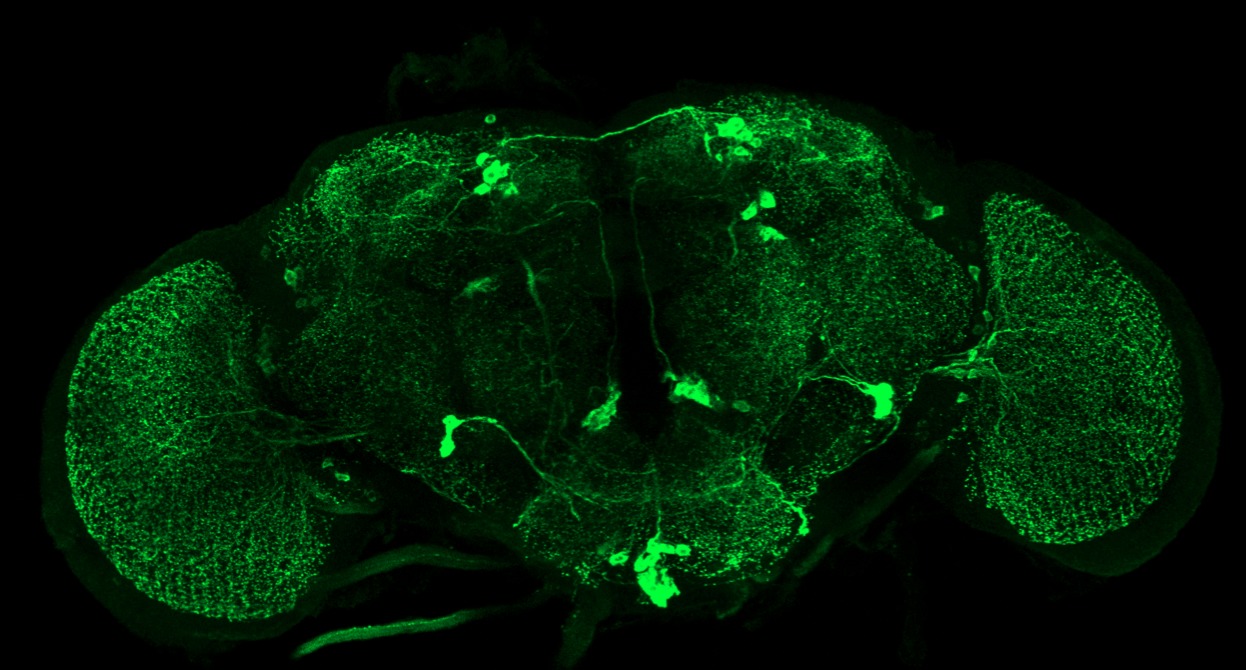
Quand l’infection bactérienne affecte le comportement
Lors des expériences menées dans notre laboratoire, nous avons constaté que les mouches infectées se comportaient différemment des mouches non-infectées. Elles semblaient moins actives et les femelles pondaient moins d’œufs (Kurz et al., 2017) (figure 4 ci-dessous). Se posait alors la question de savoir si ces modifications étaient dues à des effets secondaires de l’infection ou bien à une action directe de certains composés bactériens sur les neurones. Un des suspects était le PGN dont nous avons vu qu’il activait les cellules immunitaires. Nos expériences montrent que l’injection de PGN purifié, et donc dépourvu d’autres composés bactéries, mime les effets des bactéries. Les drosophiles auxquelles on injecte du PGN pondent moins d’œufs que les témoins. Par la suite, nous avons montré que les protéines nécessaires à l’activation de la réponse immunitaire suite à la détection du PGN, étaient aussi exprimées sur certains neurones.
D’autres expériences, que seule l’extraordinaire connaissance de la génétique de la drosophile rend possible, nous ont permis de démontrer que le PGN bactérien est capable de gagner le cerveau de ces insectes. En modifiant l’activité de deux neurones seulement sur les 100.000 que contient le cerveau, il provoque une réduction de la ponte des femelles infectées (Masuzzo et al., 2019). Ce travail montre que, lors d’une infection, la détection du peptidoglycane bactérien par les cellules de la drosophile a deux effets. Lorsqu’il est reconnu par les cellules immunitaires, il déclenche la production de molécules qui détruisent les bactéries : c’est la réponse immunitaire « classique ». Ce même peptidoglycane peut être détecté par quelques neurones du cerveau et bloquer alors la ponte des femelles. Il est probable que l’arrêt de la production d’œufs, processus consommateur d’énergie, soit un moyen pour les femelles infectées de concentrer leurs ressources sur la lutte contre les agents infectieux : c’est un cas d’immunité comportementale (figures 3 et 4).
De nombreuses études récentes mettent à jour d’autres mécanismes par lesquels les bactéries ou d’autres microorganismes agissent directement sur le système nerveux de leurs hôtes, chez les invertébrés mais aussi chez les mammifères. Nous ne sommes qu’au début de nos surprises dans ce domaine !
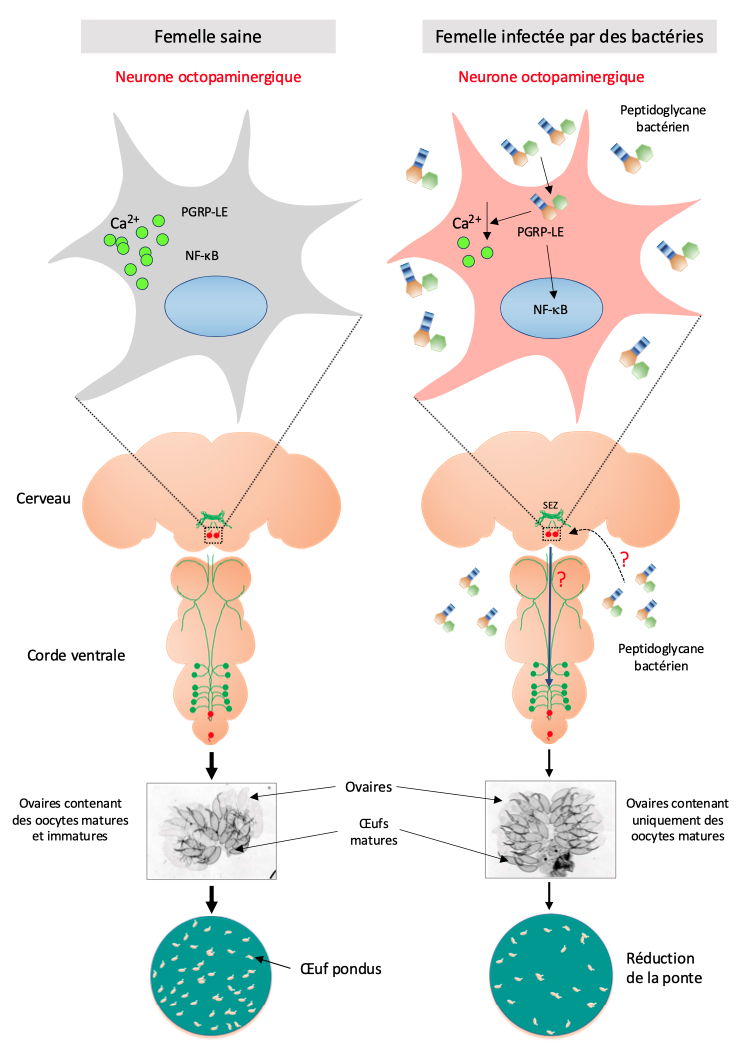
A droite : Femelles infectées par les bactéries. Quand elles se divisent, ces bactéries relarguent du peptidoglycane dans l’hémolymphe de la mouche. Par des mécanismes inconnus, ce peptidoglycane franchit la barrière hémato-encéphalique et arrive au cerveau. Il interagit avec un neurone octopaminergique du cerveau grâce à la protéine PGRP-LE. Cela a pour conséquence d’inhiber ce neurone. Cette baisse d’activité se mesure par le taux de calcium qui est plus faible dans le même neurone de la mouche infectée que dans celui de la mouche saine. Par des mécanismes incompris, le neurone ainsi inhibé, va dialoguer (flèche bleue) avec les neurones de la corde ventrale qui contrôlent la ponte. Le neurone cérébral agirait donc comme un interrupteur qui bloque de la ponte. La femelle retient ses œufs et les ovaires sont remplis d’oeufs matures prêts à être pondus dès le peptidoglycane et donc l’infection bactérienne auront disparus (Source : J. Royet)
Julien Royet
Après une thèse à Lyon, sur l’hématopoïèse murine, j’ai étudié le rôle des protéines morphogènes dans la formation des disques imaginaux de la drosophile lors de deux stages postdoctoraux à l’université de Pennsylvanie à Philadelphie puis au Laboratoire européen de biologie moléculaire (EMBL)à Heidelberg. J’ai découvert l’immunité des insectes dans l’Institut de Jules Hoffmann à Strasbourg avant de continuer mes recherches plus au sud. Apiculteur amateur ! |
Bibliographie
- de Roode, J.C. & Lefevre, T. (2012) : Behavioral Immunity in Insects. Insects 3 (3), 789-820 (lien)
- Lefevre, T. et al. (2012) : Defence strategies against a parasitoid wasp in Drosophila : fight or flight? Biol Lett 8 (2), 230-3 (lien)
- Storelli, G. et al. (2011) : Lactobacillus plantarum promotes Drosophila systemic growth by modulating hormonal signals through TOR-dependent nutrient sensing. Cell Metab 14 (3), 403-14 (lien)
- Shin, S.C. et al. (2011) : Drosophila microbiome modulates host developmental and metabolic homeostasis via insulin signaling. Science 334 (6056), 670-4 (lien)
- Lafferty, K.D. & Shaw, J.C. (2013) : Comparing mechanisms of host manipulation across host and parasite taxa. J Exp Biol 216 (Pt 1), 56-66 (lien)
- Liu, W. et al. (2017) : Enterococci Mediate the Oviposition Preference of Drosophila melanogaster through Sucrose Catabolism. Sci Rep 7 (1), 13420 (lien)
- Elya, C. et al. (2018) : Robust manipulation of the behavior of Drosophila melanogaster by a fungal pathogen in the laboratory. Elife 7 (lien)
- Masuzzo, A. et al. (2020) : How Bacteria Impact Host Nervous System and Behaviors : Lessons from Flies and Worms. Trends Neurosci 43 (12), 998-1010 (lien)
- Lee, J.H. et al. (2020) : Drosophila as a model system for deciphering the ‘host physiology-nutrition-microbiome’ axis. Curr Opin Insect Sci 41, 112-119 (lien)
- Royet, J. et al. (2011) : Peptidoglycan recognition proteins: modulators of the microbiome and inflammation. Nat Rev Immunol 11 (12), 837-51 (lien)
- Kurz, C.L. et al. (2017) : Peptidoglycan sensing by octopaminergic neurons modulates Drosophila oviposition. Elife 6 (lien)
- Masuzzo, A. et al. (2019) : Peptidoglycan-dependent NF-kappaB activation in a small subset of brain octopaminergic neurons controls female oviposition. Elife 8 (lien)

 Professeur de biologie cellulaire et de biologie du développement à Aix Marseille Université sur le campus de Luminy, mon laboratoire s’intéresse aux interactions hôtes-bactéries dans le modèle de la drosophile
Professeur de biologie cellulaire et de biologie du développement à Aix Marseille Université sur le campus de Luminy, mon laboratoire s’intéresse aux interactions hôtes-bactéries dans le modèle de la drosophile