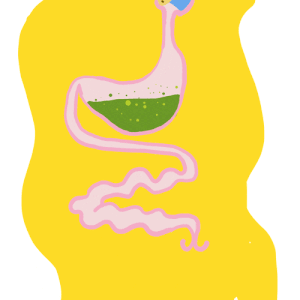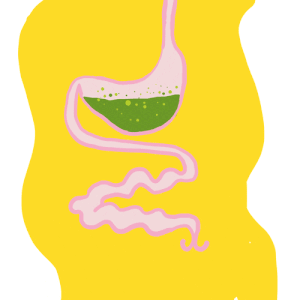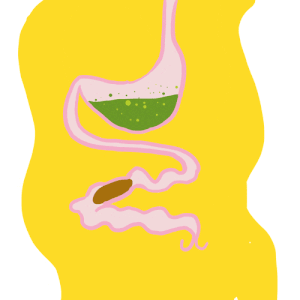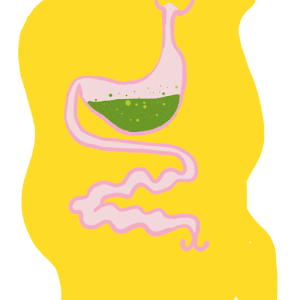Par Benoît GILLES
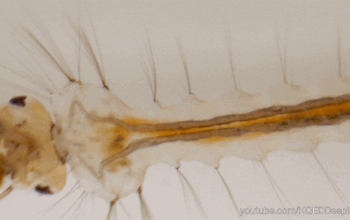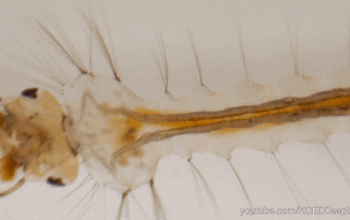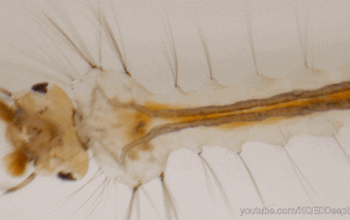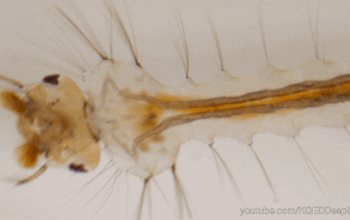
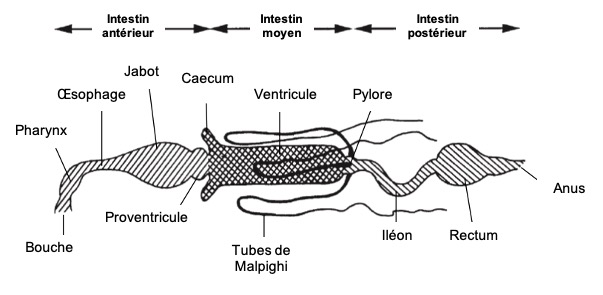
Le tube digestif des insectes est subdivisé en trois parties (figure 1) :
- Intestin antérieur (stomodeum) d’origine ectodermique
- Intestin moyen (mesenteron) d’origine endodermique
- Intestin postérieur (proctodeum) également d’origine ectodermique
Contrairement au tube digestif des vertébrés couvert d’une paroi ayant de nombreuses couches (muqueuse, sous-muqueuse, musculeuse et tunique externe), celui des insectes est constitué d’une couche unique de cellules épithéliales que délimite une membrane basale et des muscles striés.
Il forme un conduit linéaire continu de la bouche à l’anus. Des régionalisations et des zones de spécialisation sont présentes : diverticules au niveau de l’intestin moyen, caecum au niveau de l’intestin moyen, tubes de Malpighi à la jonction entre les intestins moyen et postérieur.
Chez les insectes se nourrissant de matières peu solides, voire de fluides, comme les Hémiptères (suceurs de sèves), les larves de Neuroptères (fourmilions par exemple) qui avalent une proie liquéfiée par digestion externe (lien) ou encore les larves d’Hyménoptères sociaux dont les adultes prémâchent la nourriture, un rétrécissement sépare l’intestin médian à l’intestin postérieur.
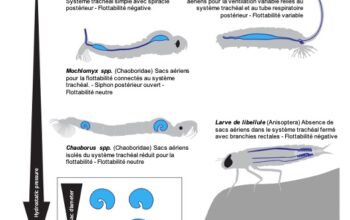
Diversité anatomique des tubes digestifs chez les insectes : figure 11 en bas de page.
Origine embryonnaire
D’origine ectodermique, les parois de l’intestin antérieur et postérieur sont couvertes par la cuticule qui, sécrétée par des cellules épidermiques, constitue la continuité avec l’exosquelette de l’insecte. Ces parois sont évacuées puis renouvelées avec l’ensemble de l’exosquelette lors de chaque mue.
L’intestin moyen n’est quant à lui pas recouvert de cuticule, mais de nombreux insectes sécrètent toutefois une membrane uni-couche non-cellulaire (enveloppe péritrophique) dont le rôle est d’isoler les cellules épithéliales de la nourriture.
Intestin antérieur
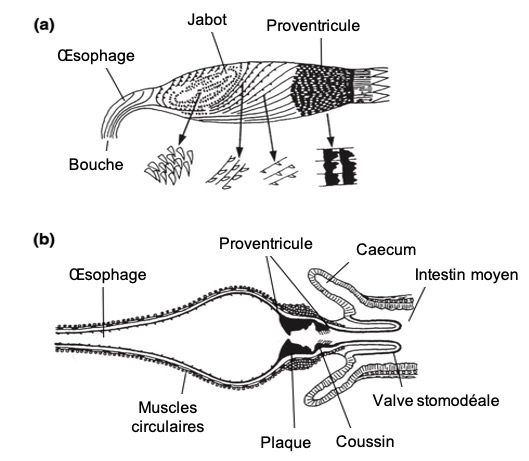
Les cellules de l’intestin antérieur sont généralement aplaties et indifférenciées du fait qu’elles n’interviennent ni dans l’absorption des nutriments ni dans la sécrétion d’enzymes. La membrane cuticulaire est en générale peu sclérifiée mais uniquement constituée d’une endocuticule et d’une épicuticule (lien). Chez de nombreux insectes, la surface de l’intestin antérieur est parfois recouverte d’épines ou de dents sclérifiées. De forme et de disposition variables selon les espèces, ces excroissances pointent vers l’arrière afin de faciliter le transit de la nourriture (figure 2).
un appareil de broyage (d’après Snodgrass, 1935) (Source : Insect – Structure and function – Chapman Ed5 – modifié par B. Gilles)
L’intestin antérieur est subdivisé en quatre parties : pharynx, œsophage, jabot, proventricule.
- Le pharynx intervient dans l’ingestion de la nourriture une fois celle-ci amenée par la bouche : il est constitué d’une musculature développée permettant la progression de celle-ci vers l’œsophage
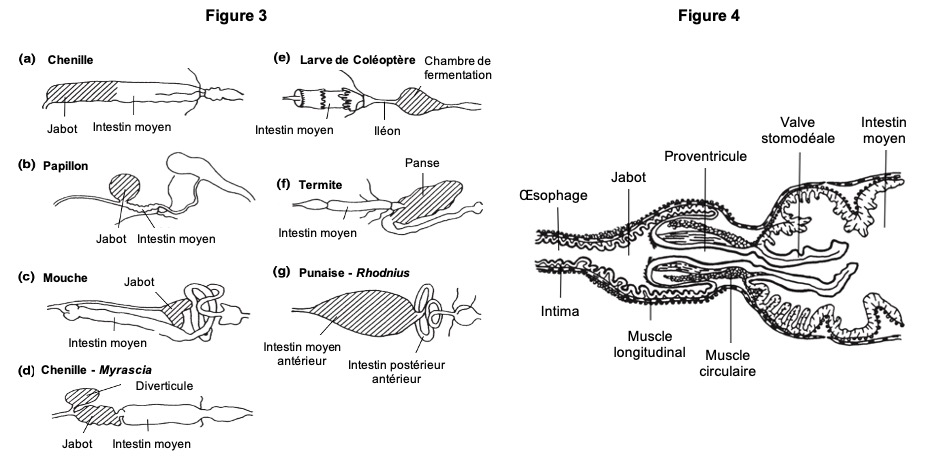
- L’œsophage relie le pharynx au jabot. Souvent mal caractérisé chez les insectes hémimétaboles (métamorphose incomplète – lien), mais il forme un long tube élancé traversant le thorax et les muscles du vol chez les insectes holométaboles (métamorphose complète – lien). Les espèces se nourrissant de plantes résineuses possèdent souvent une adaptation singulière de l’œsophage : des diverticules simples ou appariées y jouent un rôle dans le stockage de la résine (exemple : chenilles du genre Myrascia qui se nourrissent de Myrtacées (figure 3) ou larves de tenthrèdes du genre Neodiprion qui se nourrissent de pins et dont les diverticules sont dotés de puissants muscles circulaires leur permettant d’éjecter le contenu du jabot en réponse aux attaques de prédateurs)
- Le jabot est un organe de stockage, extensible chez la plupart des insectes (figure 3). Chez les Lépidoptères et les Diptères, il forme un diverticule latéral de l’œsophage. Plissées longitudinalement et transversalement, ses parois se distendent au fur-et-à-mesure que le jabot se remplit, d’où une importante augmentation de son volume. Cas particulier, chez les blattes Periplaneta, le jabot, bien que vide, garde un volume constant en se remplissant d’air. La capacité du jabot à contenir du liquide réside dans l’imperméabilité de la muqueuse cuticulaire aux molécules hydrophiles (molécules ayant une affinité avec l’eau vs molécules hydrophobes)
- Le proventricule présente une grande diversité de forme. Il s’ouvre par une simple valve à l’extrémité antérieure de l’intestin moyen, pénétrant parfois sur une courte distance dans la lumière de ce segment. Chez les criquets (Acrididae – Orthoptères), le proventricule forme une constriction limitant le passage des aliments solides vers l’intestin moyen tout en laissant diffuser les liquides dans les deux sens. Les fourmis possèdent un proventricule spécialisé séparant la nourriture partiellement digérée de la nourriture stockée dans le jabot. Ce mécanisme intervient lors de la trophallaxie (échange de nourriture entre deux individus par régurgitation). Le proventricule est également spécialisé chez les abeilles mellifères (qui fabriquent du miel) (figure 4) ce qui leur permet de retenir le nectar dans le jabot tout en laissant passer les grains de pollen vers l’intestin moyen. Chez les Orthoptères, les blattes (Blattodea) et certains Coléoptères, les proventricules sont constitués de plaques cuticulaires ou de dents intervenant dans le broyage d’aliments solides (figure 2).
Intestin moyen
La partie tubulaire de l’intestin moyen (également appelée ventricule) présente de nombreuses différenciations régionales marquées à la fois au niveau anatomique (Hétéroptères par exemple) et cellulaire (Diptères par exemple). Chez une multitude d’insectes, l’intestin moyen comporte des caecums dans la partie antérieure (figure 1 ci-dessus). Le nombre de caeca varie selon les taxons : 2 chez les grillons (Gryllidae) et certaines larves de Diptères, 6 chez les criquets (Acrididae), 8 chez les blattes (Blattodea) et les larves de Culicidae (moustiques – Diptères).
Les cellules de l’intestin moyen (entérocytes) sont impliquées dans la production et la sécrétion d’enzymes digestives et dans l’absorption des nutriments. La majorité d’entre elles, rectangulaires, forment des « colonnes » dont la membrane luminale (en contact avec la lumière de l’intestin) porte des microvillosités augmentant ainsi la surface d’échange parfois d’un facteur 100 (figure 3.5).
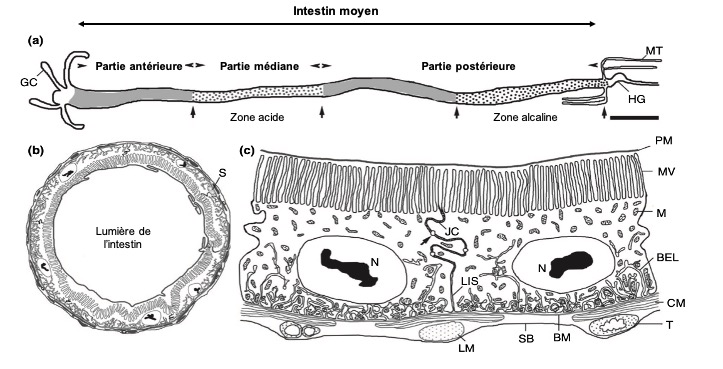
Les autres types de cellules prédominants dans l’épithélium de l’intestin moyen sont les cellules dites entéroendocrines sécrétant des hormones de régulation et les cellules souches intestinales à l’origine des cellules différenciées de ce segment (figure 6). Les cellules souches forment souvent des amas appelés « nidus ». Chez certains Coléoptères, les nidus sont limités aux cryptes des cellules souches (cellules invaginées formant des cryptes) sous forme de petites papilles (figure 6).
L’intestin moyen des larves de Lépidoptères possède d’autres types de cellules appelées « cellules en coupe » dont la membrane luminale, présentant des microvillosités, est invaginée pour créer une cavité en forme de ballon (figure 7). Ces cellules assurent l’alcalisation de ce segment (pH basique – ph<7). Une large cavité médiane est présente chez les éphémères (Éphéméroptères), les Plécoptères et les Trichoptères sans que sa fonction soit connue.
Chez tous les insectes, les cellules souches des larves prolifèrent et se différencient en entérocytes et en cellules entéroendocrines durant la métamorphose pour former l’intestin moyen de l’adulte. Les cellules souches continueront à jouer ce rôle durant toute la vie de l’insecte.
L’épithélium de l’intestin moyen de l’adulte a un temps de renouvellement de 1 à 2 semaines, les anciennes cellules étant expulsées dans la lumière intestinale. Ce phénomène est favorisé par la présence de bactéries symbiotes stimulant la production d’oxygène par les entérocytes, et augmentant la prolifération et la différenciation des cellules souches.
La couche épithéliale larvaire est cependant entièrement remplacée lors de la métamorphose par un épithélium nymphal (adulte) qui persiste tout au long de la vie adulte de l’insecte.
Chez les larves de drosophile, (Drosophila melanogaster – Diptères) la croissance de l’intestin moyen résulte principalement de l’augmentation de la taille des cellules le constituant.
Chez les larves de Lépidoptères, un pic de division de cellules souches a lieu avant chaque mue et les cellules nouvellement différenciées s’intercalent entre les cellules de l’épithélium préexistant. Durant la métamorphose, l’épithélium de l’intestin moyen des chenilles subit une apoptose (mort cellulaire programmée – autodestruction) et une autophagie (recyclage des éléments cellulaires) puis les déchets métaboliques sont rejetés après l’émergence du papillon adulte.

Figure 7 : (a) Cellule à gobelet (d’après Cioffi, 1979) (Source : Insect – Structure and function – Chapman Ed5 – modifié par B. Gilles)
Enveloppe péritrophique
L’intestin moyen de la plupart des insectes est séparé de la lumière par une structure non cellulaire appelée enveloppe péritrophique (membrane péritrophique ou matrice péritrophique). La composition et le mode de formation de cette enveloppe varient selon les insectes, mais elle comprend généralement un gel de protéoglycane scouvrant une structure rigide de microfibres de chitine (un des constituants de la cuticule) (figure 8 ci-dessous).
L’enveloppe péritrophique est dite de type I si elle est produite sur toute la longueur de l’intestin moyen, ou de type II si elle n’est produite que dans la partie antérieure de l’intestin moyen. De nombreuses variations existent au sein de chacun de ces deux types.
Le type I se rencontre chez les Coléoptères, les Blattodea, les Éphéméroptères, les Hyménoptères, les Odonates, les Orthoptères, les Phasmides, les larves de Lépidoptères ou encore les Diptères adultes.
Chez un criquet qui se nourrit activement, une nouvelle enveloppe est produite toutes les 15 minutes de sorte que les enveloppes successives se superposent. Les couches les plus anciennes sont éliminées avec la nourriture au fur-et-à-mesure que de nouvelles sont produites. La résistance mécanique de l’enveloppe péritrophique varie en fonction des espèces. Par exemple, les criquets (Acrididae) granivores du genre Locusta synthétisent une enveloppe fine et délicate tandis que l’enveloppe des espèces polyphages comme celles du genre Schistocerca, est plus épaisse et dure.
Type II : l’enveloppe péritrophique de type II est caractéristique des Dermaptères (perce-oreilles – lien), des Isoptères (termites – lien), de certains Lépidoptères et des larves de Diptères. Chez les larves de moustiques Aedes, les 8 à 10 anneaux de cellules les plus antérieurs de l’épithélium de l’intestin moyen (seulement 300 à 400 cellules) produisent toute l’enveloppe péritrophique constituée d’une seule couche de 0,7mm d’épaisseur. Chez Forficula (Dermaptères), l’enveloppe est constituée de plusieurs couches.
L’enveloppe péritrophique s’apparente à un tamis moléculaire dans lequel les pores sont des canaux aqueux traversant le gel de protéoglycane. La microscopie électronique permet de déterminer les dimensions de ces spores et de constater leur perméabilité à des particules de 21 à 36nm, telles des ions inorganiques, de petites molécules organiques (sucres, acides aminés, etc.), de peptides, voire de petites protéines. Cette enveloppe constitue en revanche une barrière efficace au passage des lipides, des polysaccharides (polymères de glucides) et d’autres grosses molécules.
Elle protège également la paroi intestinale des dommages causés par les matières ingérées comme des particules alimentaires abrasives, des agents pathogènes (résistance de jeunes larves d’abeille âgées de 3 jours à la bactérie Paenibacillus en partie retenue par la membre péritrophique) ou encore de certaines toxines (tanins de plantes par exemple). Cependant, bien que certaines molécules de tanins soient plus petites que les pores, le mécanisme permettant à la membrane de les retenir n’est pas encore élucidé. Chez Locusta, la membrane épitrophique n’est pas perméable à l’acide tannique. Lors de l’ingestion de trop d’aliments contenant cette substance, les insectes risquent des lésions épithéliales de l’intestin moyen pouvant entrainer leur mort.
Enfin, l’enveloppe joue un rôle dans la compartimentation des activités enzymatiques et l’entretien d’un écoulement à contre-courant de fluides augmentant l’efficacité de leur absorption.
Le rôle de l’enveloppe péritrophique dans la protection mécanique est démontré lors d’études sur des larves mutantes de Bombyx mori incapables de la produire.
L’enveloppe péritrophique est absente chez certains insectes comme les moustiques adultes, n’apparaissant qu’à la suite d’un repas chez les femelles, les papillons se nourrissant de nectar, et les Hémiptères et les Thysanoptères (trips) où une couche de lipoprotéines (membrane périmicrovillaire) la remplace.

Intestin postérieur
L’intestin postérieur est généralement différencié en trois régions : pylore, iléon et rectum (figure 1 ci-dessus).
Comme pour l’intestin antérieur, il est recouvert d’une couche de cuticule, toutefois plus fine et plus perméable que celle de l’intestin antérieur.
Le pylore constitue la zone où se mélangent les résidus alimentaires de l’intestin moyen et les sécrétions des tubules de Malpighi qui y débouchent. Chez de nombreux insectes, il est délimité par un muscle circulaire et agit donc comme un sphincter contrôlant le passage de la nourriture de l’intestin moyen vers l’intestin postérieur et prévenant le reflux du contenu de l’intestin postérieur vers l’intestin moyen.
L’iléon est un tube étroit situé entre le pylore et le rectum. La partie distale de l’iléon pouvant parfois être différente, cette partie est alors appelée côlon. L’iléon peut également être élargi dans sa partie postérieure pour abriter des microorganismes symbiotes formant la « panse » chez les termites et la « chambre de fermentation » chez certains Scarabaeidés (bousiers par exemple) (figure 3 ci-dessus). La cuticule tapissant ces chambres forme des épines allongées ou des lobes bulbeux servant probablement à la fixation des microorganismes.
Le rectum consiste en un sac élargi protégé par un épithélium mince à l’exception de certaines régions, plus épaisses, comme les coussinets rectaux composés des cellules épithéliales en forme de colonne et où a lieu l’absorption de l’eau.
Le rectum est également un site d’échanges des gaz respiratoires chez certains insectes aquatiques comme les larves d’Odonates chez lesquelles la partie postérieure du rectum forme une chambre branchiale constituée de filaments ramifiés (figure 9).

Musculature du tube digestif
Les muscles du tube digestif se divisent en deux catégories : les muscles viscéraux extrinsèques qui sont attachés à la paroi corporelle et sont insérés dans l’intestin, et les muscles viscéraux intrinsèques qui ne sont associés qu’à l’intestin.
Les muscles viscéraux intrinsèques comprennent des muscles striés circulaires et longitudinaux s’étendant le long du tube digestif. Ils sont bien développés autour du pharynx et du proventricule, a contrario, moins développés le long de l’intestin moyen.
Les muscles viscéraux extrinsèques ressemblent quant à eux aux muscles squelettiques. Localisés dans l’intestin antérieur et postérieur, ils interviennent dans la dilatation de l’intestin. Dans la partie antérieure, ils jouent un rôle de pompe aspirant les fluides vers l’œsophage. Dans l’intestin postérieur, ils refoulent l’eau vers les chambres branchiales des larves de libellules par exemple. (figure 8).
Passage de l’aliment à travers le tube digestif
L’aliment est déplacé à l’aide des muscles de la pompe pharyngée puis véhiculé le long de l’intestin par péristaltisme (ensemble des contractions musculaires permettant la progression d’un contenu à l’intérieur d’un organe creux).
Contrôlés à partir du système nerveux antérieur, ces mouvements sont modulés par diverses neurohormones. Par exemple, lorsqu’un criquet Locusta (Acrididés) se nourrit après une période de jeûne de plusieurs heures, la nourriture solide reste dans l’intestin antérieur jusqu’à ce que celui-ci soit rempli et distendu. Le bol alimentaire débute alors son déplacement vers l’arrière. Chez les femelles de mouches hématophages et de celles se nourrissant de nectar, la destination de l’aliment est déterminée par sa composition chimique détectée par les récepteurs des pièces buccales : la stimulation avec des sucres à des concentrations élevées dirige le repas vers le jabot (figure 3) tandis qu’une stimulation avec des protéines entraîne le repas vers l’intestin moyen.
Dans l’intestin moyen de la plupart des insectes, le déplacement de la nourriture est facilité par l’enveloppe péritrophique. Les insectes hématophages comme les punaise Rhodnius et Cimex, les moustiques ou les taons (Tabanidae) qui prennent des repas peu fréquents stockent la nourriture dans l’intestin moyen antérieur (figure 3), l’eau est absorbée directement.
Les mouvements de l’intestin postérieur sont importants dans l’élimination du matériel non digéré. Chez le criquet Schistocerca (Acrididae), l’iléon forme généralement un coude en « S » provoquant le déchirement de la membrane péritrophique qui, mélangée avec le bol alimentaire, forme ainsi un culot fécal. Les contractions de la partie distale de l’iléon et du rectum forcent ce culot à sortir par l’anus. Chez les sauterelles, les excréments sont enfermés dans l’enveloppe péritrophique alors que chez les chenilles, l’enveloppe est déchirée dans l’intestin postérieur.
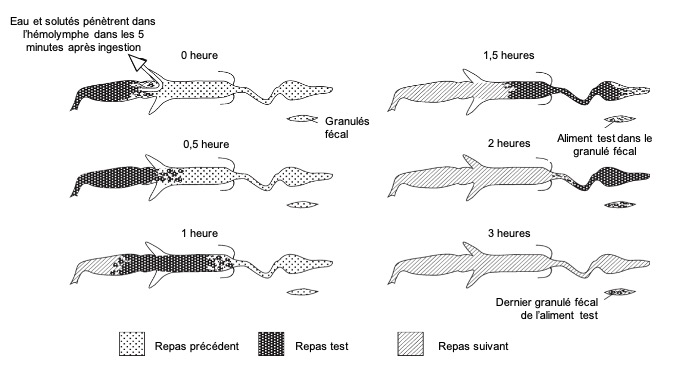
Le temps nécessaire pour que la nourriture traverse l’intestin est variable. Chez une sauterelle avec un accès continu à la nourriture, les liquides atteignent l’intestin moyen et sont absorbés dans les 5 minutes suivant le début du repas, les particules solides mettront 15 minutes ou plus. La nourriture quitte l’intestin avant 90 minutes environ, repoussée par le repas suivant (figure 10). En l’absence de second repas, l’intestin antérieur est complétement vide 5 heures après l’ingestion, et l’intestin moyen après 8 heures environ.
Chez la blatte Periplaneta (Blattodea), les aliments solides traversent l’intestin en 20 heures environ, et, en cas de jeûne, de l’aliment peut y être retrouvé après plusieurs jours. Chez les termites qui se nourrissent de bois et de matières végétales, des fragments de nourriture sont conservés dans l’intestin postérieur durant de longues périodes afin que les microorganismes symbiotiques aient le temps de dégrader la cellulose.
Diversité anatomique des tubes digestifs chez les insectes

Bibliographie
- The Insects: Structure and Function
(R.F. Chapman & Stephen J. Simpson – Edition : Cambridge University Press – 959 pages – 5ème édition : 12 novembre 2012)
- Engel P. & Moran N. (2013) : The gut microbiota of insects – Diversity in structure and function. FEMS Microbioloy Reviews, 37(5), 699-735 (lien)
Recommandation d’ouvrages sur cette thématique
- The Insects : Structure & Function (5th edition, 2013) – Edition : S.J. Simpson & A.E. Douglas – Cambridge University Press
- Evolution of the Insects (David Grimaldi & Michael S. Engel – Edition : Cambridge University Press – 772 pages – 16 mai 2005)
- The Insects: An Outline of Entomology (P.J. Gullan & P.S. Cranston – Edition : Wiley-Blackwell – 624 pages – 5ème édition : 6 août 2014)
- The Insects: Structure and Function (R.F. Chapman & Stephen J. Simpson – Edition : Cambridge University Press – 959 pages – 5ème édition : 12 novembre 2012)
- Encyclopedia of Insects (Vincent H. Resh & Ring T. Cardé – Edition : Academic Press – 1024 pages – 2ème édition : 22 juillet 2009)