Par Franck Canorel
Si la coexistence de l’Homme avec des arthropodes hématophages est ancienne et bien documentée en paléopathologie, le lien de causalité entre insecte et maladie est relativement récent dans l’histoire de la médecine. De façon synthétique, nous nous proposons de revenir sur l’évolution des idées qui, couplées avec des innovations techniques, a donné naissance à une discipline méconnue : l’entomologie médicale. Nous aborderons ensuite (dans ses grandes lignes) la lutte anti-vectorielle. Enfin, un dernier paragraphe sera consacré à la démarche holistique One Health.
Des fléaux aux vecteurs
Dans l’Ancien testament, les fléaux qui s’abattent sur l’Egypte sont appelés des plaies, terme polysémique qui englobe la notion de blessure (le mot « plaie », du mot latin plaga, donnera naissance en anglais à « plague », autrement dit la peste). La troisième (une invasion de moustiques) est suivie de l’attaque de « mouches venimeuses », autrement dit de taons, qui saignent les Egyptiens. Autant de punitions dont l’origine divine ne saurait être mise en doute.
Il faudra attendre l’Antiquité pour que les explications magico-religieuses soient concurrencées par des idées nouvelles. Ainsi le médecin et philosophe grec Hippocrate considère que les fièvres tierces ou quartes dont la symptomatologie correspond à celle du paludisme (du latin palus, marais) ont pour origine les eaux croupies. S’il s’agit d’une rupture épistémologique (on passe des croyances à l’observation et du Ciel à la Terre), les beaux esprits de cette époque restent néanmoins muets quant au rôle joué par les anophèles dans les épidémies paludéennes qui frappent le pourtour méditerranéen.
Le Moyen-âge s’inscrit dans cette continuité. Conformément à la théorie des humeurs et au dogme aristotélicien de la génération spontanée, les ectoparasites (poux, puces et autres punaises sont largement confondues), ont pour origine un excès d’humidité corporelle, voire une nourriture trop riche, qui stagne dans les viscères et entraîne la pourriture (1).
Nul ne songe par exemple à faire le rapprochement entre les puces et la peste (du latin pestis, « fléau ») qui de 1347 à 1352, fait passer de vie à trépas entre 30 et 60% de la population européenne.
Quant aux insectes qui mettent à mal les récoltes, ils sont excommuniés (avec des résultats, disons, discutables) (2).
Méprisables et sources de nuisance, ces animalcules ne feront l’objet d’aucune attention scientifique proprement dite avant la fin du XVIe siècle. Du reste, les observer suppose de disposer des outils adéquats. Or, sans microscope, il n’est pas possible de décrire avec précision leur anatomie, notamment leurs pièces buccales. Si chacun sait que les moustiques se gorgent de sang, on ignore donc que leurs repas s’accompagnent d’une injection de salive.
Au XVIIe siècle, le paludisme sévit partout en Europe : bas peuple comme gouvernants sont touchés (Richelieu en 1628, Louis XIV en 1658, etc.).
Dépourvue de signe pathognomonique, la maladie échappe à une classification stricte par les hommes de l’Art. Elle est ainsi appelée mal’aria en Italie tandis que de l’autre côté des Alpes, on parle tour à tour de fièvres intermittentes, de fièvre palustre, d’impaludisme et enfin, à partir de 1881, de paludisme. Comme l’écrit Sabine Barles : « Cette terminologie n’est pas neutre : la malaria renvoie à l’air, le paludisme au sol. » (3)
A l’aube du XXe siècle, on continue de lui payer un lourd tribut. C’est une fatalité, un mal qu’on ne peut conjurer.

Pourtant – mais l’Histoire est une grande dame facétieuse – un jeune chercheur autrichien basé à Strasbourg, Othmar Zeidler (Vienne 1850 – Mauer 1911), parvient en 1874 à synthétiser une molécule appeler à faire date : le dichlorodiphényltrichloroéthane ou DDT. Las, il n’en voit pas l’utilité, et ses travaux passent inaperçus.
Trois ans plus tard, Patrick Manson (Old Meldrum 1844 – Londres 1922), un médecin anglais basé près de Canton (Chine), émet l’hypothèse que la transmission à l’Homme d’un nématode, la filaire de Bancroft (Wuchereria bancrofti), est due aux moustiques (figure 1).
Au moment où l’Europe colonise l’Afrique pour en exploiter les richesses (la conférence de Berlin actant le partage du continent se tient du 15 novembre 1884 au 26 février 1885), la lutte contre les agents infectieux est grosse d’enjeux économiques.
Manson rentre en Europe. Malgré ses intuitions géniales, il est dans l’erreur concernant l’étiologie du paludisme. Pour lui, les individus deviennent malades en ingérant de l’eau contaminée par les moustiques.
Un confrère décrit comme impétueux, Ronald Ross (Almora 1857 – Londres 1932), vient à sa rencontre. Il accorde peu de crédit à son hypothèse. Et il a raison !
Il établit en effet sans discussion possible que le parasite Plasmodium falciparum est stocké dans les glandes salivaires du moustique et libéré lors de la piqûre de l’hôte, signant ainsi le 20 août 1897 l’acte de naissance de l’entomologie médicale.
S’appuyant sur les travaux de Théophile Lotz sur la contagiosité (le taux d’infection q plus tard noté R0), il publie en 1911 The Prevention of Malaria où il pose les bases d’une modélisation mathématique des épidémies paludéennes. Considérant qu’il existe un seuil de densité de moustiques en deçà duquel le paludisme ne peut pas se propager, il en déduit que si on en réduit la population, on améliorera grandement la santé publique.
Reste à trouver un moyen efficace pour atteindre cet objectif.
Mais la roue tourne. Chargé par la société suisse Geigy de mettre au point un produit capable d’éradiquer les mites, le chimiste Paul Hermann Müller (Olten 1899 – Bâle 1965), met en évidence en 1939 les propriétés insecticides de la molécule découverte par Zeidle. Bientôt les brevets ad hoc sont déposés et l’utilisation du DDT se généralise (figure 2). Erik Orsenna note dans Géopolitique du moustique : « (…) partout les résultats tiennent de la magie. Un exemple : le Sri-Lanka. Le nombre de malades s’approchait de trois millions, avec sept mille trois cents décès chaque année. Après avoir traité tous les sites larvaires et un grand nombre d’habitations, ce chiffre descend à…dix-sept cas et aucun décès. » (4)
Les choses auraient pu se dérouler ainsi si une biologiste américaine, Rachel Louise Carson (Springdale 1907 – Silver Spring 1964) n’était devenue la première lanceuse d’alerte en dénonçant les effets délétères (cancérigènes et reprotoxiques) du DDT dans un pamphlet demeuré célèbre : Silent Spring.
L’ouvrage aura un tel retentissement que l’usage du DDT sera progressivement interdit à partir de 1970, la Norvège et la Suède étant les deux premiers pays à s’engager dans cette voie.
Bénéfique pour l’environnement, cette avancée aura pour contrepartie un accroissement de la densité de moustiques, le paludisme redevenant endémique dans les pays tropicaux.

Des vecteurs et des maladies vectorielles
Si l’Organisation Mondiale de la Santé (OMS) a dénombré pas moins de 409 000 morts du paludisme en 2019, les moustiques du genre anophèles sont loin d’être les seuls arthropodes à poser des problèmes de santé publique. Mentionnons chez les insectes les phlébotomes (figure 3), les réduves (figure 4), les mouches (figure 5) et chez les acariens les tiques (figure 8).

Chez les premiers, ceux dotés de la compétence vectorielle, autrement dit capables de transmettre un agent infectieux d’un vertébré à un autre, appartiennent principalement à l’ordre des diptères, qu’ils soient brachycères (antennes courtes) ou nématocères (antennes longues) (5).
Certains sont solénophages (ils prélèvent leur repas de sang au niveau des capillaires) quand d’autres sont telmophages (ils lacèrent le derme et se nourrissent en créant un micro-hématome).
Tordons immédiatement le coup à une idée reçue : les insectes hématophages ne sont pas de simples seringues prélevant du sang et injectant en retour chez leur hôte un agent infectieux. Au contraire, ils constituent un milieu propice à leur multiplication, voire leur développement (c’est ce qu’on appelle l’incubation extrinsèque). Ce dernier peut d’ailleurs être très complexe comme dans le cas du cycle dit sporogonique des agents du paludisme.
Au cours du repas sanguin (appelé gorgement), l’agent infectieux pénètre dans l’organisme de l’insecte hématophage par les pièces buccales, passe par le pharynx, l’œsophage et le jabot, franchit le proventricule et la valve stomodéale avant de gagner l’intestin moyen ou mésentéron.
Il existe à ce niveau une membrane dite péritrophique que François Rodhain, ex-chef de laboratoire à l’Institut Pasteur décrit ainsi : « une membrane chitinisée qui, à l’intérieur de la lumière digestive (…) entoure le sang ingéré, qui n’entre donc pas en contact direct avec les cellules de l’épithélium intestinal. » (6)

Il faut distinguer deux types de membranes péritrophiques : celles dites de sécrétion et celles dites de délamination.
Les premières sont « secrétées par des cellules intestinales particulières du proventricule (…) et constituent un tube s’étendant, à l’intérieur de la lumière digestive, depuis le proventricule jusqu’à l’intestin postérieur ; leur formation est continue. ». La membrane péritrophique de sécrétion fournit aux agents pathogènes « la possibilité d’échapper à l’entraînement et à l’évacuation vers le rectum du contenu intestinal. On trouve par exemple (…) ce type de membrane chez les glossines, les stomoxes (figure 5), la mouche domestique et beaucoup d’autres cyclorraphes (ainsi que chez toutes les larves de diptères). »
Les autres membranes péritrophiques sont formées « immédiatement après chaque repas sanguin, à partir des cellules épithéliales elles-mêmes », constituant en quelques heures « un sac fermé entourant le sang ingéré, à l’intérieur de l’estomac (…) De telles membranes sont retrouvées chez tous les diptères nématocères adultes (et donc les culicides), chez les tabanides, et d’une façon générale, chez tous les brachycères orthorraphes. Elles sont considérées comme constituant un obstacle à l’évolution des parasites ingérés dans la mesure où beaucoup s’y trouvent emprisonnées. »
Un insecte infecté par un microorganisme ne sera pas immédiatement infectant. Le délai qui s’écoule entre l’ingestion de l’agent pathogène et la transmission à un nouvel hôte est appelé « période d’incubation extrinsèque » (PEI). Et Mohamed Gharbi, docteur vétérinaire et docteur ès sciences biologiques de l’Institut polytechnique de Toulouse de préciser : « Cette période varie en fonction d’abord de l’agent pathogène (…) et secondairement en fonction du vecteur mais aussi des conditions abiotiques, notamment la température (n’oublions pas que les vecteurs sont des êtres vivants poïkilothermes. Par exemple, elle est de 19 jours pour Leishmania infantum (agent étiologique de la leishmaniose) chez le vecteur Phlebotomus). » (7)

Signalons enfin que des modèles mathématiques, dont le plus connu est le SIR (Susceptible-Infected-Recovered) permettent de visualiser sous forme simplifiée la dynamique des épidémies.
Chez les seconds, les tiques Ixodes ricinus (Linnaeus, 1758) ne sont ni plus ni moins que les premiers agents de transmission de maladies vectorielles dans le monde. A ce titre, elles suscitent quantité de recherches, tant en Europe qu’aux Etats-Unis.
Quant aux agents pathogènes transmis par ces arthropodes, ils sont, hélas, fort nombreux. Un exemple : on a recensé pas moins d’une centaine d’arbovirus (de l’anglais « arthropod-born-virus ») dangereux pour l’Homme, appartenant principalement aux genres Alphavirus, Flavivirus et Phlebovirus. Et encore faut-il ajouter à cette liste des bactéries (borrélies, rickettsies…), des protozoaires et des vers.
De la lutte anti-vectorielle
En l’absence de vaccin, la lutte anti-vectorielle (LAV) est le seul moyen de prévention contre la plupart des agents pathogènes transmis par les arthropodes.
Elle a pour principal objectif d’éviter la transmission de cet agent aux populations humaines (ou animales) en réduisant soit la densité, soit la longévité des vecteurs (et donc leur infectiosité).
Réduire la densité de vecteurs implique de recourir à la lutte anti-larvaire (c’est à ce stade que les insectes, pour ne parler que d’eux, sont les plus vulnérables) :
- En éliminant ou en modifiant les lieux de ponte (comblement des collections d’eau, déforestation, installation d’un barrage avec une vanne…) (8)
- En procédant à l’épandage de larvicides, soit biologiques (par exemple la bactérie entomotoxique Bacillus thuringiensis israelensis H14 ou Bti), soit chimiques
- En introduisant des prédateurs dans des lieux de ponte (poissons, tortues…)
- En rendant ces derniers inaccessibles
Bien entendu, on ne saurait parler de la LAV sans aborder la question des pesticides (nous invitons les lecteurs qui souhaiteraient aller au fond des choses à consulter l’excellent – bien qu’ancien – ouvrage de Josette Fournier sur le sujet (9)).
L’abandon progressif du DDT a en effet incité les laboratoires du monde entier à mettre au point des produits de substitution.
Leurs cibles peuvent être la conduction axonale (c’est le cas des organochlorés et des pyréthrinoïdes), les récepteurs GABA, canaux des membranes neuronales activés par l’acide gamma-aminobutyrique (c’est le cas des phénylpyrazoles) ou encore la transmission synaptique par inhibition de l’acétylcholinestérase (c’est le cas des carbamates, des néonicotinoïdes et des organophosphorés).
Délicate, leur utilisation doit toujours être raisonnée : quid des problèmes de rémanence dans le milieu (eaux, sols) ? Quid de leur spectre d’activité (attention à la biodiversité) ? Quid enfin, de leur toxicité pour l’Homme ?
Outre les épandages (coûteux à mettre en œuvre et parfois prohibés), signalons à titre d’exemple qu’il est d’usage dans beaucoup de pays d’Afrique sub-saharienne d’attirer les glossines (vecteurs de la maladie du sommeil chez l’Homme et du nagana chez les animaux) avec un drap de couleur bleu roi préalablement enduit de pyréthrinoïde.
Pour clore ces quelques généralités sur les insecticides, il faut garder à l’esprit que les insectes hématophages ne sont pas totalement démunis pour y faire face : certains peuvent en effet tolérer des doses de produits toxiques qui étaient auparavant létales pour la majorité des individus de leur espèce.
Ce phénomène, désigné sous le terme générique de « résistance » peut être de quatre types :
- Résistance par modification de la cible des insecticides
- Résistance de comportement
- Résistance par excrétion
- Résistance métabolique
Cette dernière fait appel à différentes enzymes de détoxification : estérases, oxydases et glutathion sulfo-transférases.
Par ailleurs, un recours systématique au même insecticide peut entraîner une pression dite de sélection : si le produit utilisé va tuer la majorité des insectes, il sera sans effet sur ceux porteurs d’un gène leur permettant de survivre. Autrement dit, le risque est grand de favoriser la transmission à leur descendance de ce même gène (10).

Il existe cependant des stratégies de gestion de la résistance aux insecticides au nombre desquelles le maintien de zones non traitées, l’utilisation de différents insecticides de façon alternée dans l’espace (mosaïque) ou dans le temps (rotation), le recours à des insecticides peu rémanents ou à des synergistes pour bloquer les enzymes de détoxification, etc.
Outre les insecticides, il existe d’autres moyens de lutte anti-vectorielle, notamment contre les moustiques. On peut mentionner deux techniques autocides : celle de l’insecte stérile ou TIS et celle de l’insecte incompatible ou TII.
Mise au point aux Etats-Unis dans les années cinquante par deux entomologistes, Raymond C. Bushland et Edward G. Knipling, la TIS consiste à stériliser dans un laboratoire des insectes mâles par rayonnement avant de les lâcher dans la nature. Si la technique s’est avérée efficace, notamment contre un diptère myiasigène, la lucilie bouchère (Cochliomyia hominivorax, Coquerel 1858), elle n’est pas infaillible. Ainsi, au Japon, les femelles de la mouche du melon (Bactrocera cucurbitae, Coquerel 1899) (figure 6) ont appris à reconnaître les mâles stériles et s’en sont détournées. Il n’y a actuellement qu’un seul laboratoire en Europe, plus précisément à Bologne (Italie), qui maîtrise cette technique nécessitant d’importantes quantités d’insectes pour le largage par drone.
La TII repose quant à elle sur incompatibilité cytoplasmique médiée par la bactérie endosymbiotique Wolbachia (la descendance issue d’un croisement entre un mâle porteur de certaines souches de Wolbachia et une femelle non-porteuse n’est pas viable).
Autre méthode de lutte : l’utilisation d’entomophthorales, des champignons entomopathogènes. Si les Zygomycètes sont les plus nombreux, on utilise préférentiellement les Deutéromycètes.
Leur mode d’action se divise en quatre phases. D’abord l’adhésion du champignon au corps de l’insecte s’effectue via des conidies (des spores asexuées). Ensuite, il y a germination par bourgeonnement ou scission des hyphes. Vient alors le moment de la différenciation d’une spore germée qui produit un appresorium qui va ramollir la cuticule de l’hôte. Enfin, le champignon va envahir le corps de l’insecte et le tuer (11) (figure 7).
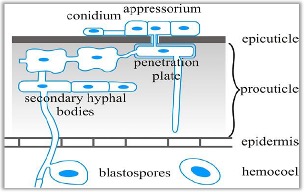
Les espèces Beauveria bassiana (à l’origine de la maladie appelée « muscardine blanche) et Verticillium lecanii, sont connues pour leur efficacité contre les aleurodes et les pucerons.
Signalons enfin que des recherches sont en cours pour évaluer les résultats obtenus par l’introduction de prédateurs contre les nuisibles. Hudson Onen du département d’entomologie de l’Uganda Virus Research Institute et d’autres chercheurs, ont ainsi fait une recension fort intéressante des différents insectes (dytiques, notonectes et odonates) utilisés pour lutter contre Anopheles gambiae, un vecteur du paludisme très redouté en Afrique (12).
Et en France ? Venu d’Asie, vecteur du chikungunya, de la dengue et du virus Zika (responsable de microcéphalie chez les nouveau-nés), le moustique tigre (Aedes albopictus, Skuze 1894) est arrivé à Menton en 2003.

En dépit de l’épidémie de chikungunya ayant frappé l’île de La Réunion en 2005-2006 (244 000 malades ; 203 morts), il faudra attendre…seize ans avant que les pouvoirs publics ne mettent en œuvre la LAV (13). De quoi laisser au moustique tigre une confortable avance pour conquérir tout le territoire…
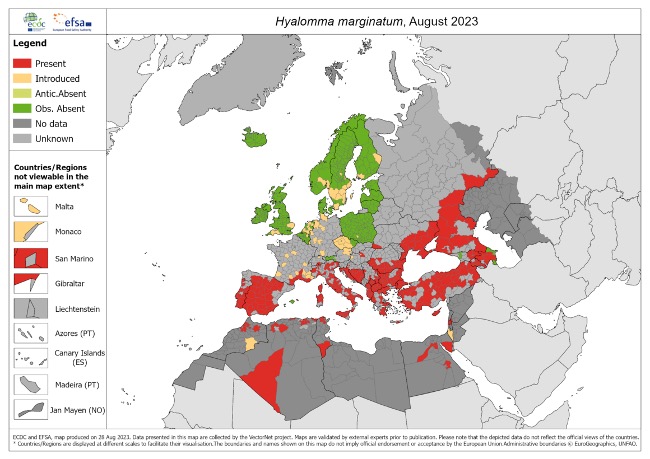
D’autres arthropodes font peu ou prou l’objet d’une surveillance. Tel est le cas du moustique Culex pipiens (Linnaeus, 1758), vecteur du virus du Nil occidental et de façon moindre de la tique Hyalomma marginatum (Koch, 1844) (figure 8), vecteur de la fièvre hémorragique de Crimée-Congo semble-t-il venue sur le continent via des oiseaux migrateurs mais dont l’expansion en France sera probablement freinée par les basses températures (trois signalements ont été portés à ma connaissance en Essonne ces deux dernières années) (figure 9).
Par ailleurs, il ne faut pas oublier que la France possède des territoires ultramarins, dont la Guyane où sévit notamment le virus oropouche.
Enfin, dans les zones du globe terrestre où l’être humain et l’animal partagent le même biotope, le risque de contracter une zoonose est accru.
One Health
En 1964, le vétérinaire et épidémiologiste américain Calvin Schwabe (Newark 1927 – Haverford 2006) publie Veterinary medicine and human health (14). Ayant observé que les Dinkas, un peuple nomade du Sud Soudan, ne sépare pas la santé animale de la santé humaine, il promeut une nouvelle approche de la santé publique.
Idée lumineuse sachant que 58% des 1 407 agents pathogènes affectant l’homme sont d’origine animale et que les échanges commerciaux et les voyages tendent à favoriser la circulation des agents pathogènes et des vecteurs d’un continent à l’autre.
En mai 1995, à l’issue de la 48e assemblée de l’Organisation Mondiale de la Santé (OMS), est adoptée la résolution WHA48.13 « Lutte contre les maladies transmissibles : maladies infectieuses nouvelles, émergentes et réémergentes ». Elle sera suivie de la publication par les Centers for Disease Control and Prevention du premier numéro du journal (en open access) Emerging Infectious Diseases.
En septembre 2004, la Wildlife Conservation Society, une organisation non gouvernementale travaillant sur la biodiversité, organise un symposium sur les zoonoses à l’Université Rockefeller (Etats-Unis).
Cet évènement aboutit à la formulation de ce qui est communément appelé les Douze principes de Manhattan, le premier portant sur « le lien essentiel entre la santé humaine, animale et sauvage et la menace que représentent les maladies pour les populations ».
S’il est prometteur, ce concept dit « One Health » (lien) n’en est aujourd’hui qu’à ses balbutiements. Reste maintenant à le traduire sur le terrain.
Auteur
Son engouement pour la photographie et la randonnée l’ont peu à peu amené à s’intéresser aux insectes, à suivre le MOOC d’entomologie médicale de l’Institut Pasteur et à obtenir un certificat dans cette discipline à l’Université d’Aix-en-Provence/Marseille. Il est aujourd’hui ingénieur d’études sanitaires à l’Agence régionale de santé Ile-de-France (lien) où il s’occupe notamment des maladies vectorielles à tiques. |
Bibliographie
- COLLARD F., SAMAMA E. : Poux, puces, punaises. La vermine de l’homme – Découverte, descriptions et traitements. Antiquité, Moyen-Age, Epoque moderne. Paris : L’Harmattan, 2015, 418 pages
- Cette pratique perdurera longtemps. Cf. BARATAY E. : L’excommunication et l’exorcisme des animaux aux XIIe-XVIIIe siècles, une négociation entre bêtes, fidèles et clergé. Revue d’histoire ecclésiastique, 2012, 107(1), pp. 223-54
- BARLES S. La ville délétère : Médecins et ingénieurs dans l’espace urbain XVIIIe-XIXe siècles. Seyssel : Champ Vallon, 1999, p. 307. Milieux
- ORSENNA E., DE SAINT-AUBIN S. Géopolitique du moustique. Petit précis de mondialisation IV. Paris : Fayard, 2017, 288 p. Documents, témoignages
- Les Triatominae ou réduves, qui appartiennent à l’ordre des hétéroptères (punaises) font aussi l’objet d’une attention particulière puisqu’elles transmettent à l’Homme un parasite, Trypanosoma cruzi, responsable d’une très grave affection : la maladie de Chagas
- RODHAIN F., PEREZ C. Précis d’entomologie médicale et vétérinaire. Notions d’épidémiologie des maladies à vecteurs. Préface de Léonard Bruce-Chwatt. Paris : Maloine s.a ; éditeur, 1985, p. 3
- GHARBI M. 101 entrées pour l’entomologie médico-vétérinaire. L’Harmattan, 2023, p. 124. Environnement
- C’est cette méthode qui a été utilisée en Italie à partir de 1928 pour supprimer les marais pontins, épisode relaté de façon romancée par Antonio Pennacchi dans Canal Mussolini.
- FOURNIER J. Chimie des pesticides. Nantes : Cultures et Techniques. Paris : Agence de coopération culturelle et technique, 1988, 351 p.
- Au Cambodge, l’utilisation sans modération et ce depuis des années du même insecticide a eu pour conséquence fâcheuse de rendre les populations de moustiques tigre totalement insensibles (échange avec Pierre-Olivier Macquart de l’Institut Pasteur)
- Au Canada est commercialisé sous la marque Aprehend® un piège contre les punaises de lit à base de Beauvaria
- Onen, H., Kaddumukasa, M.A., Kayondo, J.K. et al. A review of applications and limitations of using aquatic macroinvertebrate predators for biocontrol of the African malaria mosquito, Anopheles gambiae sensu lato. Parasites Vectors 17, 257 (2024)
- Décret n°2019-258 du 29 mars 2019 ; arrêté du 23 juillet 2019 relatif aux modalités de mise en œuvre des missions de surveillance entomologique, d’intervention autour des détections et de prospection, traitement autour des lieux fréquentés par les cas humains de maladies transmises par les moustiques vecteurs
-
SCHWABE C. Veterinary medecine and human health. Baltimore : Williams & Wilkins, 1964, 516 p.

 Diplômé de l’Ecole de santé publique de la Faculté de médecine de Nancy (
Diplômé de l’Ecole de santé publique de la Faculté de médecine de Nancy (
