Par Gérard Duvallet
Parmi les ectoparasites qui sont une nuisance pour le bétail et l’élevage en général, il y a, à côté des tiques (Acariens), plusieurs familles de Diptères (Insectes). Les stomoxes et mouches des cornes (Diptères, Muscidae) et les taons (Diptères, Tabanidae) sont certainement les plus importants (photos 1, 2 et 3), en raison des nuisances engendrées et de la possible transmission de pathogènes par ces insectes hématophages (se nourrissant de sang).

Nous verrons dans la suite de cet article des éléments sur la biologie et l’écologie des stomoxes, leur impact sur la santé animale, et les moyens disponibles pour contrôler leurs populations. Mouches des cornes et taons seront envisagés dans de prochains articles.
Stomoxes
Les stomoxes (genre Stomoxys) appartiennent à la famille des Muscidae et à la sous-famille des Stomoxyinae (Tableau 1 ci-dessous). La classification au sein du règne animal est la suivante :
- Embranchement des Arthropodes
- Classe des Insectes
- Ordre des Diptères
- Sous-ordre des Brachycères
- Famille des Muscidae
- Sous-famille des Stomoxyinae
Ce sont des insectes cosmopolites que l’on peut rencontrer aussi bien dans les climats froids et tempérés d’Europe et d’Amérique du Nord que sous les climats chauds d’Afrique, d’Asie ou d’Amérique du Sud. Ces mouches sont considérées comme des nuisances majeures dans les élevages de bovins et de chevaux, mais on les rencontre aussi dans les élevages de porcs, de volailles ou de lapins.
Le genre Stomoxys comprend 18 espèces dont 12 sont connues uniquement en région Afro-tropicale, 4 uniquement en région Orientale, une espèce (Stomoxys sitiens) est présente à la fois dans les deux régions précédentes, et l’espèce Stomoxys calcitrans (mouche des étables ou stable fly en anglais) est cosmopolite (Tableau 2). C’est cette dernière espèce qui est la plus étudiée en raison de son inféodation aux activités d’élevage. Son impact sur la filière élevage aux Etats-Unis a été évaluée à 2,2 milliards de US$ par an (Taylor et al., 2012).
Tableau 1 : Genres et nombre d’espèces connues dans la sous-famille des Stomoxyinae
| Genres de la sous famille des Stomoxyinae |
Nombres d’espèces connues |
| Rhinomusca Malloch (1932) | 2 |
| Neivamyia Pinto & Fonseca (1930) | 5 |
| Bruceomyia Malloch (1932) | 1 |
| Parastomoxys Zumpt (1973) | 1 |
| Prostomoxys Zumpt (1973) | 1 |
| Stygeromyia Austen (1907) | 2 |
| Haematobosca Bezzi (1907) | 13 |
| Haematobia Lepeletier & Serville (1828) | 6 |
| Haematostoma Malloch (1932) | 1 |
| Stomoxys Geoffroy (1762) | 18 |
Tableau 2 : Liste des espèces connues du genre Stomoxys et répartition
| Espèces | Répartition géographique |
| S. calcitrans (Linnaeus, 1758) | Cosmopolite |
| S. boueti Roubaud, 1911 | Région Afro-tropicale |
| S. inornatus Grünberg, 1906 | |
| S. luteolus Villeneuve, 1934 | |
| S. niger niger Macquart, 1851 | |
| S. niger bilineatus Grünberg, 1906 | |
| S. ocbrosoma Speiser, 1910 | |
| S. omega Newstead, 1907 | |
| S. pallidus Roubaud, 1911 | |
| S. stigma Van Emden, 1939 | |
| S. transvittatus Villeneuve, 1916 | |
| S. taeniatus Bigot, 1888 | |
| S. varipes Bezzi, 1907 | |
| S. xanthomelas Roubaud, 1937 | |
| S. sitiens Rondani, 1873 | Région Afro-tropicale et orientale |
| S. indicus Picard, 1908 | Région Orientale |
| S. pullus Austen, 1909 | |
| S. uruma Shinonaga et Kano, 1966 | |
| S. bengalensis Picard, 1908 |
Phylogénie
Une étude phylogénétique a été réalisée par N. Dsouli dans mon laboratoire en 2010 en analysant des séquences géniques de 11 des 18 espèces de Stomoxys. On considérait jusqu’à ce travail que les stomoxes étaient originaires d’Afrique, en prenant en compte le nombre d’espèces présentes sur ce continent (Tableau 2).
L’étude a montré que toutes les espèces analysées étaient sœurs de l’espèce S. indicus, qui apparaît ainsi comme la plus ancienne. Or cette espèce n’est connue que du continent asiatique. Il semble donc que les stomoxes seraient plutôt apparus en Asie et auraient migré ensuite vers l’Afrique où ils se seraient diversifiés.
N. Dsouli a aussi réalisé une étude phylogéographique de la seule espèce cosmopolite S. calcitrans en comparant des populations provenant de tous les continents à l’exception de l’Australie. Il est apparu une séparation nette entre les populations d’Asie et celles du reste du monde. On se demande si les populations d’Asie appartiennent encore à la même espèce, ou bien si l’on n’est pas devant un phénomène de spéciation par isolement géographique. Les analyses se poursuivent actuellement sur ce sujet en collaboration avec un laboratoire américain.
Morphologie
Le stomoxe adulte (S. calcitrans) mesure 5 à 7 mm de long et présente des caractéristiques morphologiques semblables à celles de la mouche domestique (Fig. X). Il se différencie par l’existence d’une trompe grêle, dirigée vers l’avant, de type piqueur-suceur (appelée proboscis) (Illustration 1).
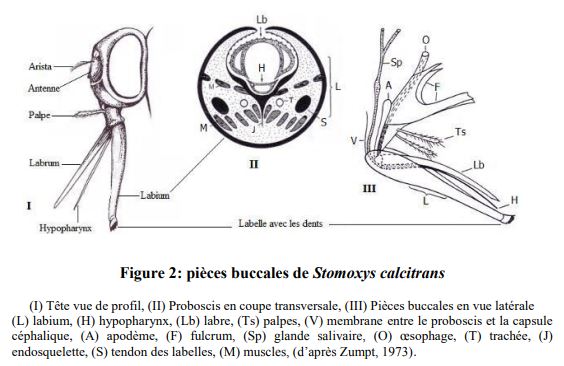
Cette mouche est de couleur gris-brun, le thorax est marqué de 4 bandes dorsales noires longitudinales, et l’abdomen, plus large que long, présente des taches noires médianes et des taches latérales arrondies. Les ailes sont translucides et la nervure longitudinale centrale montre un décrochement vers l’avant moins marqué que chez la mouche domestique (Illustration 2).

Cycle de développement
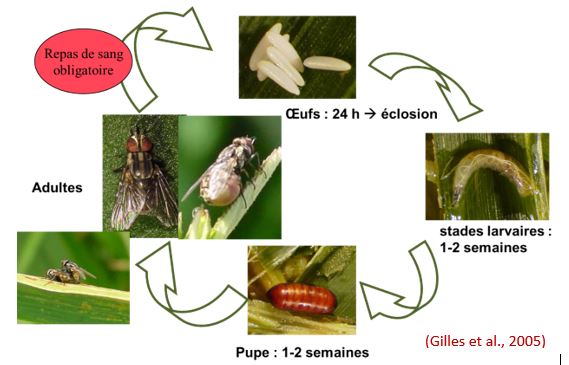
Les adultes vivent en moyenne entre 4 à 5 semaines. Ils peuvent passer l’hiver dans des sites d’élevage chauffés et maintenir ainsi une activité reproductrice tout au long de l’année.
Les femelles effectuent leur première ponte environ 9 jours après leur émergence. En conditions favorables (25°c) les œufs éclosent en 1 à 3 jours. Les larves sont des asticots apodes et presque cylindriques. Elles se nourrissent de matière organique en décomposition. Cette phase larvaire comprend 3 stades et dure entre 7 jours à 30°c et 11 jours à 25°c.
Au moment de la pupaison, la larve de stade 3 recherche des sites où la température est de 15-20°c et l’humidité relative de 70-85%. La larve s’enferme alors dans une capsule cylindrique dénommée puparium. Cette phase dure environ 7 jours à 25°c. Le cycle complet de développement s’effectue en 19 jours à 25°c, 90 jours à 14°c et 130 jours à 10,5°c (Illustration 3).
Régime alimentaire
Les stomoxes mâles et femelles sont hématophages. Ils s’attaquent principalement aux ruminants (bovins, moutons, etc.) et aux chevaux, plutôt qu’à l’homme. Ils peuvent se nourrir aussi sur oiseaux. Le sang est nécessaire pour la reproduction : développement des ovaires chez les femelles et du liquide séminal chez les mâles. Mais pour les besoins énergétiques, en particulier le vol, ces mouches se nourrissent aussi de nectar et/ou de secrétions végétales (sève).
L’un de mes étudiants gabonais (J.F. Mavoungou) a étudié l’activité saisonnière et la distribution des différentes espèces de stomoxes dans la forêt équatoriale autour de Makokou dans l’est du Gabon. Il a eu l’idée de mettre des pièges dans la canopée à 30 m de hauteur, et il a constaté qu’une espèce, très peu connue, S. xanthomelas vivait là à cette hauteur dans les arbres. L’analyse des repas de sang a montré qu’une bonne partie des repas de cette espèce étaient pris sur singes, mais que parfois cette mouche pouvait aussi piquer des humains en venant au niveau du sol.
Nous pensons qu’il y a là un réel danger, car avec l’intensification du développement dans cette région (Makokou – Gabon), les contacts avec les humains vont augmenter et cette mouche pourrait bien être le vecteur de pathogènes nouveaux entre les singes et les humains.
Activités saisonnières
Les populations de stomoxes montrent une activité saisonnière (phénologie) dépendante des températures extérieures. Avec le réchauffement climatique observé actuellement, ces mouches sont actives à l’extérieur à Toulouse de mi-février à fin novembre (Graphique 1), alors qu’elles n’apparaissaient qu’en avril-mai il y a quelques années seulement. Dès que la température extérieure dépasse 10-11°c, les mouches sont actives. On observe un pic d’abondance à la fin du printemps-début de l’été (semaines 23 à 29), une diminution du nombre pendant l’été, puis un second pic, plus important, à l’automne (semaines 45 à 49).

Nuisances
Ces mouches harcèlent les animaux pour leurs repas de sang, les empêchent de s’alimenter et provoquent ainsi une diminution du gain de poids quotidien (réduction de plus de 13% dès qu’il y a 50 mouches par bovin) ou de la production de lait (réduction de 0,7% par stomoxe par bovin).
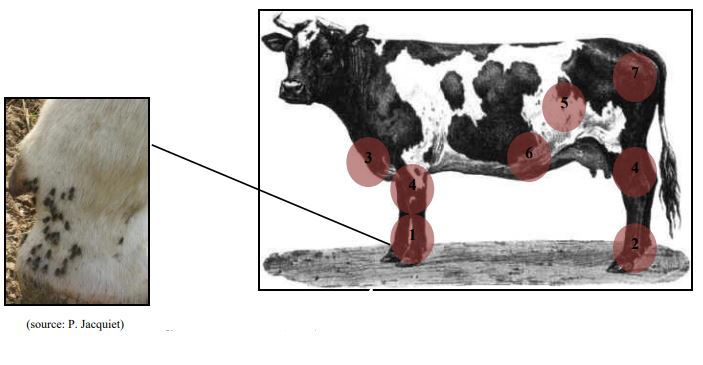
En plus de ces nuisances, les stomoxes peuvent transmettre des pathogènes d’un animal infecté à un animal sain sensible : rôle vecteur. Les stomoxes étaient connus autrefois sous le nom de mouches charbonneuses, car susceptibles de transmettre la bactérie Bacillus anthracis, agent du charbon.
En France, nos collègues de l’Ecole nationale vétérinaire de Toulouse (ENVT) ont démontré que ces mouches pouvaient aussi transmettre aux bovins le protozoaire Besnoitia besnoiti, agent de la besnoitiose (Lienard et al., 2013 ; Sharif et al., 2017). Cette pathologie qui n’était connue autrefois que des contreforts pyrénéens, s’est répandue jusque dans le nord de la France à l’occasion des mouvements d’animaux.
Les stomoxes peuvent aussi transmettre des Helminthes (vers), c’est le cas de parasites du tractus digestif des Equidés : Habronema megastoma. Cette parasitose se rencontre dans les régions méridionales, mais est peu fréquente.
En régions tropicales, ces mouches sont responsables de la transmission de bien d’autres pathogènes, par exemple : trypanosomes (protozoaires), Dermatophilus congolensis (bactéries), virus de la dermatose nodulaire contagieuse. Ce dernier virus inquiète d’ailleurs les autorités européennes. Cette dermatose nodulaire contagieuse, connue en anglais sous le nom de Lumpy Skin Disease, est aux portes de l’Europe (Photo 4).

J’ai eu la possibilité de visiter il y a quelques années, grâce à un étudiant éthiopien qui a soutenu sa thèse de doctorat à l’Ecole vétérinaire de Toulouse, plusieurs foyers de cette maladie au sud d’Addis-Abeba. On sait que les stomoxes jouent un rôle dans la transmission de ce virus, mais l’épidémiologie de cette maladie n’est pas encore complètement comprise. Or, en août 2015, cette pathologie a été constatée en Grèce pour la première fois. La Bulgarie, la Macédoine et la Serbie ont signalé les premiers foyers au printemps 2016, et fin juin 2016, le Kosovo a lui aussi annoncé un premier cas de LSD. Le virus continue depuis de se propager dans les régions touchées.
Les autorités européennes annoncent que dans la région des Balkans les foyers identifiés ont chuté de 95%, passant de 7 483 foyers en 2016 à 385 en 2017. Ces chiffres confirment que la vaccination du bétail, recommandée par l’EFSA en 2016, constitue le moyen le plus efficace pour contenir la maladie. Cette inquiétude devrait inciter aussi nos responsables à soutenir les recherches sur les méthodes de lutte contre les stomoxes.
Contrôle
Pendant longtemps la lutte contre ces mouches a été réalisée à l’aide d’insecticides. D’abord le DDT et produits voisins, jusqu’à leur interdiction, puis de nouvelles molécules à partir des années 1970, jusqu’aux pyréthrinoïdes de synthèse actuellement. Mais nos collègues de l’ENVT ont bien montré que certaines populations de stomoxes, soumises à une pression insecticide constante, sont désormais résistantes à toutes les molécules disponibles (Salem et al., 2012 ; Tainchum et al., 2018).
C’est pourquoi, dans le cadre d’un projet dénommé FlyScreen (CIRAD, ENVT, CEFE-Univ Paul-Valéry Montpellier 3, CIRDES-Burkina Faso, AtoZ-Tanzanie), financé par l’Agence Nationale de la Recherche (ANR) et coordonné par le CIRAD (Dr Marc Desquesnes), nous mettons au point de nouveaux systèmes de lutte utilisant des écrans bleus imprégnés d’insecticide (brevet déposé) et des systèmes de piégeage. On sait en effet depuis longtemps que ces mouches hématophages sont attirées par des tissus ou des plastiques de couleur bleu phtalogène (longueur d’onde autour de 460 nm) (Duvallet, 2017). Ces écrans montrent une très bonne efficacité sur le terrain pour des populations sensibles (Photos 5, 6 et 7).

Les évaluations se poursuivent, y compris pour des pièges innovants qui seront utilisés là où les populations sont résistantes aux insecticides. Les pièges doivent être les plus efficaces possible pour la capture des stomoxes, et les plus sélectifs possible en ne capturant pas d’autres insectes.
Des écrans développés dans le cadre du projet FlyScreen ont été mis en place dans plusieurs fermes en Thaïlande et donnent de bons résultats en limitant fortement la densité apparente des stomoxes, qui sont encore très sensibles aux insecticides utilisés. Il en est de même en Afrique sub-saharienne où les glossines (mouches tsétsé) sont aussi très sensibles. Mais sur le campus de l’Ecole vétérinaire de Toulouse, où l’on sait que les stomoxes sont particulièrement résistants à tous les insecticides utilisables, les écrans sont peu efficaces, d’où notre intérêt pour l’évaluation de système de piégeage.

La lutte contre les stomoxes est rendue difficile pour plusieurs raisons : ces mouches ne restent sur l’animal que le temps nécessaire à prendre leur repas de sang, elles se reposent ensuite dans la végétation pour digérer et leur dispersion dans l’espace ne facilite pas leur contrôle ; les sites de reproduction et de développement larvaire sont aussi très variés : herbes en décomposition, tas de fumier lorsqu’il y a beaucoup de paille, balles de foin lorsqu’il y a une forte humidité….
Au Costa Rica, où j’ai été amené à faire une mission en raison de pullulations observées de stomoxes dans des plantations d’ananas, nous avons constaté que les mouches femelles venaient pondre sur la matière végétale qui restait au sol après la récolte des fruits. Ce milieu extrêmement favorable entraînait des densités de mouches très fortes et une nuisance terrible pour les travailleurs et pour les élevages des environs.

Des situations similaires se rencontrent dans le sud du Brésil dans les plantations de canne à sucre, ou dans l’ouest de l’Australie autour de Perth dans des plantations de légumes. L’idée est en effet de ne plus brûler ces résidus végétaux pour ne pas envoyer plus de CO² dans l’atmosphère, mais de les incorporer au sol. Bonne idée a priori que de rendre de la matière organique au sol, projet d’ailleurs soutenu par une initiative internationale (4 pour 1 000). Mais, dans les pays évoqués ci-dessus, ce sont des dizaines de milliers d’hectares qui ont été plantés.
Le Costa Rica, petit pays, est devenu le premier producteur et exportateur mondial d’ananas. Les masses énormes de matière végétale en décomposition sont très favorables aux mouches. Nous avons constitué avec les américains, les costariciens, les brésiliens, les australiens et nous-même un consortium pour discuter et proposer des méthodes de lutte adaptées à ces situations.
Lutte biologique par lâchers de parasitoïdes, lutte mécanique par déploiement d’écrans, de pièges attractifs et sélectifs, enfouissement profond de la matière organique sont quelques-unes des méthodes à intégrer dans un programme de contrôle de la nuisance. Des recherches sont encore nécessaires notamment sur la mise au point de produits efficaces attractifs d’un côté (pour le piégeage) et répulsifs de l’autre (protection des humains et des animaux) qui permettrait de développer une méthode dénommée « push-pull » par les anglo-saxons.
Conclusion
Ces mouches sont une nuisance importante pour l’élevage et l’agriculture et des recherches sont encore nécessaires pour mettre au point des méthodes de lutte efficaces et respectueuses de l’environnement. Il est regrettable que les formations universitaires en entomologie aient disparu en France.
Pour se former en Entomologie médicale et vétérinaire, ne subsiste qu’un cours de quelques semaines tous les deux ans à l’Institut Pasteur de Paris et un Master International d’Entomologie médicale et vétérinaire (MIE) que l’on a ouvert en Afrique de l’Ouest (actuellement à Bouaké en Côte d’Ivoire, avec le soutien de l’Université de Montpellier).
Bibliographie
- Duvallet G., (2017) : Le bleu, couleur fatale pour les stomoxes. Insectes, 184 (1) : 11-14
- Gilles J., David J.-F., Duvallet G., (2005) : Temperature effects on the development and survival of two stable flies, Stomoxys calcitrans and Stomoxys niger niger (Diptera: Muscidae), in La Réunion island. Journal of Medical Entomology, 42 (3): 260-265 (lien)
- Jacquiet P., D. Rouet, E. Bouhsira, A. Salem, E. Liénard, M. Franc (2014) : Population dynamics of Stomoxys calcitrans (L.) (Diptera: Muscidae) in southwestern France. Revue Médecine Vétérinaire., 2014, 165, 9-10, 267-271 (lien)
- Liénard, E., Salem, A., Jacquiet, P., Grisez, C., Prévot, F., Blanchard, B., Bouhsira, E., Franc, M. (2013) : Development of a protocol testing the ability of Stomoxys calcitrans (Linnaeus, 1758) (Diptera: Muscidae) to transmit Besnoitia besnoiti (Henry, 1913) (Apicomplexa: Sarcocystidae). Parasitology Research, 112(2): 479-486 (lien)
- Salem A, Bouhsira E, Liénard E, Bousquet Melou A, Jacquiet P, Franc M. (2012) : Susceptibility of two European strains of Stomoxys calcitrans (L.) to Cypermethrin, Deltamethrin, Fenvalerate, k-cyhalothrin, Permethrin and Phoxim. International Journal of Applied Research in Veterinary Medicine, 10, 249–257 (lien)
- Sharif, S., Jacquiet, P., Prevot, F., Grisez, C., Bouhsira, E., Franc, M., Lienard, E. (2017) : Assessment of persistence of Besnoitia besnoiti (Henry, 1913) bradyzoites in Stomoxys calcitrans (Diptera: Muscidae). Revue de Médecine Vétérinaire, 168 : 197-203 (lien)
- Tainchum, K., S. Shukri, G. Duvallet, L. Etienne, and P. Jacquiet. (2018) : Phenotypic susceptibility to pyrethroids and organophosphate of wild Stomoxys calcitrans (Diptera: Muscidae) populations in southwestern France. Parasitol. Res. 117: 4027–4032 (lien)
- Taylor DB, Moon RD and Mark DR (2012) Economic Impact of Stable Flies (Diptera: Muscidae) on Dairy and Beef Cattle Production. Journal of Medical Entomology 49:198-209 (lien)





