Par Paul Clémençon
Cet article sur la neuroécologie des courses-poursuites est divisé en deux parties. Ne manquez pas la première partie sur l’écologie des jeux de cache-cache/évasion, avant de lire celle-ci, qui porte plus sur des aspects neuroéthologiques.
II – Détection et traitement des informations sensorielles
Les prédateurs produisent des indices (cues) qui peuvent être détectés par la proie. La réponse d’évasion est décomposable en trois parties, comme décrit dans (1). Il s’agit tout d’abord d’une classification de l’information sensorielle incluant des composants perceptuels (nature du stimulus), et de valeur (est-ce que le stimulus est menaçant ou non). Ensuite, il y a une phase de sélection d’action (initiation de la réponse), autrement dit quelle action du répertoire comportemental est la plus appropriée à la situation. Enfin, il y a une phase d’action (exécution de la réponse).
Après une description du « cahier des charges » d’un système de fuite, nous décrirons certains circuits neurosensoriels connus dans la détection des prédateurs.
A) Caractéristiques générales des réponses d’évasion
Une interaction physique avec un prédateur conduit à une perte de fitness. Dans le cas le plus extrême, l’interaction proie-prédateur conduit à la mort de la proie. Même si la proie parvient à s’échapper, les blessures se traduisent par exemple par un perte de la capacité locomotrice pour rechercher un partenaire ou de la nourriture, ou par un handicap lors de combat avec des conspécifiques (1). Les pressions de sélections sur l’évasion se traduisent par des systèmes nerveux innés (hardwired) avec de hauts niveaux d’efficacité, avec toutefois une part de flexibilité.
Les circuits d’évasion (2) :
- Sont rapides et avec un timing précis. Une milliseconde peut faire la différence. Chez les insectes, il n’existe pas de gaine de myéline (pas de conduction saltatoire). La vitesse de conduction dépend alors du diamètre des neurones : plus le neurone est gros, plus rapide est la conduction de l’influx nerveux. On retrouve des neurones géants impliqués dans l’évasion chez de nombreux ordres d’insectes
- Sont résistants aux faux négatifs et aux faux positifs, et intégrés à la biologie. S’échapper dans des situations inappropriées peut être très coûteux (figure 4)
- Sont matched. Les circuits sont adaptés aux forces et faiblesses du prédateurs. Les structures neurales sont coûteuses à entretenir, et posséder des systèmes sensoriels périphériques sélectifs aux stimuli les plus pertinents pour la biologie permet de s’affranchir de calculs neuronaux supplémentaires (3). Par exemple, les papillons de nuit présentent des tympans sélectifs à une gamme de hautes fréquences qui correspondent grosso modo à celle utilisées par les chauves-souris (4). L’entretien des systèmes nerveux est coûteux, et on a observé une sensibilité plus forte des neurones AN2 (des neurones clés dans la perception des ultrasons) chez les populations de grillons exposés à un fort risque de prédation par des chauve-souris, en comparaison avec une autre population vivant dans une zone avec un risque plus bas (5)
- Présentent souvent une parcimonie neuronale, la rapidité de la réponse impose une limite numérique sur le nombre de neurones
- Sont innés et adaptatifs. Se baser entièrement sur l’expérience du danger est risqué. Certains motifs sont extrêmement conservés, comme par exemple les neurones sensibles à un stimulus visuel looming (voir figure 5.1 ci-dessous). On décrit souvent l’évasion comme de simples boucles réflexes, mais il s’agit en fait d’une réponse coordonnée décomposable en une série de « sous-comportements » (6)
On parle de fixed action pattern pour décrire un comportement stéréotypé, caractéristique d’une espèce et déclenché par un stimulus releaser. Cependant, certaines réponses d’évasion peuvent être interrompus en cours de route, et peuvent dépendre de l’expérience, ce qui n’est pas le cas d’un fixed action pattern au sens strict.
B) Système visuel de détection des collisions
Lorsqu’un prédateur s’approche d’une proie, cela produit une tâche (projection rétinienne) dont la taille angulaire ϴ(t) augmente de manière non-linéaire au cours du temps (figure 5c). Celle-ci ne dépend que du ratio l/v entre la demi-taille de l’objet et sa vitesse d’approche. On appelle cela le looming (figure 5.1). De nombreux neurones sensibles au looming ont été découvert chez les Vertébrés et Invertébrés, soulignant une convergence évolutive et l’importance de ces indices pour la biologie des animaux (10) (lien).
Le système visuel des insectes est assez bien connu (lien). Les lobes optiques sont divisés en plusieurs régions. Il y a dans l’ordre : les photorécepteurs, la lamina, la médulla puis la lobula/lobula plate. Le traitement de l’information visuelle se fait de manière progressive (figure 6). Les cellules plus périphériques encodent la luminance d’un objet, celles des couches inférieures encodent les variations de luminance, et les cellules de couches encore inférieures encodent des caractéristiques visuelles plus fines, comme le mouvement (Elemenary Motion Detectors EMD).
Articles sur le système nerveux des insectes : Système nerveux central – Système nerveux généralité
B1. Chez la drosophile
En raison de la présence d’outils génétiques, et de son statut d’« organisme modèle », l’anatomie du système visuel de détection des collisions est plus connu chez la Drosophile que chez le criquet.
Chez la Drosophile, on observe deux types de réponses. Une réponse courte d’urgence, qui est rapide (chaque ms compte !) mais qui nécessitera des manœuvres pour corriger la trajectoire du vol instable, et une réponse longue, durant laquelle on observe une élévation des ailes avant la saut (préparation de la posture) (7).
Les neurones clés sont les cellules LPLC2, LC4, et les neurones descendants (DN), le plus célèbre étant la Fibre Géante (GF=Giant Fiber). Les cellules LPLC2 reçoivent des entrées des neurones T4 et T5 qui sont sensibles au mouvement. Les cellules LPLC2 indiquent la taille de l’objet, alors que les cellules LC4 (Lobula Columnar type 4) indiquent la vitesse de l’objet. On parle de multiplexing d’information (ou de traitement parallèle) : les caractéristiques d’un prédateur (sa taille et sa vitesse d’approche) sont traitées en même temps par des circuits spécialisés parallèles, accélérant le traitement.
La Fibre Géante réaliserait l’opération de multiplication l/v en combinant les entrées synaptiques provenant des cellules LPLC2 (taille, cellule orange sur la figure 6), et celles provenant des cellules LC4 (vitesse, cellule bleue sur la figure 6) (11). Lorsqu’un potentiel d’action est produit par la Fibre Géante, il se produit toujours des évasions de type « mode-court », sans élévation des ailes au préalable. La Fibre Géante est souvent décrite comme un neurone de commande, dont l’activation suffit à déclencher l’évasion, mais la situation est probablement un peu plus complexe.
En parallèle, les cellules LC4 et LPLC2 réalisent des connections avec d’autres neurones descendants (12). C’est l’activation simultanée d’autres DNs qui produirait les réponses en mode-long, on encore les marches arrière. On retrouverait donc des circuits parallèles, l’un dédié aux urgences (par un neurone de « commande ») et l’autre aux réponses avec plus de préparations (par une population de neurones).
Rappelons également que nous voyons le monde avec une fréquence de 60Hz, alors les mouches voient le monde avec une fréquence de rafraîchissement d’environ 250Hz (elles voient plus d’images par seconde). C’est l’une des raisons pour laquelle il est si difficile d’attraper une mouche.
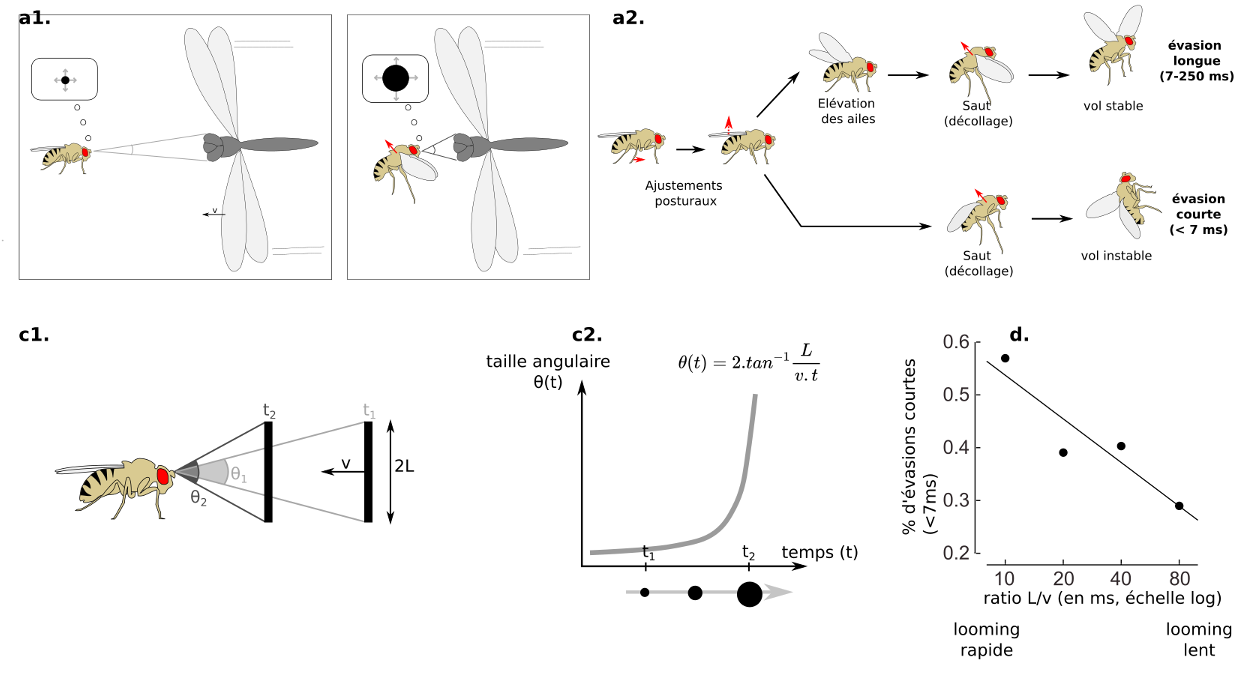
(a) Envol chez la drosophile en réponse à un prédateur. Le comportement d’évasion peut être sub-divisé en sous-comportements qui peuvent être interrompus. On distingue une évasion longue, qui inclut une élévation des ailes, rendant le vol post-décollage plus stable, et une évasion courte, pour les urgences, qui supprime l’étape d’élévation des ailes, gagnant plusieurs précieuses millisecondes, mais nécessitant des manœuvres aériennes pour corriger la trajectoire après coup – (a1, b1, c1) Notion de looming stimulus. Lorsqu’un prédateur s’approche, cela produit une « tâche » dont la taille grossit au cours de l’approche d’un prédateur – (c2) La taille angulaire θ(t) de cette tâche augmente de manière non linéaire au cours du temps, et ne dépend que du ratio L/v – (d) corrélation linéaire positive entre l’imminence du looming (plus le temps l/v est petit, plus la collision arrive rapidement), et la proportion d’évasion courtes chez la Drosophile -D’après (7) (Source : P. Clémençon)
B2. Chez le criquet
En présence d’un prédateur approchant, les criquets peuvent réaliser une réponse d’évasion composée de sous-comportements qui peuvent être interrompus : flexion initiale, co-contraction et saut (figure 5.2). La biomécanique est assez remarquable car les pattes réalisent une accélération de 100g lors de la détente !
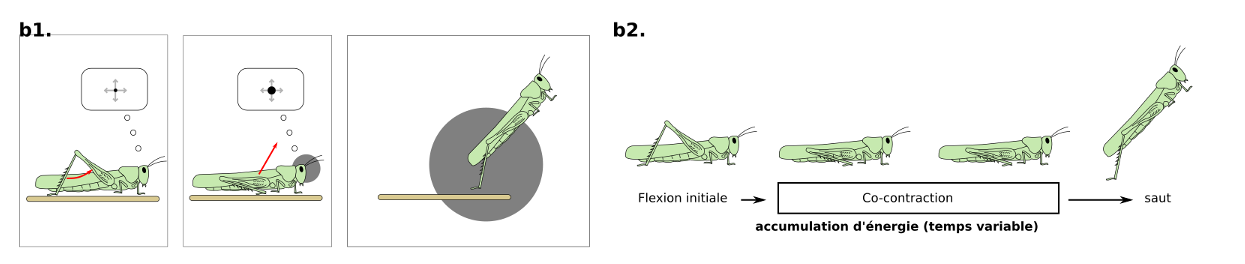
Les neurones clés sont le Descending Contralateral Movement Detector (DCMD) et le lobula giant movement detector (LGMD1 et LGMD2).
Le LGMD, situé dans le lobula, est connecté avec le DCMD, un neurone descendant. Le DCMD est un neurone avec un axone de large diamètre (15 um) qui est connecté avec les motoneurones thoraciques, déclenchant l’évasion (flexion initiale, co-contraction des muscles flexeurs et extenseurs, puis détente). Chaque potentiel d’action enregistré dans le DCMD correspond exactement à un potentiel d’action émis par le LGMD. Autrement dit, pour enregistrer l’activité du LGMD, on peut enregistrer à la place l’activité du DCMD (« plus simple ») et vice-versa.
Le LGMD (et donc le DCMD) réagit sélectivement à des objets approchant (looming stimuli) (13). indépendamment de leur forme (rond ou carré), texture (damier ou motif plein), ou de la température. Dans une expérience ayant conduit à l’obtention d’un prix IgNobel, Rind & Simmons ont enregistré l’activité du LGMD en projetant le film Star Wars à un criquet. Ils ont pu corréler les pics d’activité du LGMD avec les moments où un vaisseau s’approche de la caméra.
Le LGMD possède un large arbre dendritique, divisé en 3 sous-régions : 2 branches mineures et l’arbre majeur, qui ressemble à un éventail et qui reçoit des informations de cellules sensibles à la direction du mouvement. On observe expérimentalement que le pic d’activité du LGMD (fréquence maximale de potentiels d’action) coïncide avec le moment où la taille angulaire ϴ(t) du prédateur dépasse un seuil ϴseuil, avec un petit délai fixe (14)
En termes algorithmiques, le LGMD se comporte comme un détecteur de seuil angulaire, et réalise une multiplication (combinaison de L et 1/v) dont l’implémentation n’est pas entièrement comprise (15). D’autres neurones sensibles au looming ont été découverts, et un traitement de l’information pourrait avoir lieu en parallèle du LGMD.
Ainsi, on retrouve des similarités et des différences dans l’organisation anatomique du système visuel des criquets et Drosophiles ainsi que dans l’algorithme de détection du looming (extraction du mouvement, extraction des caractéristiques de looming, opération de multiplication, et action) (figure 6).
Articles sur le système nerveux des insectes : Système nerveux central – Système nerveux généralité
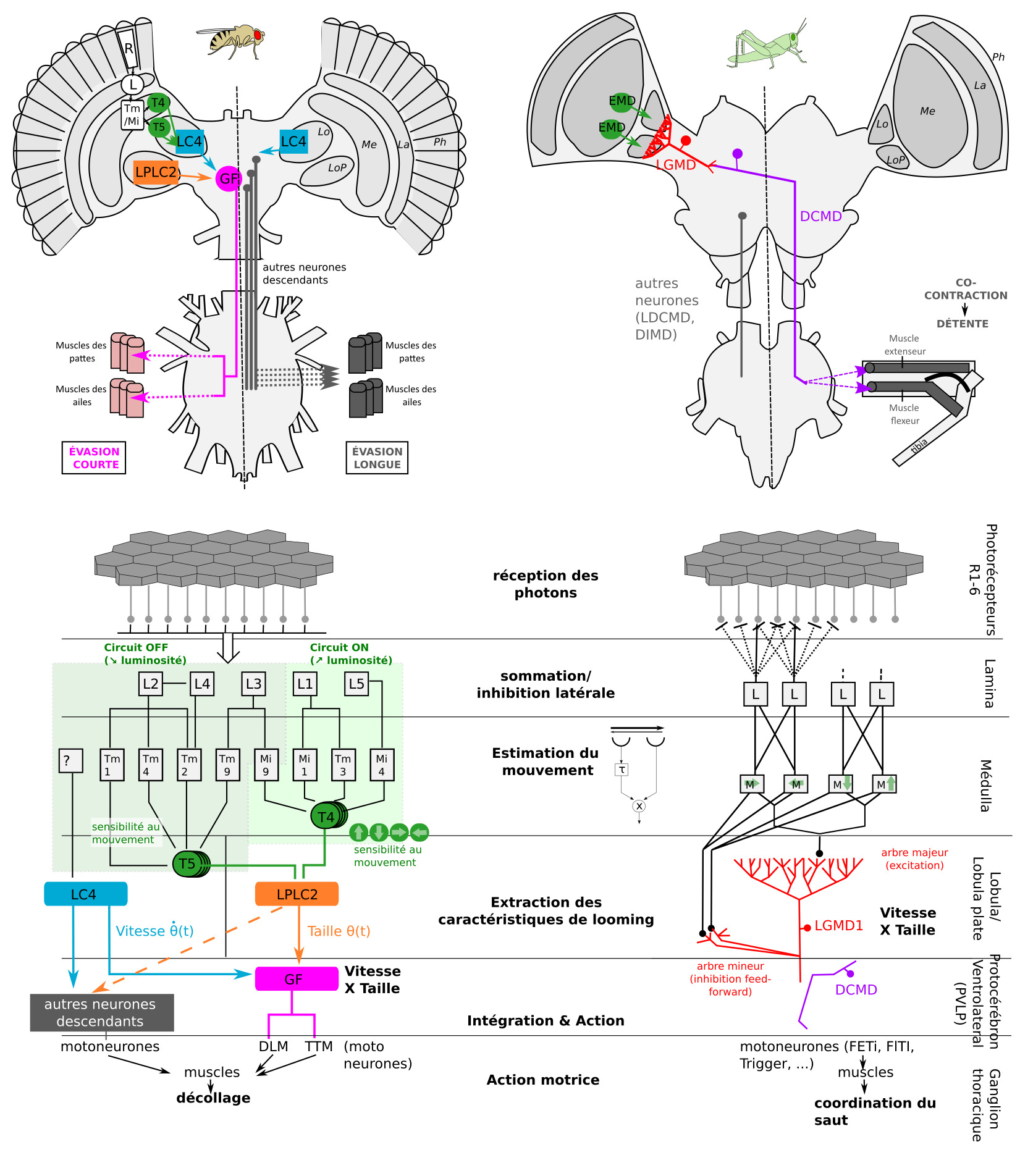
Le schéma du circuit de la Drosophile est directement inspiré de (33). Celui du criquet est inspiré de (34),et insiste plus sur les calculs réalisés, l’identité des cellules étant moins connue que chez la Drosophile (Source : P. Clémençon)
C) Système auditif
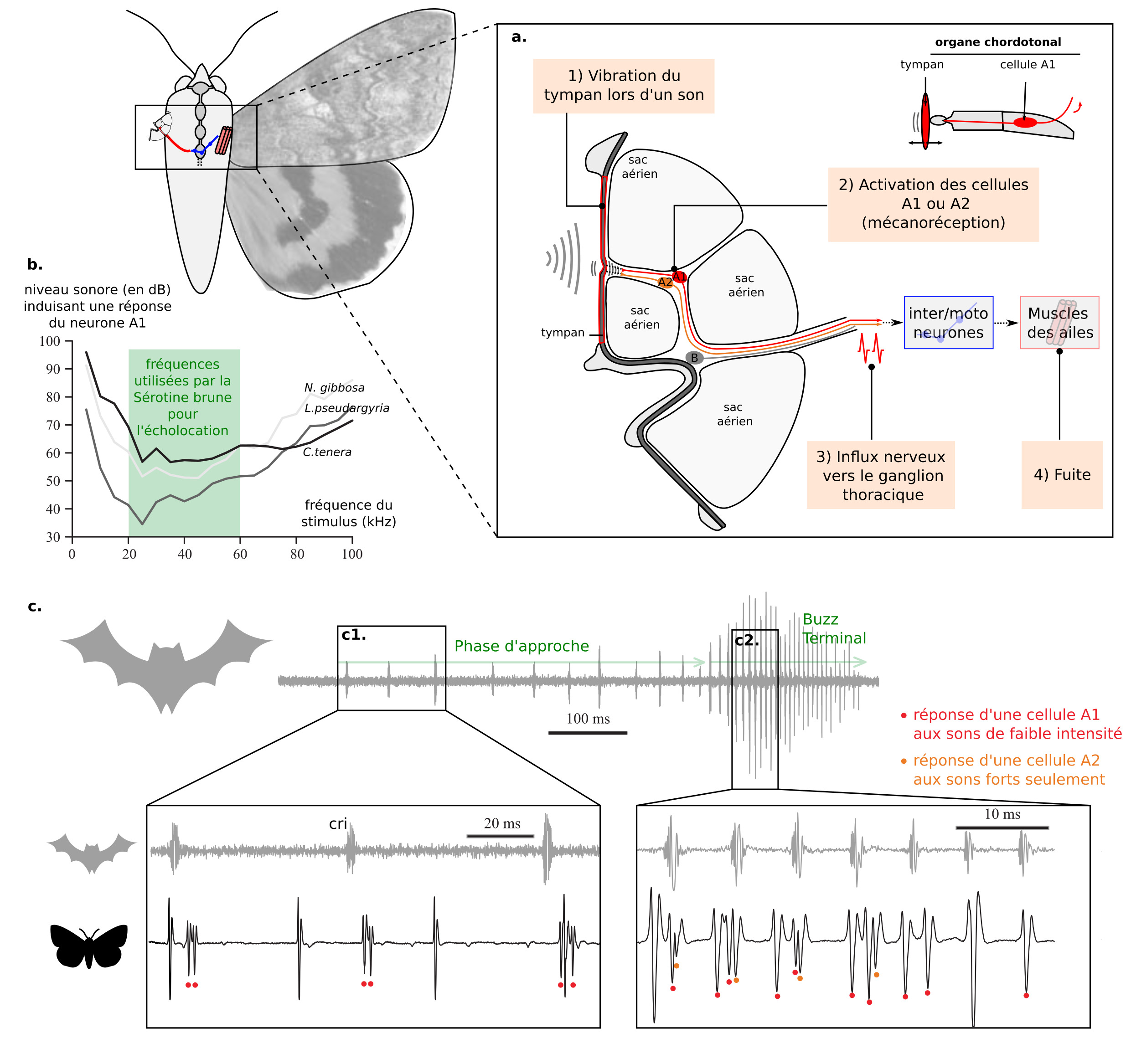
L’écholocation, utilisée par les chauve-souris pour localiser leurs proies, est également leur talon d’Achille. De nombreux insectes volants nocturnes possèdent des « oreilles », une fine membrane de cuticule appelée tympan couplée à des organes chordotonaux. Ces tympans sont également associés avec des sacs aériens. Il existe une grande diversité de forme et de placement de ces oreilles (figure 7a) (17).

La vibration du tympan lors de la réception d’un son conduit à l’excitation de neurones sensoriels (A1 et A2 chez les papillons de nuit). L’influx nerveux est traité par les interneurones des ganglions thoraciques (lien) (réduction du bruit et sommation temporelle du signal). Ensuite, des motoneurones sont alors activés et coordonnent une réponse d’évasion, comme un plongeon d’urgence (figure 7). Chez de nombreux papillons, le seuil d’activation des cellules A1 et A2 est bas pour des fréquences autour de 20kHz, fréquences utilisées par la sérotine brune (figures 8a & 8b).
L’attaque d’une chauve-souris commence par de simples clics, et, si un papillon est choisi comme cible (l’attaque est alors imminente), la fréquence de clics augmente : c’est la phase de buzz terminal. Comme présenté sur les enregistrements électrophysiologiques (4) de la figure 8c soulignent, les cellules A1 (rouge) réagissent à des sons de faibles intensité, permettant de détecter les chauve-souris lorsque la phase d’approche commence à peine. L’asymétrie entre les réponses des cellules A1 situés à gauche ou à droite du papillon l’informe de la localisation de la chauve-souris. Il est intéressant de noter que les neurones aux seuils les plus bas peuvent détecter les cris des chauve-souris à un moment où l’écho retour est trop faible pour être audible pour les chauve-souris, donnant un avantage crucial pour le papillon. Les cellules A2 ont un seuil d’intensité plus haut et leur activation indiquerait un danger imminent, comme le buzz terminal d’une chauve-souris.
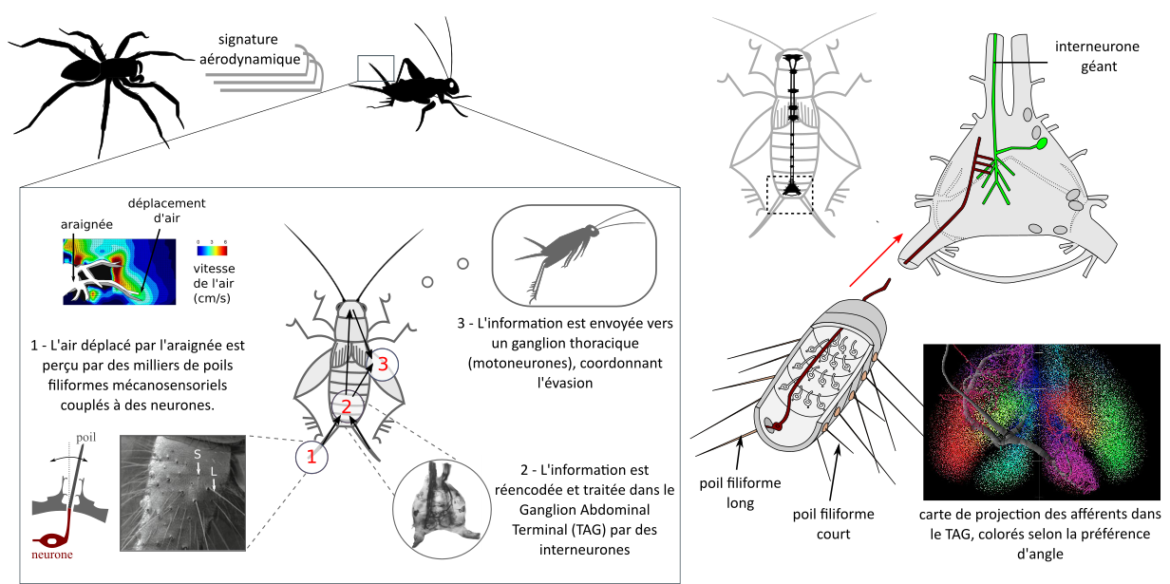
D) Système de perception des flux d’air
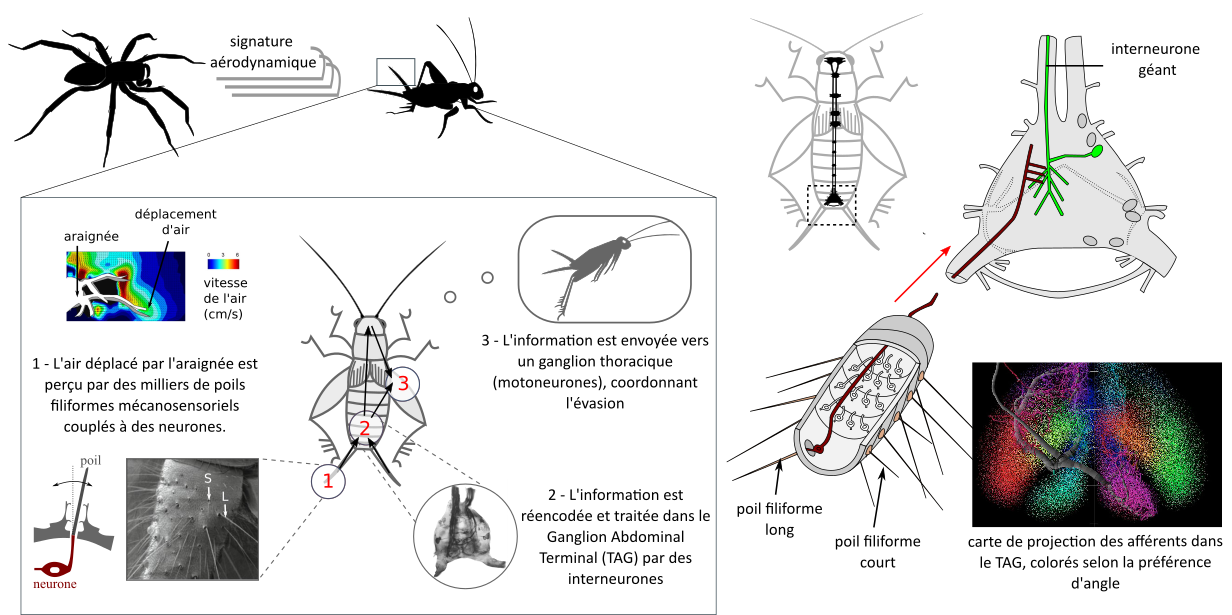
Les blattes, les grillons et plusieurs Hexapodes « basaux » (thysanoures, lépismes, …) (lien) possèdent à l’arrière de l’abdomen des cerques (figure 9) (18), un système sensoriel généraliste impliqué dans de nombreux comportements : reproduction, perception de la gravité et fuite notamment. Ces cerques sont recouverts de poils mécanosensoriels couplés chacun à un neurone. Lorsque l’inclinaison du poil dépasse un certain seuil, le neurone couplé produit un influx nerveux (lien).
Le système est à ce jour le plus sensible du règne animal, 1/10ème de l’énergie d’un photon suffirait à activer les neurones mécanosensoriels (19).
Les poils sont de taille variable, entre 0.2 et 2 mm. Une des interprétations fonctionnelles proposées est la suivante : lorsqu’un prédateur arrive à toute vitesse, les poils courts réagiraient avant les poils longs, et le recrutement successif des poils indiqueraient un danger imminent. Lorsqu’un prédateur arrive lentement, les poils courts ne collecteraient pas assez d’énergie pour dépasser l’angle seuil à l’inverse des poils longs qui indiqueraient la présence du prédateur (20) (lien). Les poils présentent également un angle préférentiel. Le neurone couplé à un poil sélectif aux déplacements d’air transversaux réagira plus fortement à un prédateur venant du côté qu’un prédateur venant de l’arrière. L’hétérogénéité dans la canopée de poils refléterait la large gamme de flux d’air qu’un grillon pourrait rencontrer dans son environnement.
L’information provenant de tous ces poils est traitée dans le ganglion abdominal terminal (TAG) composé d’une vingtaine d’interneurones géants permettent une vitesse de conduction rapide, et d’une trentaine de neurones locaux. Les propriétés sélectives des poils permettraient d’effectuer un multiplexing d’information. Par exemple, les synapses des poils présentant le même angle préférentiel se situent à peu près au même endroit dans le ganglion abdominal terminal, et cela coïncide avec les dendrites (inputs) de 4 interneurones du TAG présentant également des directions préférées (figure 9). Ces 4 interneurones répondent de manière maximale à des stimulus provenant de 45, 135, 225, 315°. Ces 4 neurones formeraient une unité fonctionnelle suffisante pour encoder la direction du stimulus. (21)
Concernant l’identité du flux d’air, les grillons distingueraient un prédateur et le vent ambiant ou les propres mouvements de l’animal via l’encodage du profil d’accélération. Le LGI, le plus gros interneurone, est l’un des candidats.
On dit souvent que l’information provenant de 1 000 poils est compressée dans un système comprenant moins d’une centaine de neurones. En fait, il ne s’agit pas d’une compression, mais plutôt d’une extraction des caractéristiques les plus pertinentes : l’identité, la direction et l’intensité du flux d’air. Lorsqu’un journal enroulé se dirige vers une blatte, l’information pertinente est qu’un objet dangereux arrive vite, et non le titre du journal.
E) Intégration multimodale et aspects cognitifs
D’autres systèmes de détection non décrits ici des prédateurs incluent : le toucher et la perception des vibrations (par des sensilles campaniformes, organes chordonotaux et subgénuaux) ou l’odorat (par des sensilles olfactives).
L’évasion est multisensorielle et les différentes modalités décrites précédemment interagissent. Le cerveau combine ces entrées sensorielles variées, en les pondérant, pour ne produire qu’une sortie comportementale. Une modalité sensorielle peut induire une augmentation de la sensibilité d’une autre. Par exemple, chez les mâles de noctuelle Spodoptera, la sensibilité des neurones olfactifs à la phéromone (olfaction) augmente quelques heures après l’exposition de cris de chauve-souris (audition) (24).
Les insectes peuvent réaliser des apprentissages non associatifs (habituation, sensibilisation, …) et associatifs (conditionnement). Lors d’attaques répétées, on peut observer une sensibilisation se traduisant par un état d’alerte prolongé, une diminution du temps de réaction, une augmentation de la FID (distance proie-prédateur nécessaire pour que la proie fuit) ou encore des changements de stratégies. A l’inverse, l’exposition répétée d’un stimulus non nocif peut conduire à des phénomènes d’habituation comme chez les larves de moustiques (25) (26).
Concernant les apprentissages associatifs, les insectes peuvent apprendre les zones de prédations (par exemple les fourmis et les pièges des fourmillons), et certains insectes, même non sociaux comme par exemple les grillons des bois (27), apprennent un danger en apprenant de conspécifiques (social learning).
L’évasion est le résultat de l’intégration et pondération de multiples modalités sensorielles ainsi que de connaissances, ne produisant au final qu’un seul output comportemental, une grande question en neurosciences.
III) L’évasion des insectes et l’Homme
Nous discuterons de deux points : l’apport de la compréhension des mécanismes d’évasion pour anticiper certaines réponses aux changements globaux, et l’utilisation des connaissances sur les circuits neuraux sous-jacents à l’évasion pour la bio-inspiration (figure 10).
A) Biomimétisme
L’évasion peut se résumer en un « calcul sensorimoteur donnant un comportement flexible dans un temps contraint ».
Pour les aspects sensoriels, les structures impliqués dans l’évasion ont parfois donné lieu à des implémentations technologiques (figure 10). La compréhension des mécanismes physiques de la déflexion des poils filiformes du grillon a inspiré le développement de micro-senseurs de flux d’air, des MEMS, qui pourraient être utilisés pour détecter d’éventuelles fuites, invisibles à l’œil nu (28). Les pattes sauteuses puissantes du criquet inspirent des actionneurs mécaniques capable de stocker de l’énergie élastique et de la libérer rapidement.
Pour les aspects neuronaux, les circuits sous-jacents l’évasion intéressent de près les ingénieur.e.s en neuromorphique (29) et en robotique. La contrainte de rapidité se traduit probablement par un nombre limité de connections synaptiques, et une simplicité structurale en comparaison à d’autres circuits. Le système visuel du criquet a par exemple inspiré plusieurs algorithmes de détection des collisions (30), qui ont été implémentés dans des puces électroniques (31), ou dans des robots (9).
Pour les aspects plus comportementaux, la biomécanique spectaculaire de certains systèmes, comme les pattes des criquets, inspirent des systèmes dits de ressort. Certaines sociétés utilisent les connaissances sur l’évasion chez les papillons de nuit pour concevoir des drones destinés à être déployés dans les serres pour éliminer les papillons de nuit nuisibles aux récoltes, sans affecter les autres insectes.
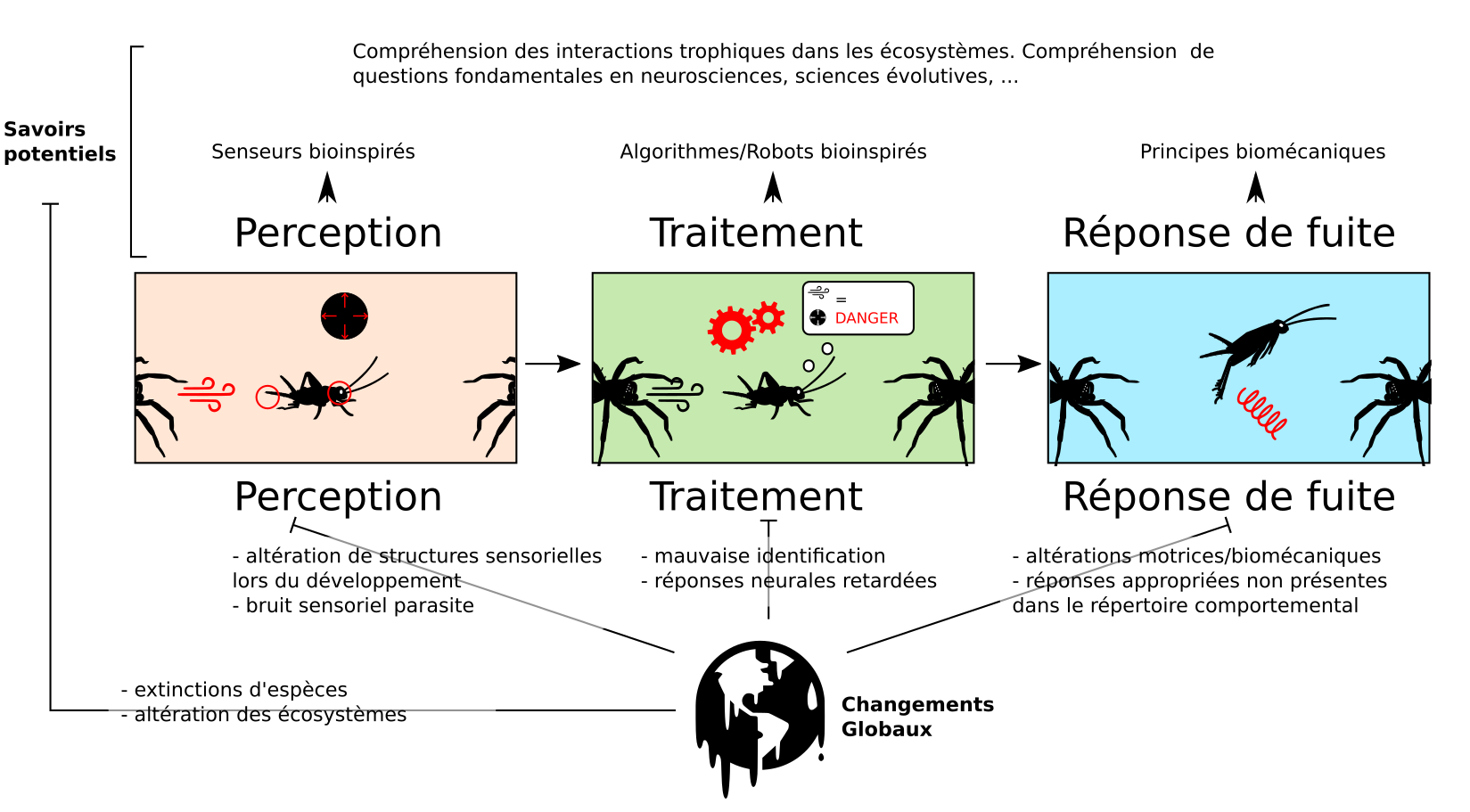
B) Changements globaux
Les modifications de température et le bruit anthropique pourrait altérer la performance musculaire et sensorielle des insectes comme décrit chez les poissons (32) (figure 10). Cette diminution des capacités pourrait avoir des conséquences en chaîne sur les écosystèmes (33) (34). Brièvement, plusieurs études soulignent la probable plus grande sensibilité des prédateurs aux températures par rapport à leurs proies (35), ainsi que l’augmentation potentielle de prédation intra-guilde du fait de la modification des niches (36) (37), ce qui pourrait conduire à terme à une prolifération d’herbivores nuisibles dans les récoltes. L’arrivée de nouveaux prédateurs par dispersion anthropique, comme le frelon asiatique, peut avoir de larges conséquences, les proies ne possédant pas de systèmes sensorimoteurs adaptés (« matched », voir partie I) à ces prédateurs.
Concernant l’évasion en elle-même, plusieurs altérations des réponses d’évasion ont été observées.
Les syrphes qui utilisent le mimétisme batésien comme défense anti-prédateur primaire pourraient voir leur taux de prédation augmenter suite à des changements de phénologie (38).
Certains polluants, même en capacités sublétales, peuvent altérer les capacités d’évasion en diminuant les capacités d’habituation ainsi que l’activité spontanée des neurones du système visuel du criquet (39). La pollution lumineuse, comme les lampes aux vapeurs de mercure (certes beaucoup moins utilisées aujourd’hui), inhibent la perception des ultrasons par les papillons, et donc diminuent leur capacité à évader aux chauve-souris (40). Une augmentation du CO2 atmosphérique pourrait quant à elle diminuer les capacités d’évasion, comme cela a été montré chez les pucerons (41). Des perturbations du développement pourrait se traduire par des altérations des structures sensorielles et motrices, diminuant les capacités évasives des insectes.
L’extinction de certaines espèces d’insectes se traduit également par une perte irrémédiable de savoirs fondamentaux potentiels (en neurosciences, sciences évolutives, écologie,…) qui auraient pu par exemple être transposées de manière plus appliquée (dans des technologies comme décrit plus haut par exemple).
Chaque espèce raconte une histoire particulière (principe de Krogh : « en sélectionnant le bon modèle animal, on peut maximiser le ratio signal sur bruit, rendant l’interprétation des résultats beaucoup plus simple (42), et la connaissance des mécanismes ne peut se faire qu’avec des organismes dits « modèles ».
Conclusion
L’évasion chez les insectes offre un cadre de travail combinant terrain et de laboratoire. L’élicitation répétable des réponses d’évasion et le faible nombre de neurones impliqués (du fait de la parcimonie neurale liés aux contraintes de vitesse) sont des avantages pratiques.
La flexibilité dans les réponse offre néanmoins la possibilité d’étudier comment le systèmes nerveux extraient l’information et prennent une décision motrice appropriée dans un temps contraint.
Les fortes pressions anthropiques peuvent se traduire en des opportunités manquées de mieux comprendre les systèmes proies-prédateurs. La diversité des innovations évolutives pour échapper aux prédateurs apporte des connaissances fondamentales mais également appliquées en inspirant par exemple de nouvelles technologies.
|
Bibliographie
- D. A. Evans ; A. V. Stempel ; R. Vale & T. Branco (2019) : Cognitive Control of Escape Behaviour. Trends Cogn. Sci. 23, 334–348 (lien)
- D. D. Yager (2010) : “Predator Evasion” in Encyclopedia of Animal Behavior, M. D. Breed, J. Moore, Eds. (Academic Press, 2010), pp. 765–773
- R. Wehner (1978) : « Matched filters » — neural models of the external world. J. Comp. Physiol. A 161, 511–531 (lien)
- J. H. Fullard ; J. W. Dawson & D. S. Jacobs (2003) : Auditory encoding during the last moment of a moth’s life. J. Exp. Biol. 206, 281–294 (lien)
- J. H. Fullard, et al. (2012) : Release from bats: genetic distance and sensoribehavioural regression in the Pacific field cricket, Teleogryllus oceanicus. Naturwissenschaften 97, 53–61 (lien)
- G. M. Card (2012) : Escape behaviors in insects. Curr. Opin. Neurobiol. 22, 180–186 (lien)
- C. R. von Reyn, et al. (2017) : Feature Integration Drives Probabilistic Behavior in the Drosophila Escape Response. Neuron 94, 1190-1204.e6 (lien)
- H. S. Cheong ; I. Siwanowicz & G. M. Card (2020) : Multi-regional circuits underlying visually guided decision-making in Drosophila. Curr. Opin. Neurobiol. 65, 77–87 (lien)
- S. Bermúdez I Badia ; U. Bernardet & P. F. M. J. Verschure (2010) : Non-Linear Neuronal Responses as an Emergent Property of Afferent Networks: A Case Study of the Locust Lobula Giant Movement Detector. PLOS Comput. Biol. 6, e1000701 (lien)
- M. Y. Peek & G. M. Card (2016) : Comparative approaches to escape. Curr. Opin. Neurobiol. 41, 167–173 (lien)
- J. M. Ache, et al. (2019) : Neural Basis for Looming Size and Velocity Encoding in the Drosophila Giant Fiber Escape Pathway. Curr. Biol. 29, 1073-1081.e4 (lien)
- M. Dombrovski, et al. (2023) : Synaptic gradients transform object location to action. Nature 613, 534–542 (lien)
- F. C. Rind & P. J. Simmons (1992) : Orthopteran DCMD neuron: a reevaluation of responses to moving objects. I. Selective responses to approaching objects. J. Neurophysiol. 68, 1654–1666 (lien)
- F. Gabbiani, et al. (2004) : Multiplication and stimulus invariance in a looming-sensitive neuron. J. Physiol.-Paris 98, 19–34 (lien)
- F. Gabbiani ; H. G. Krapp ; C. Koch & G. Laurent (2002) : Multiplicative computation in a visual neuron sensitive to looming. Nature 420, 320–324 (lien)
- D. D. Yager ; M. L. May & M. B. Fenton (1990) : Ultrasound-triggered, flight-gated evasive maneuvers in the praying mantis Parasphendale agrionina. I. Free flight. J. Exp. Biol. 152, 17–39 (lien)
- D. D. Yager (1999) : Structure, development, and evolution of insect auditory systems. Microsc. Res. Tech. 47, 380–400 (lien)
- Y. Baba & H. Ogawa (2017) : “Cercal System-Mediated Antipredator Behaviors” in The Cricket as a Model Organism: Development, Regeneration, and Behavior, H. W. Horch, T. Mito, A. Popadić, H. Ohuchi, S. Noji, Eds. (Springer Japan, 2017), pp. 211–228 (lien)
- T. Shimozawa ; J. Murakami & T. Kumagai (2003) : “Cricket Wind Receptors: Thermal Noise for the Highest Sensitivity Known” in Sensors and Sensing in Biology and Engineering, F. G. Barth, J. A. C. Humphrey, T. W. Secomb, Eds. (Springer, 2003), pp. 145–157 (lien)
- T. Steinmann & J. Casas (2017) : The morphological heterogeneity of cricket flow-sensing hairs conveys the complex flow signature of predator attacks. J. R. Soc. Interface 14, 20170324 (lien)
- G. A. Jacobs ; J. P. Miller & Z. Aldworth (2008) : Computational mechanisms of mechanosensory processing in the cricket. J. Exp. Biol. 211, 1819–1828 (lien)
- J. Casas ; T. Steinmann & O. Dangles (2008) : The Aerodynamic Signature of Running Spiders. PLOS ONE 3, e2116 (lien)
- D. Booth ; B. Marie ; P. Domenici ; J. M. Blagburn & J. P. Bacon (2009) : Transcriptional Control of Behavior: Engrailed Knock-Out Changes Cockroach Escape Trajectories. J. Neurosci. 29, 7181–7190 (lien)
- S. Anton ; K. Evengaard ; R. B. Barrozo ; P. Anderson & N. Skals (2011) : Brief predator sound exposure elicits behavioral and neuronal long-term sensitization in the olfactory system of an insect. Proc. Natl. Acad. Sci. 108, 3401–3405 (lien)
- N. F. Zilber-Gachelin & M. P. Chartier (1973) : Modification of the Motor Reflex Responses Due to Repetition of the Peripheral Stimulus in the Cockroach: I. Habituation at the Level of an Isolated Abdominal Ganglion. J. Exp. Biol. 59, 359–381 (lien)
- H. Baglan ; C. Lazzari & F. Guerrieri (2017) : Learning in mosquito larvae (Aedes aegypti): Habituation to a visual danger signal. J. Insect Physiol. 98, 160–166 (lien)
- I. Coolen ; O. Dangles ; J. Casas (2005) : Social Learning in Noncolonial Insects? Curr. Biol. 15, 1931–1935 (lien)
- G. J. M. Krijnen ; H. Droogendijk ; A. M. K. Dagamseh ; R. K. Jaganatharaja & J. Casas (2014) : “Crickets as Bio-Inspiration for MEMS-Based Flow-Sensing” in Flow Sensing in Air and Water: Behavioral, Neural and Engineering Principles of Operation, H. Bleckmann, J. Mogdans, S. L. Coombs, Eds. (Springer, 2014), pp. 459–488 (lien)
- T. Dalgaty ; E. Vianello ; B. De Salvo & J. Casas (2018) : Insect-inspired neuromorphic computing. Curr. Opin. Insect Sci. 30, 59–66 (lien)
- S. Yue ; F. C. Rind ; M. S. Keil ; J. Cuadri & R. Stafford (2006) : A bio-inspired visual collision detection mechanism for cars: Optimisation of a model of a locust neuron to a novel environment. Neurocomputing 69, 1591–1598 (lien)
- D. Jayachandran, et al. (2020) : A low-power biomimetic collision detector based on an in-memory molybdenum disulfide photodetector. Nat. Electron. 3, 646–655 (lien)
- P. Domenici ; B. J. M. Allan ; C. Lefrançois & M. I. McCormick (2019) : The effect of climate change on the escape kinematics and performance of fishes: implications for future predator–prey interactions. Conserv. Physiol. 7, coz078 (lien)
- J. A. Harvey (2015) : Conserving host–parasitoid interactions in a warming world. Curr. Opin. Insect Sci. 12, 79–85 (lien)
- A. N. Laws (2017) : Climate change effects on predator–prey interactions. Curr. Opin. Insect Sci. 23, 28–34 (lien)
- M. E. Moore ; C. A. Hill & J. G. Kingsolver (2021) : Differing thermal sensitivities in a host–parasitoid interaction: High, fluctuating developmental temperatures produce dead wasps and giant caterpillars. Funct. Ecol. 35, 675–685 (lien)
- M. Pélissié ; F. Johansson & C. Hyseni (2002) : Pushed Northward by Climate Change: Range Shifts With a Chance of Co-occurrence Reshuffling in the Forecast for Northern European Odonates. Environ. Entomol. 51, 910–921 (lien)
- B. T. Barton & O. J. Schmitz (2009) : Experimental warming transforms multiple predator effects in a grassland food web. Ecol. Lett. 12, 1317–1325 (lien)
- C. Hassall ; J. Billington & T. N. Sherratt (2019) : Climate-induced phenological shifts in a Batesian mimicry complex. Proc. Natl. Acad. Sci. 116, 929–933 (lien)
- R. H. Parkinson ; S. Zhang & J. R. Gray (2020) : Neonicotinoid and sulfoximine pesticides differentially impair insect escape behavior and motion detection. Proc. Natl. Acad. Sci. 117, 5510–5515 (lien)
- A. M. Svensson & J. Rydell (1998) : Mercury vapour lamps interfere with the bat defence of tympanate moths (Operophtera spp.; Geometridae). Anim. Behav. 55, 223–226 (lien)
- W. T. Hentley ; A. J. Vanbergen ; R. S. Hails ; T. H. Jones & S. N. Johnson (2014) : Elevated Atmospheric CO2 Impairs Aphid Escape Responses to Predators and Conspecific Alarm Signals. J. Chem. Ecol. 40, 1110–1114 (lien)
- S. Lindstedt & Krogh 1929 or ‘The Krogh Principle.’ J. Exp. Biol. 217, 1640–1641 (2014)
- K. T. Sillar ; L. D. Picton & W. J. Heitler (2016) : The Neuroethology of Predation and Escape (John Wiley & Sons, 2016).

 Paul Clémençon
Paul Clémençon