Par Hugo Pereira
Les insectes eusociaux théoriquement vulnérables aux pathogènes
L’incroyable succès des insectes eusociaux et notamment des fourmis provient de la haute coopération entre les membres du groupe qui se partagent les tâches telles que la reproduction, la récolte de ressources, la protection de la colonie et le soin au couvain. Cependant, ce mode de vie engendre également une plus grande vulnérabilité face aux pathogènes et ce pour plusieurs raisons :
1) Les sociétés d’insectes eusociaux peuvent regrouper des centaines de milliers d’individus dans l’espace confiné du nid, pouvant donner lieu à une densité de population extrême. Cette densité engendre de nombreuses interactions et contacts entre les individus composant la colonie et donc favorise la transmission de pathogènes entre les membres.
2) Chez les insectes eusociaux les individus composant la colonie sont génétiquement proches. La faible diversité génétique au sein d’un groupe favorise le succès d’infection du pathogène car si ce pathogène infecte un membre de la colonie, il peut théoriquement infecter une très large majorité de la population.
3) Les nids des insectes eusociaux représentent un environnement confiné avec une température et une humidité favorisant le développement de pathogènes (Cremer et al., 2017, 2007; Schmid-Hempel, 1995).
Virus, bactéries, champignons, helminthes, plathelminthes exercent donc une pression sur les colonies d’insectes eusociaux.
Mais alors, face à ces menaces sanitaires, les insectes eusociaux ont-ils des défenses pour contrer les parasites et les pathogènes ?
Défenses mises en place chez les insectes eusociaux
Tout comme les espèces non sociales, les insectes eusociaux sont dotés de protections individuelles leur permettant de faire face aux pathogènes. Ces défenses sont d’ordre morphologiques, physiologiques et comportementales. Leur cuticule composée de mélanine représente une barrière physique efficace, sur laquelle sont déposées des molécules antimicrobiennes via des glandes exocrines. Ces substances sont notamment étalées durant le toilettage, comportement central dans les stratégies sanitaires. Les individus sont également protégés par un système immunitaire qui permet dans une moindre mesure de mettre en place une mémoire immunitaire comparable en certains points à ce que l’on peut retrouver chez les vertébrés (Masri & Cremer, 2014).
En plus des défenses individuelles propres à chaque individu, les insectes eusociaux ont développé une immunité sociale. Cette dernière se définit comme toutes les défenses prophylactiques et hygiéniques basées sur la coopération entre les individus permettant de limiter l’exposition et la prolifération de pathogènes (Cremer et al., 2007).
Depuis plusieurs décennies, de nombreuses études montrent la place importante de l’immunité sociale au sein des colonies d’insectes eusociaux telles que chez les fourmis (figure 1).
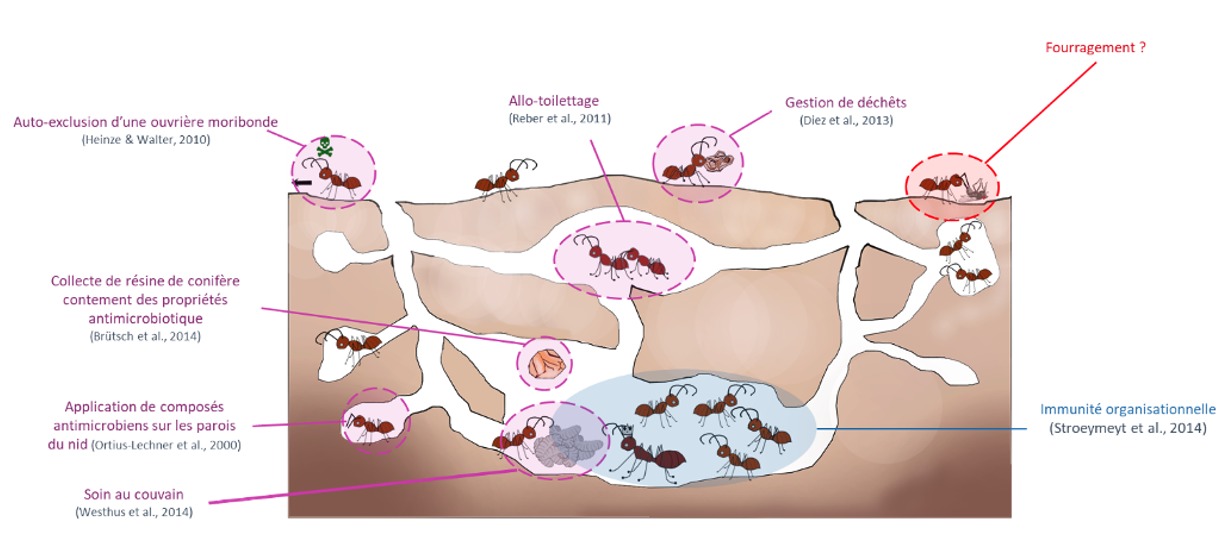
Par exemple, les ouvrières se toilettent entre elles (allotoilettage) dans le but d’enlever mécaniquement les agents pathogènes sur leur cuticule mais également afin de partager des composés antimicrobiens. Ces composés qui sont produits par la glande métapleurale et la glande à poison sont également tapissés sur les parois du nid afin de limiter la croissance de bactéries ou champignons pathogènes dans le nid.
Par ailleurs, les colonies transportent leurs déchets ainsi que les cadavres de leurs congénères à l’extérieur. Cette gestion a été montrée comme efficace pour limiter le développement de pathogènes au sein du nid. Les ouvrières moribondes infectées étant sur le point de mourir quittent la colonie et meurent loin de leurs congénères. Cette action limite également le développement de pathogènes au sein de la colonie.
Dans la structure coloniale, on retrouve une immunité organisationnelle, c’est-à-dire une ségrégation à la fois spatiale et sociale entre des individus considérés à risque (couvain et reine) et les individus impliqués dans des tâches hygiéniques. Cette structure du réseau permet donc de limiter la transmission de pathogènes entre individus effectuant des tâches différentes surtout entre celles impliquées dans des tâches à l’extérieur et celles à l’intérieur du nid s’occupant du couvain (Stroeymeyt et al., 2014).
Bien que de nombreuses stratégies sanitaires ont été révélées au sein du nid, on ne connaît que très peu de stratégies à l’extérieur du nid permettant de limiter l’apport de nouvelles charges pathogènes à l’intérieur du nid. Cette étape est pourtant cruciale car elle permettrait d’éviter les coûts énergétiques et temporels nécessaires afin de se débarrasser du pathogène.
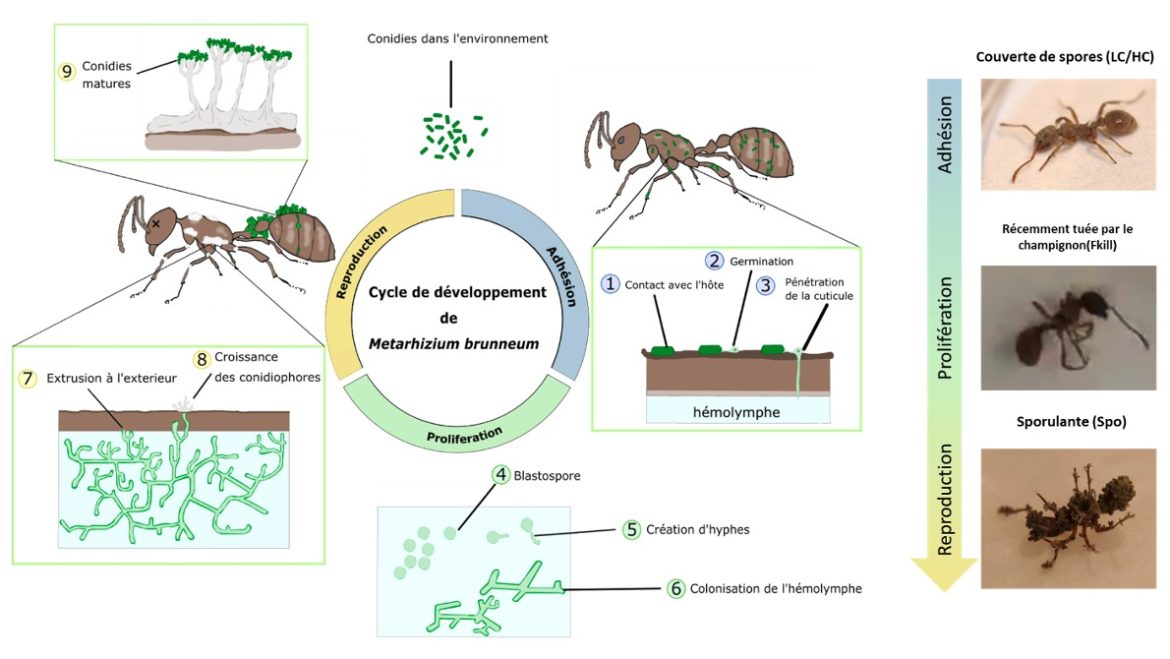
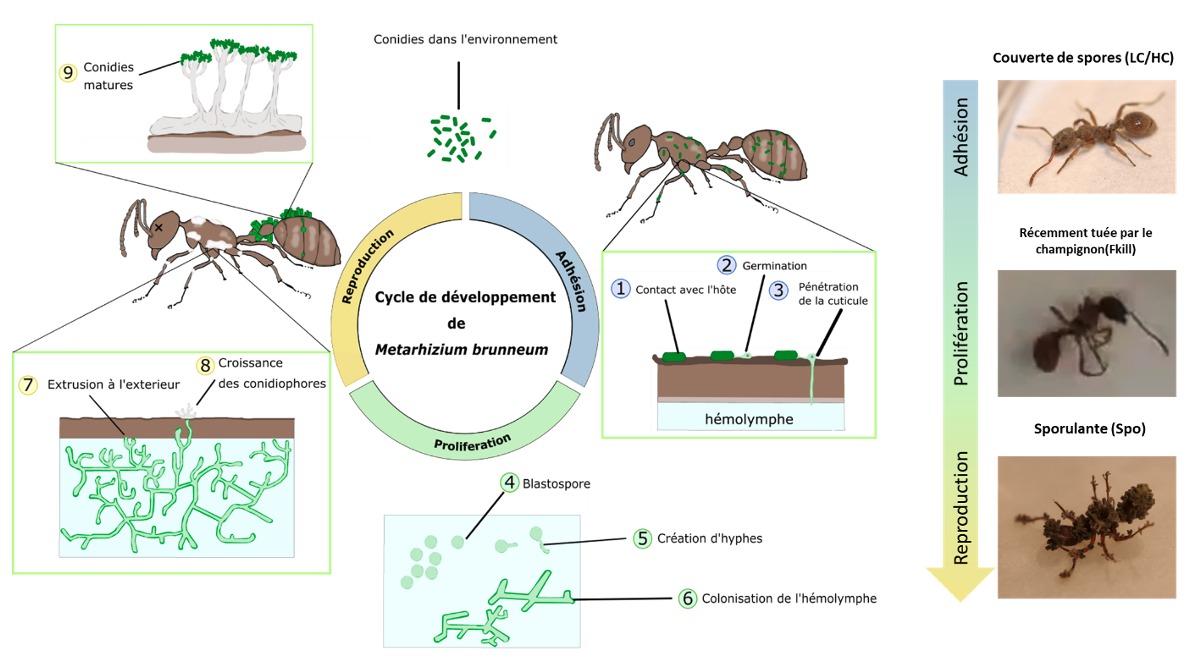
Dans plusieurs articles scientifiques parus en 2020 et 2021, des collègues et moi-même avons investigué les possibles stratégies sanitaires mises en place par l’espèce de fourmi Myrmica rubra lorsqu’elle est exposée à un champignon entomopathogène généraliste Metarhizium brunneum dans un contexte de fourragement (figure 3). Ici je vous présente une synthèse d’une partie des résultats de ma thèse réalisée à l’Unité d’Ecologie Sociale (Université Libre de Bruxelles).
Expériences réalisées
Nous avons utilisé l’espèce de fourmi Myrmica rubra (figure 2), très commune dans une large partie de l’Europe, en Russie, et en Asie centrale et septentrionale (Groden et al., 2005). Elle a un régime alimentaire omnivore, s’alimentant de nectar, de miellat, de cadavres d’insectes et chassant également de nombreux invertébrés de petites tailles. Son mode de vie et son régime alimentaire charognard en fait une espèce exposée à de nombreux pathogènes pouvant être retrouvés sur les cadavres récoltés cette espèce. Comme menace pathogène, nous avons opté pour le champignon entomopathogène Metarhizium brunneum.
Etant généraliste, il peut infecter plus de deux cents espèces d’insectes différentes dont M. rubra, et se retrouve communément dans les alentours des colonies et même à l’intérieur des nids de fourmis (Hughes et al., 2004; Keller et al., 2003 ; Angelone & Bidochka, 2018). Comme proie nous avons utilisé la mouche du vinaigre Drosophila melanogaster qui peut être également parasitée par le champignon (figure 2).

Son cycle de développement peut être divisé en 3 phases :
- Adhésion
- Prolifération
- Reproduction
Lorsque les conidies (i.e. spores asexuées) rentrent en contact avec un hôte, elles s’attachent sur la cuticule et la percent au bout de quelques heures afin d’atteindre l’hémolymphe. Une fois dans l’hémolymphe, le champignon prolifère sous forme de petites cellules (blastospores) qui se transforment ensuite en hyphes. Ces hyphes se développent en utilisant des nutriments se trouvant dans l’hémolymphe jusqu’à la mort de l’hôte.
Une fois l’hôte mort, le champignon continue à croître à l’intérieur puis passe par sa dernière phase : la reproduction. Lorsque les conditions externes sont favorables, le champignon perce la cuticule et s’extrude. Il colonise la partie externe du cadavre d’une mousse blanche puis développe de nouvelles conidies qui permettront d’infecter de nouveaux hôtes. Une fois arrivées à maturation, ces nouvelles conidies sont de couleurs vertes, ce qui donne une teinte verdâtre au cadavre mycosé mais également donne le nom de cette maladie : la muscardine verte (Aw & Hue, 2017).
Les fourrageuses sont-elles capables individuellement de discriminer des proies infectées ?
Dans un premier temps nous avons étudié la capacité de discrimination des fourrageuses M. rubra face à deux proies dont l’une était infectée par le champignon entomopathogène. L’originalité de notre approche a été d’étudier les différents stades de développement du champignon et non de se focaliser uniquement sur la première étape qui est l’adhésion des conidies. De cette façon, nous avons pu observer les réactions comportementales des fourrageuses face à différents états sanitaires de proies pouvant être potentiellement rencontrées dans l’environnement. Comme nourriture appétente, nous avons utilisé des cadavres de mouches Drosophila melanogaster.
Plusieurs conditions ont été mises en place :
– 2 cadavres de mouche non infectés (Ctrl – ctrl)
– 1 cadavre non infecté et 1 couvert d’une faible concentration en conidies (Ctrl – LC)
– 1 cadavre non infecté avec 1 couvert d’une forte concentration en conidie (Ctrl-HC)
– 1 cadavre non infecté avec 1 tué par le champignon (Ctrl-Fkill)
– 1 cadavre non infecté avec 1 tué par le champignon et sporulant (Ctrl-Spo)
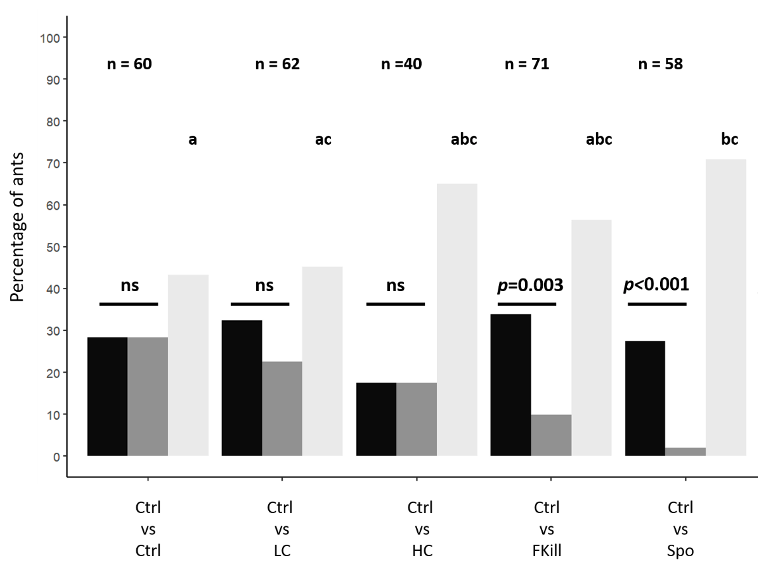
Nos résultats montrent que les fourrageuses sont individuellement capables de discriminer des proies non infectées de celles infectées, mais cela dépend du stade de développement du champignon. Les comportements d’évitement les plus prononcés sont retrouvés lorsque les proies sont sporulantes, avec quasi aucune fourrageuse n’ayant prélevé la proie infectée (1 sur 58) (Figure 4). Cet évitement est moins marqué lorsque la proie est récemment tuée par le champignon mais pas encore sporulante (environ 22% de prise). En revanche, les cadavres de proies simplement couvertes de conidies n’étaient pas discriminés des cadavres non infectés.
Le stade de développement du champignon semble donc être un élément important dans la détection et l’évitement du parasite. Plus le stade de développement du pathogène est avancé et plus on observe un évitement.
Nous avons donc mis en lumière un premier filtre sanitaire dès la récolte par les fourrageuses individuellement. Mais qu’en est-il du comportement de fourragement à l’échelle collective ?
Existe-il d’autres filtres avant la consommation ?
La décision de récolte par une fourrageuse est la première étape dans le processus de consommation de nourriture pour la colonie. Nous nous sommes demandé s’il existait d’autres filtres sanitaires en aval. Pour cela nous avons testé les différents stades de développement pour lesquels les fourrageuses étaient motivées à récolter les proies.
– Cadavres de mouches non infectés (ctrl)
– Cadavres de mouches couverts de conidies (LC)
– Mouches tuées par le champignon (mais pas encore sporulantes : Fkill)
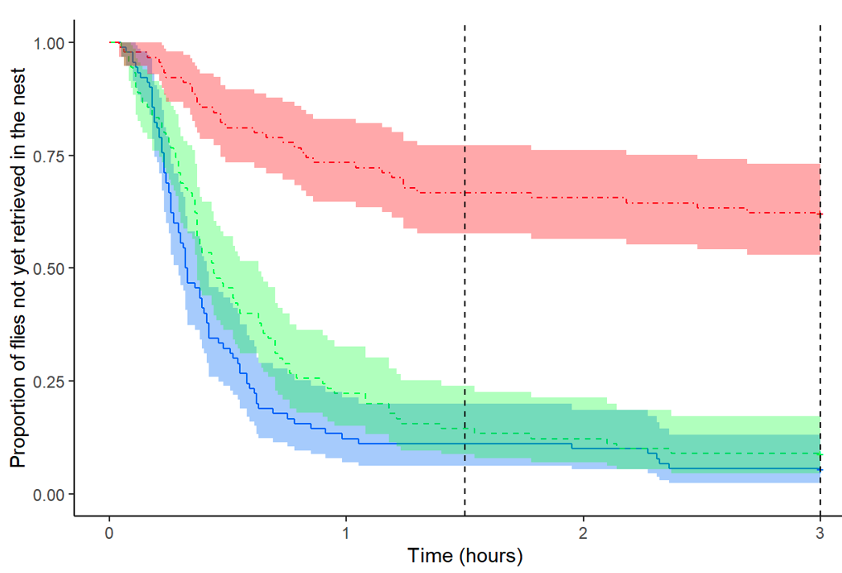
À l’échelle collective, la récolte de proie confirme nos résultats à l’échelle individuelle. Tandis que les proies non contaminées sont ramenées rapidement et en totalité par les fourrageuses, celles tuées par le champignon (Fkill) le sont peu avec seulement 40% de proies récoltées. Les cadavres de mouches couvertes de spores (LC) sont quant à elles ramenées au sein de la colonie même si la récolte est moins rapide que pour les proies non infectées (figure 5).
À l’intérieur du nid, nous avons observé un comportement appelé « extensive grooming » (ou acidopore grooming) pour la première fois chez le genre Myrmica (vidéo ci-dessous).
Durant ce toilettage, l’individu courbe son abdomen afin d’effectuer un contact bucco-anal, et ingère une petite quantité de liquide sortant de son aiguillon puis exécute un toilettage. Même si son rôle n’est pas parfaitement élucidé, il semble qu’il soit effectué dans le but d’ingérer des composés antimicrobiens permettant de nettoyer la zone buccale et le corps avant la consommation de nourriture. Ce comportement a déjà été relevé chez les genres Lasius et Formica (Tragust et al., 2020), Acromyrmex (Rodrigues et al., 2008), mais n’avait pas encore été décrit chez le genre Myrmica. Ce toilettage particulier, a été observé plus fréquemment au moment où la colonie est approvisionnée en nourriture par les fourrageuses et cet indépendamment de la qualité sanitaire.
De manière intéressante les proies ramenées ne sont pas toutes consommées, et notamment celles tuées par le champignon. Avec des analyses spatiales, nous avons mis en évidence un rejet de la majorité des proies tuées par le champignon par les individus internes. Les proies saines et couvertes de spores sont quant à elles consommées par les ouvrières.
Ce processus représente le deuxième filtre sanitaire à l’intérieur du nid avant de consommer la nourriture.
L’état sanitaire de l’environnement influence-t-il la prise de nourriture ?
Outre la nourriture elle-même, l’environnement peut également être source de contamination. Rechercher de la nourriture dans des zones chargées en pathogène peut s’avérer être couteux pour des colonies de fourmis. Nous nous sommes donc demandé si les fourrageuses étaient capables de discriminer des zones infectées de zones saines dans lesquelles se trouve la même récompense à savoir de la nourriture appétente (cadavres de mouches non infectés).
Nous avons donné la possibilité aux fourrageuses d’explorer et d’exploiter deux zones de fourragement contenant des cadavres de mouches non infectées, mais l’une des zones remplie d’items sporulants. Dans deux expériences complémentaires, l’une à l’échelle individuelle et l’autre à l’échelle collective, nous avons observé la propension à choisir l’une de ces deux sources, à y revenir et à récolter les proies.
À notre grande surprise, à l’échelle individuelle, les fourrageuses n’ont pas montré de préférence pour l’une des deux aires de fourragement, ni dans la récolte, ni dans leur choix de revenir sur la source (Figure 7). De plus, la présence d’items infectés dans l’environnement n’a pas influencé la fidélité des ouvrières à revenir vers la source préalablement visitée. En d’autres termes, les fourrageuses sont devenues fidèles à une source de nourriture au fil de leurs passages et ont exploité la source alimentaire indépendamment de la présence d’items sporulants dans l’environnement.
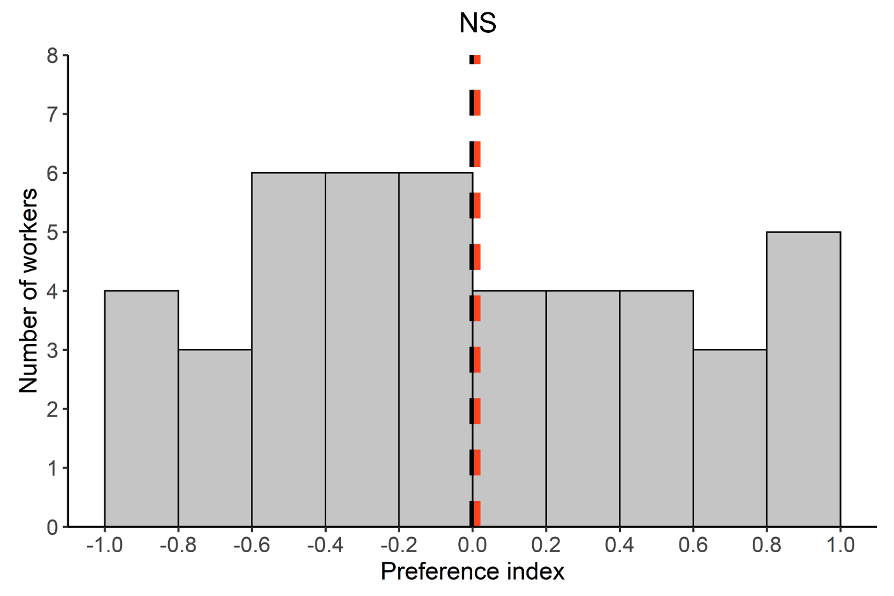
À l’échelle collective également, les colonies ne discriminent pas les sources selon l’état sanitaire de l’environnement. Les colonies ont donc exploité de manière équivalente et simultanée les deux sources, qu’importe si sur l’une d’entre elles se trouvent de nombreux items infectieux (Figure 8).
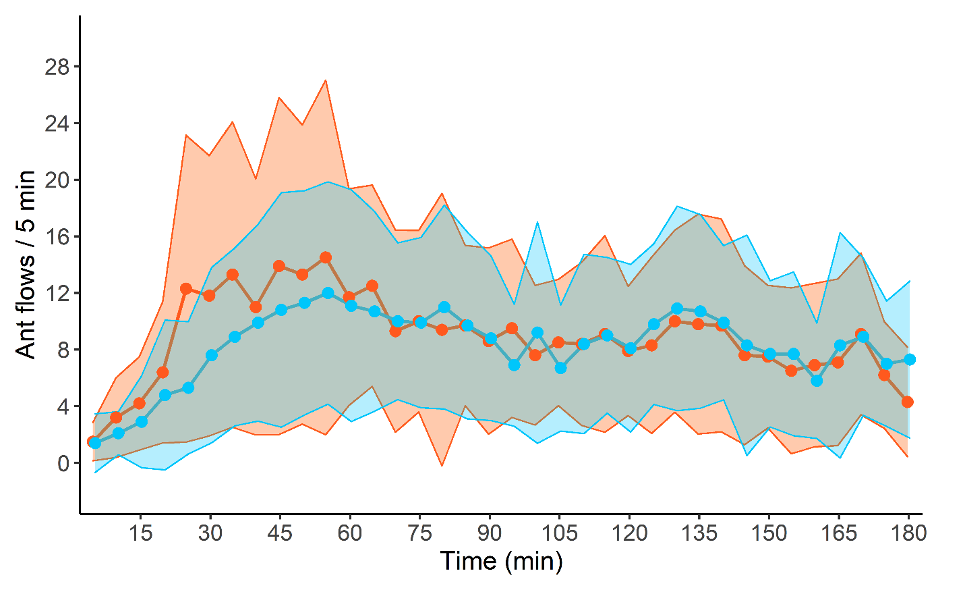
Cette absence d’évitement amène-t-elle à une forte mortalité au sein de la colonie ?
Contre toutes nos attentes, les colonies n’ont pas subi de mortalité à la suite de l’exploitation des ressources dans un environnement infecté. Pourtant, les fourmis revenant de la zone infectée étaient bien couvertes de conidies. Nous avons estimé à environ 30 000 le nombre de conidies par fourrageuse quittant la zone infectée. En infectant avec la même quantité de conidies, isolément la moitié des ouvrières succombent du champignon parasite. Cette différence de mortalité en contexte social et solitaire semble montrer les bénéfices de l’immunité sociale face à une menace pathogène.
En conclusion
Que peut-on donc en conclure ?
Pour résumer, la capacité de discrimination des colonies face à des sources de nourritures infectées dépend du stade de développement du champignon. En revanche, l’environnement ne semble pas jouer de rôle dans la prise de décision de récolte. Plusieurs filtres sanitaires sont mis en place avant la consommation de la nourriture et ce directement par les fourrageuses mais également à l’entrée du nid, où certaines proies infectées sont rejetées. Cependant ce filtre n’est pas strict chez Myrmica rubra, consommant des proies couvertes de spores, mais pas celles sporulantes ou tuées par le champignon. En d’autres termes, la cause de la mort de la proie semble jouer un rôle important dans la décision de consommation des proies.
Une fois ces informations obtenues, il serait intéressant de comprendre en détail les mécanismes de détections des ouvrières lorsqu’elles rencontrent des proies infectées et quels sont les processus mis en jeu.
Du point de vue évolutif, les réponses observées pourraient être dues à l’écologie de l’espèce et au caractère généraliste du champignon. En comparant les réponses exprimées par différentes espèces de fourmis face à de la nourriture contaminée par un champignon généraliste, il est probable qu’elles soient en adéquation avec le régime alimentaire. Les espèces charognardes, omnivores et carnivores semblent exprimer un évitement plus permissif face à de la nourriture contaminée par Metarhizium que des espèces granivores ou coupes-feuilles (également appelées champignonnistes) (Tranter et al., 2015). Une hypothèse avancée par Tranter et ses collaborateurs, est que cette différence serait due au fait que les espèces charognardes et omnivores consomment très rapidement leur nourriture à l’intérieur de la colonie tandis que les coupes-feuilles ou granivores constituent des stocks de nourriture durant plusieurs semaines. Une contamination de ce stock de nourriture pourrait théoriquement induire une menace pour la colonie. Ainsi, ces espèces constituant des stocks auraient évoluées vers des évitements plus stricts face à des sources contaminées par rapport à des espèces carnivores.
De plus, les espèces telles que M. rubra, évitant peu les proies contaminées (comme celles couvertes de spores) pourraient avoir d’autres mécanismes de défenses qui compensent une plus forte exposition aux pathogènes. On peut imaginer de meilleures défenses individuelles (cuticule, chimique, immunitaire) ou bien d’autres stratégies sanitaires qui n’ont pas été révélées ici.
L’extensive grooming décrit ici pour la première fois chez M. rubra pourrait également expliquer pourquoi les colonies récoltent et consomment des proies appétentes dont la cuticule est couverte de spores (vidéo ci-dessous). Chez d’autres genres de fourmis comme Lasius, Formica et Componotus, ce comportement (appelé acidopore grooming car elles possèdent un acidopore que Myrmica ne possède pas) a été montré comme permettant de se nettoyer et également d’ingérer des sécrétions acides qui agissent comme filtre antimicrobien durant la consommation de nourriture (Tragust et al., 2020). Ce comportement semble donc jouer un rôle prophylactique du type « se laver les mains avant manger » indépendamment de la qualité sanitaire. Une hypothèse serait que cet extensive grooming chez Myrmica participerait à inhiber le pouvoir pathogène des conidies. Hypothèse qu’il conviendra de vérifier par la suite.
Vidéo de comportements « extensive grooming » réalisés par des fourmis Myrmica
Du point de vue du pathogène, étant un champignon généraliste pouvant infecter de nombreuses autres espèces, la faible probabilité de reproduire un cycle à l’intérieur du nid ne semble pas être une forte contrainte évolutive. En effet, le champignon est susceptible de rencontrer dans l’environnement de nombreuses autres espèces d’insectes qui sont des hôtes potentiels. Ainsi le succès d’infection et de reproduction de champignons généralistes chez les insectes eusociaux n’est pas une nécessité comme certains champignons spécialistes tel que Ophiocordyceps qui ont développé des mécanismes de manipulation comportementale afin de compléter leur cycle (Hughes et al., 2016).
Les champignons généralistes semblent plus représenter une nuisance quotidienne pour les colonies de fourmis matures qu’une véritable menace sanitaire. Il est néanmoins important de préciser que les champignons généralistes restent une menace sanitaire pour des fondations ou de très petites colonies pour lesquelles composées de peu d’individus, l’action de l’immunité sociale serait limitée (Schmid-Hempel, 1998 ; Jaccoud et al., 1999 ; Loreto & Hughes, 2016).
En conclusion, les colonies de fourmis possèdent de nombreuses stratégies sanitaires permettant de limiter la prolifération de pathogènes, mais sont également capables de limiter les apports de nouvelles charges pathogènes. Comprendre les facteurs régissant l’immunité sociale nous donnerait un indice sur comment les insectes eusociaux ont pu se développer autant à travers le monde et faire face à une grande diversité de pathogènes.
Auteur Hugo a toujours désiré étudier le comportement des animaux. Après avoir effectué un premier Master portant sur l’éthologie (Comportement Animal et Humain) à l’Université Rennes 1 puis un deuxième sur les neurosciences (Neurosciences, Comportement, Cognition) à l’Université Paul Sabatier, Hugo a obtenu en mars 2021 son doctorat en biologie. Sa thèse a été réalisée au Service d’écologie sociale (USE, Université Libre de Bruxelles) sous la direction du professeur Claire Detrain et a porté sur les stratégies sanitaires chez la fourmi Myrmica rubra. Ses expériences professionnelles ont conforté son envie de continuer à étudier le comportement des insectes. Il vient d’être embauché en tant qu’entomologiste dans une entreprise privée. |
Bibliographie
- Angelone, S., & Bidochka, M. J. (2018) : Diversity and abundance of entomopathogenic fungi at ant colonies. Journal of invertebrate pathology, 156, 73-76 (lien)
- Cremer, S., Armitage, S. A., & Schmid-Hempel, P. (2007) : Social immunity. Current biology, 17(16), R693-R702 (lien)
- Cremer, S., Pull, C. D., & Fuerst, M. A. (2018) : Social immunity: emergence and evolution of colony-level disease protection. Annual Review of Entomology, 63, 105-123 (lien)
- Hughes, D. P., Araújo, J. P. M., Loreto, R. G., Quevillon, L., De Bekker, C., & Evans, H. C. (2016) : From so simple a beginning: the evolution of behavioral manipulation by fungi. Advances in genetics, 94, 437-469 (lien)
- Groden, E., Drummond, F. A., Garnas, J., & Franceour, A. (2005) : Distribution of an invasive ant, Myrmica rubra (Hymenoptera: Formicidae), in Maine. Journal of economic entomology, 98(6), 1774-1784 (lien)
- Hughes, W. O., Thomsen, L., Eilenberg, J., & Boomsma, J. J. (2004) : Diversity of entomopathogenic fungi near leaf-cutting ant nests in a neotropical forest, with particular reference to Metarhizium anisopliae var. anisopliae. Journal of Invertebrate Pathology, 85(1), 46-53 (lien)
- Jaccoud, D. B., Hughes, W. O. H., & Jackson, C. W. (1999) : The epizootiology of a Metarhizium infection in mini‐nests of the leaf‐cutting ant Atta sexdens rubropilosa. Entomologia Experimentalis et Applicata, 93(1), 51-61 (lien)
- Keller, S., Kessler, P., & Schweizer, C. (2003) : Distribution of insect pathogenic soil fungi in Switzerland with special reference to Beauveria brongniartii and Metharhizium anisopliae. BioControl, 48(3), 307-319 (lien)
- Loreto, R. G., & Hughes, D. P. (2016) : Disease in the society: infectious cadavers result in collapse of ant sub-colonies. PloS one, 11(8), e0160820 (lien)
- Masri, L., & Cremer, S. (2014) : Individual and social immunisation in insects. Trends in immunology, 35(10), 471-482 (lien)
- Rodrigues, A., Carletti, C. D., Bueno, O. C., & Pagnocca, F. C. (2008) : Leaf-cutting ant faecal fluid and mandibular gland secretion: effects on microfungi spore germination. Brazilian Journal of Microbiology, 39, 64-67 (lien)
- Schmid-Hempel, P. (1995) : Parasites and social insects. Apidologie, 26(3), 255-271 (lien)
- Stroeymeyt, N., Casillas-Pérez, B., & Cremer, S. (2014) : Organisational immunity in social insects. Current Opinion in Insect Science, 5, 1-15 (lien)
- Tragust, S., Herrmann, C., Häfner, J., Braasch, R., Tilgen, C., Hoock, M., … & Feldhaar, H. (2020) : Formicine ants swallow their highly acidic poison for gut microbial selection and control. Elife, 9, e60287 (lien)
- Tranter, C., LeFevre, L., Evison, S. E., & Hughes, W. O. (2015) : Threat detection: contextual recognition and response to parasites by ants. Behavioral Ecology, 26(2), 396-405 (lien)