Par Benoît GILLES
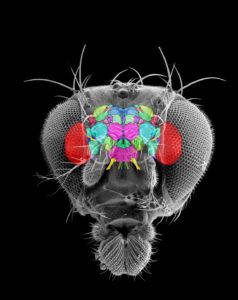
Que ce soit chez les arthropodes ou les vertébrés, le cerveau constitue le principal centre de contrôle de l’organisme. Chez les insectes, le cerveau reçoit des informations sensorielles (influx nerveux) provenant à la fois des organes des sens de la tête (vision, olfaction et goût par exemple) via les interneurones ascendants, et des ganglions plus postérieurs du thorax et de l’abdomen (voir article sur l’anatomie du système nerveux chez les insectes : lien). Bien que composé en grande partie des corps cellulaires d’interneurones et de fibres nerveuses, il comprend également les motoneurones (neurones moteurs) des muscles antennaires.
Certains de ces interneurones s’étendent le long du cordon nerveux, jusqu’aux ganglions les plus postérieurs (extrémité de l’abdomen), pour transmettre des informations comme celles en lien avec la coordination des mouvements du corps.
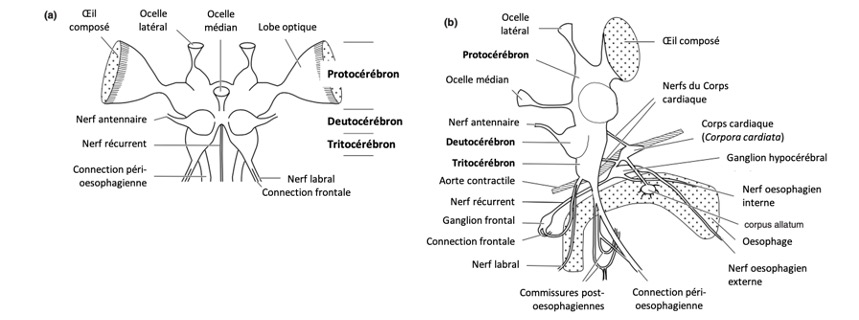
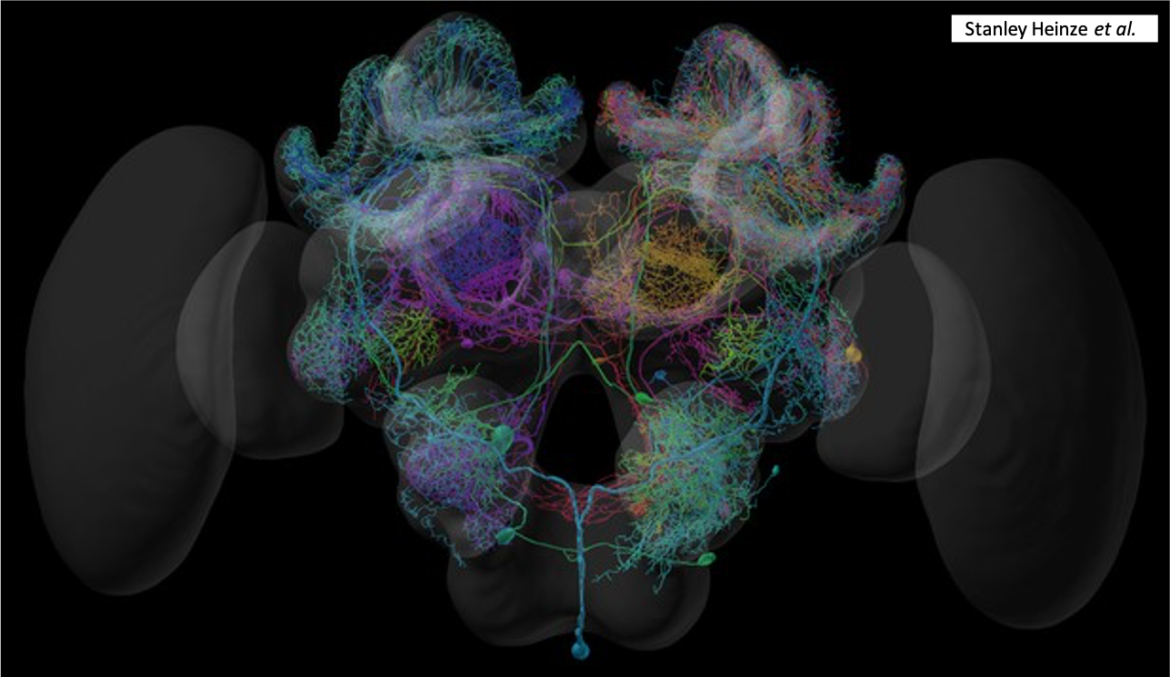
Le cerveau des insectes est subdivisé en trois régions : le protocérébron, le deutocérébron et le tritocérébron (figure 1).
Pour tout savoir sur le système nerveux périphérique des insectes : Le système nerveux des insectes
-
Protocérébron
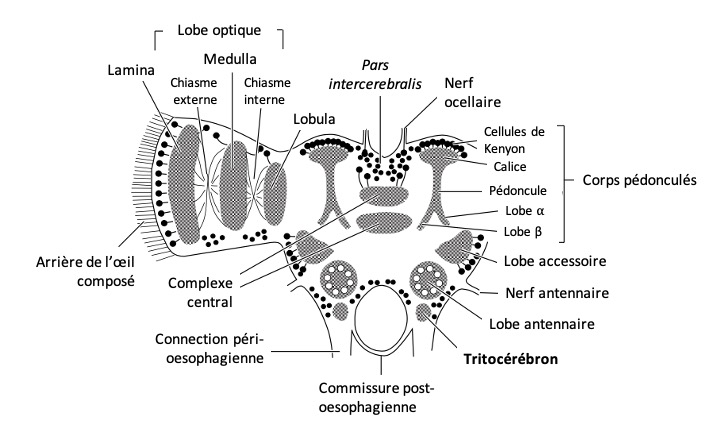
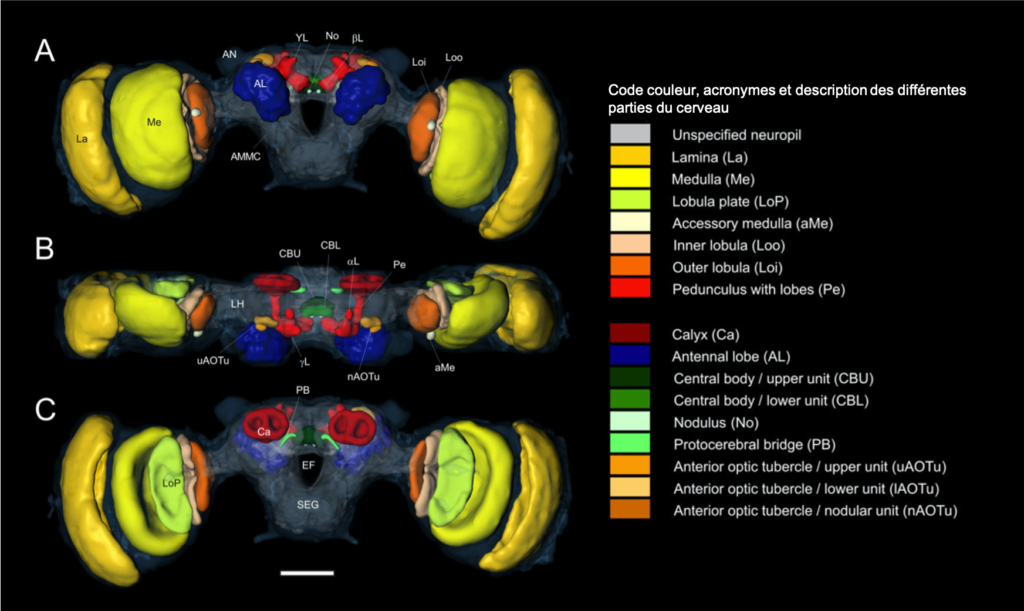
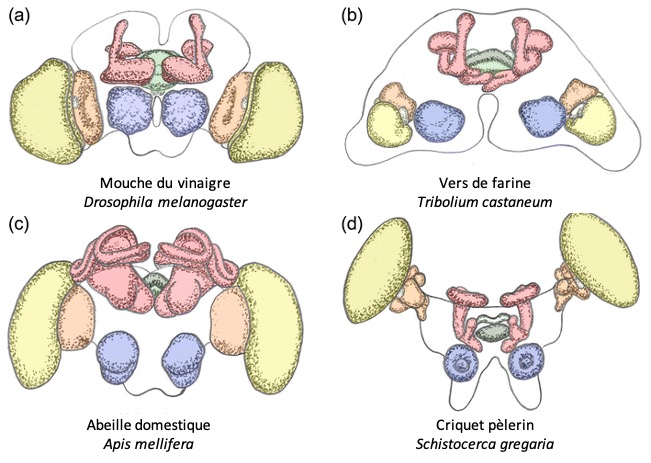
Le protocérébron constitue la partie la plus volumineuse du cerveau et la plus importante au plan fonctionnel. Situé dans la partie antérieure de la tête, de forme bilobée, il s’étend latéralement avec les lobes optiques (centres photorécepteurs des ocelles et des yeux composés – lien) et comprend les corps pédonculés et le complexe central, deux zones particulièrement développées chez les insectes sociaux (figures 2 et 3).
Le protocérébron joue un rôle primordial dans les sécrétions endocrines (molécules sécrétées directement dans l’hémolymphe), un rôle comparable à celui de l’hypothalamus chez les vertébrés. Les cellules neurosécrétrices, dont le nombre peut dépasser la centaine, sont le plus souvent regroupées dans un axe antéro-dorsal au niveau d’un système neuroendocrinien central appelé la « pars intercerebralis » (figures 2 et 3) (§ suivant). Cette région intervient notamment dans la régulation des cycles éveil-sommeil (neurones octopaminergiques).
D’autres cellules neurosécrétrices sont quant à elles reliées à un autre système de forme allongée : le corps cardiaque (également appelé : corpora cardiata ou corpus cardiacum) qui, comme l’indique ce nom, est accolé à l’aorte contractile située à l’arrière du cerveau (système assurant la circulation de l’hémolymphe). Le corps cardiaque influe à la fois sur la mue, la maturation ovocytaire, la pigmentation et les mouvements péristaltiques des tubes de Malpighi et du tube digestif au niveau du proctodeum (lien), ainsi que sur les hormones émises par les cellules neurosécrétrices de la pars intercerebralis .
-
Corps pédonculés
Situés de chaque côté de la pars intercerebralis (figures 2 et 3), les corps pédonculés, interviennent dans l’intégration des signaux sensoriels comme l’apprentissage, la mémoire ou la discrimination olfactive.
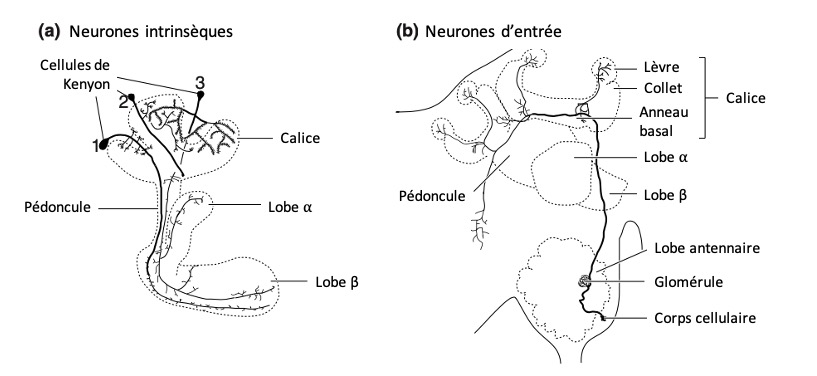
Chacun d’eux est constitué d’un calice dans sa partie antérieure à partir duquel s’étend ventralement un pédoncule se divisant en deux lobes, parfois trois, appelés α, β, et γ (figures 2 et 4a). La terminologie peut prêter à confusion puisque les deux lobes principaux sont parfois dits lobes ventral et médian selon leur orientation.
Le calice, pouvant être simple ou double, se subdivise en 3 sous-unités (neuropiles) connus sous le nom de lèvre, collet et anneau basal (figure 4b).
Regroupant les neurones olfactifs, les calices sont doubles chez des espèces à l’odorat développé comme les abeilles Apis et les blattes Periplaneta, et simples, voire absents, chez des espèces où l’olfaction joue au contraire un rôle mineur comme chez les libellules et les cigales.
Chose étonnante, le calice est chez certaines espèces associé à la gustation et est de petite taille.
Les relations du calice avec l’olfaction étant présentes chez la plupart des taxons, il est suggéré qu’il s’agisse d’un caractère ancestral (plésiomorphie). Ces relations et l’organisation de l’innervation du calice sont toutefois fortement soumises à l’influence de l’environnement et des comportements des espèces avec des spécialisations évolutives uniques. Par exemple, les punaises de la famille des Notonectidae, de par leur mode de vie subaquatique, possèdent des antennes et des lobes antennaires atrophiés.
La taille relative des corps pédonculés est corrélée à la complexité du comportement des insectes : petits chez les collemboles (lien), les Hétéroptères, les Diptères et les Odonates, de taille moyenne chez les Coléoptères, les Orthoptères, les Blattodae, les Lépidoptères et les Tenthrèdes (Hyménoptères symphytes), et plus développés chez les insectes sociaux (figure 5a). Par exemple, chez les abeilles et guêpes sociales dont les comportements de chasse reposent en grande partie sur l’acuité visuelle (informations visuelles provenant des lobes optiques), les calices sont imposants ce qui est probablement lié au rôle important que joue la vision dans l’apprentissage de zones d’alimentation, des sites de nidification et même dans l’identification des congénères de la colonie.
Les espèces de Coléoptères phytophages généralistes (plusieurs types de plantes hôtes) possèdent par exemple des pédoncules de taille supérieure à celles ayant des régimes plus spécialisés. Les criquets pèlerins en phase grégaire, ayant des régimes alimentaires diversifiés et des interactions sociales complexes, ont également des corps pédonculés plus volumineux que les criquets en phase solitaire. Chez les termites, où le volume du pédoncule et des lobes a et b est important, le calice ne représente qu’environ un tiers du volume total des corps pédonculés. Chez les abeilles et les guêpes sociales, il représente près 70% du volume des corps pédonculés.
La partie antérieure des corps pédonculés regroupe un grand nombre d’interneurones, les cellules de Kenyon. Bien qu’il ait été inventorié une diversité morphologique et fonctionnelle de ces cellules entre les taxons, la structure type d’une cellule de Kenyon demeure stable entre les taxons. Elles sont constituées d’un corps cellulaire situé au-dessus du calice, de dendrites (prolongements ramifiés des neurones) s’insérant dans le calice, d’un axone courant le long du pédoncule se ramifiant ventralement dans les lobes α et β (figure 4a).
Les abeilles ouvrières possèdent environ 170 000 cellules de Kenyon dans chaque pédoncule, représentant 40% de tous les neurones du cerveau ; la mouche Calliphora possède quant à elle environ 21 000 cellules de Kenyon dans chaque pédoncule, soit environ 12% de la totalité de ces neurones.
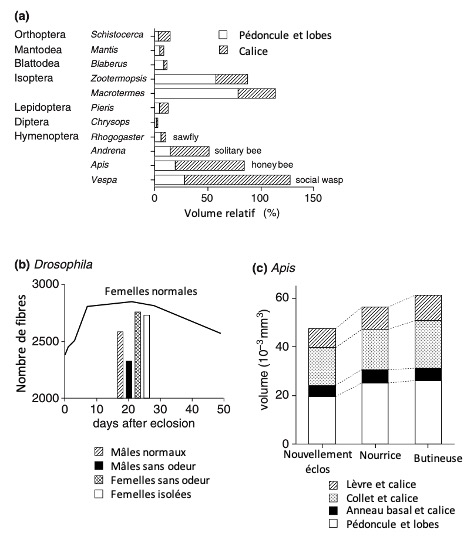
Il a été démontré que des changements se produisaient dans les corps pédonculés avec l’âge et l’expérience. Chez la drosophile par exemple, le volume des corps pédonculés augmente de plus de 20% durant la première semaine de la vie d’adulte (figure 5b), un phénomène également observé durant les dix premiers jours de la vie des abeilles ouvrières (figure 5c). Bien que certaines espèces de grillons et de Coléoptères aient la capacité de produire de nouvelles cellules de Kenyon au cours de leur vie d’adulte, cette faculté disparaît chez d’autres lorsque l’insecte atteint l’âge adulte ou durant le stade nymphal.
L’augmentation du volume corporel des corps pédonculés résulte de l’augmentation du nombre de fibres mais aussi de l’expérience vécue par l’insecte. Chez la drosophile et l’abeille Apis, par exemple, le nombre de fibres présents dans les pédoncules augmente davantage chez les individus ayant des contacts avec leurs congénères que chez des individus isolés. De la même manière, chez les abeilles ouvrières, les corps pédonculés sont plus imposants chez celles qui butinent que chez les nourrices du même âge (figures 5b et 5c).
Les corps pédonculés sont impliqués dans l’apprentissage olfactif et l’apprentissage visuel chez certains insectes. Des études suggèrent qu’ils pourraient intervenir dans certains processus de prise de décision. Des drosophiles mutantes présentant des malformations au niveau des corps pédonculés ont montré un comportement globalement normal mais avec une incapacité à apprendre certains types d’associations ou des comportements stéréotypés et certaines difficultés à répondre aux nouvelles conditions.
- Complexe central
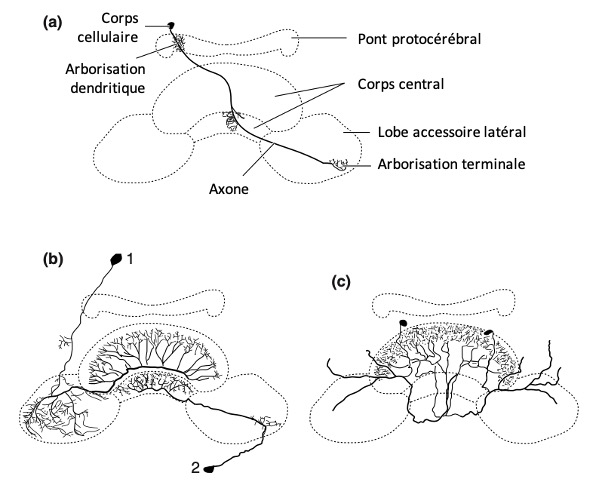
Le complexe central est une zone riche en interneurones où se rencontrent quatre neuropiles formant 16 colonnes (8 de chaque côté du cerveau) de neurones empilés en couches distinctes (figures 6a, b et c).
Les fonctions possibles du complexe central se précisent lentement. Bien que les neurones le composant aient été identifiés comme répondants aux stimuli mécanosensoriels, visuels et chimiques, et comme déclenchant des schémas comportementaux (neurones moteurs), le cheminement de l’information entrant et sortant du complexe central est encore loin d’être entièrement établi. Le rôle le plus caractérisé du complexe central serait le traitement des informations visuelles de la région du bord dorsal de l’œil composé qui est sensible à la lumière polarisée.
Les insectes utilisent le plan de polarisation du ciel (lien) (plan variant au cours de la journée en fonction de la position du soleil) pour s’orienter et se repérer dans l’espace même par temps nuageux. Ces informations visuelles permettent à l’insecte de disposer d’une sorte de boussole céleste.
Il est également admis que le complexe central intervient dans la surveillance et l’organisation des schémas comportementaux en lien avec la locomotion. Des enregistrements de l’activité électrique des neurones de cette zone chez des cafards, à l’aide de réseaux multi-électrodes, ont montré que leur activité était corrélée au rythme de la marche et que, dans de nombreux cas, le changement d’activité des neurones précédait le changement de comportement. De plus, la stimulation électrique de ces neurones à travers les électrodes pouvait modifier les habitudes de marche. D’autres travaux, dont plusieurs études utilisant des mutants de drosophiles, ont suggéré un rôle général du complexe central dans l’intégration sensorielle motrice (propriorécepteurs) en particulier en relation avec la position du corps et différentes régions du corps par rapport à l’espace extérieur.
-
Lobes optiques
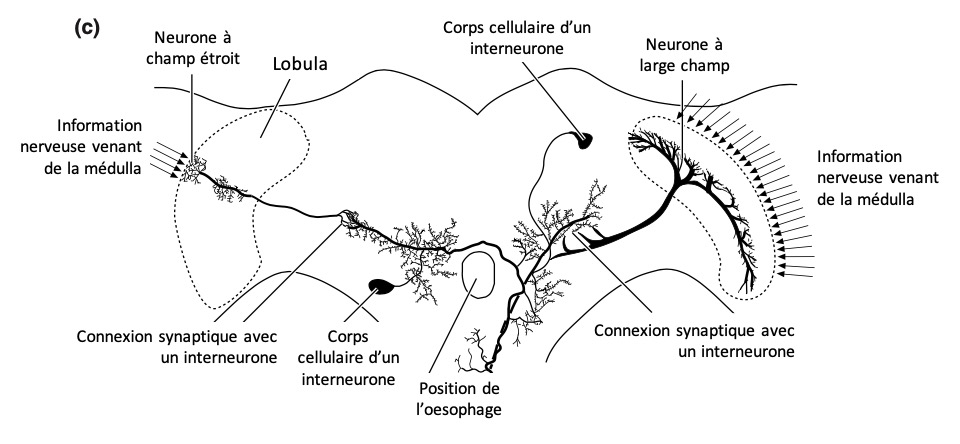
Les lobes optiques forment des extensions latérales reliant le protocérébron et les yeux composés. Chacun d’eux est constitué de trois neuropiles successifs (figures 2 et 3), connus sous le nom de : lamina, medulla et lobula.
Les arrangements structuraux en couches des neurones offrent un fort degré de rétinotopie, c’est-à-dire que la représentation précise de toute image arrivant sur l’œil (cellules photoréceptrices) est conservée à mesure que le traitement de l’information nerveuse progresse de la lamina au lobula. De manière étonnante, les fibres se croisent horizontalement entre les neuropiles successifs, formant des chiasmes optiques externe et interne. Cette configuration nerveuse entraine des inversions successives de la carte neurale de l’image visuelle le long de l’axe antéro-postérieur (figures 2, 3 et 7).
-
Deutocérébron
Le deutocérébron, essentiellement associé aux antennes, est constitué de deux lobes antennaires regroupant à la fois les neurones du système olfactif (chémorécepteurs) et ceux des centres mécanosensoriels et moteurs (figures 1 et 2).
Ces régions, relativement mal définies, contiennent les arborisations terminales des neurones mécanosensoriels provenant du scape et du pédicelle, voire également du flagelle, de l’antenne ainsi que les arborisations dendritiques des motoneurones contrôlant les muscles antennaires.
La détection des sources de nourriture, des sites de pontes et des partenaires sexuels repose en grande partie sur la chimioréception, le contact, l’olfaction ou la gustation (lien). La répartition sur les antennes et les pièces buccales des récepteurs olfactifs, gustatifs et de contact est spécifique à chaque espèce.
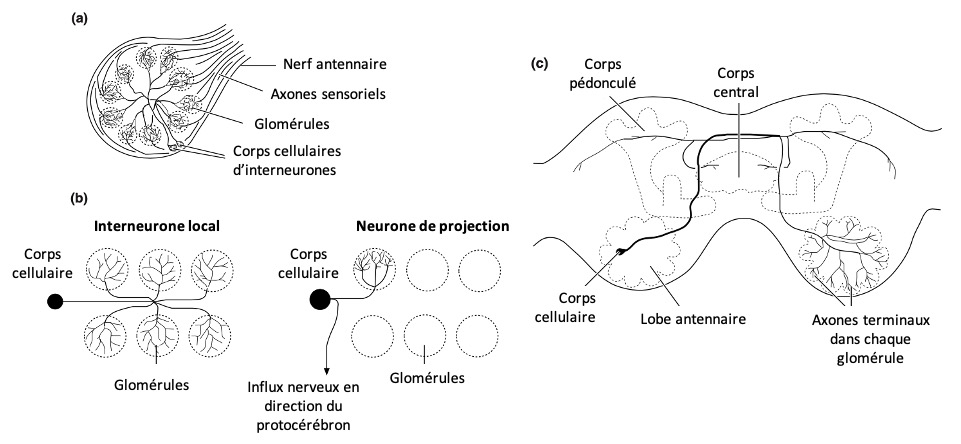
Les lobes antennaires, constituées de neuropiles synaptiques denses, sont appelés glomérules, leur nombre variant considérablement d’une espèce à l’autre (figure 8a). Par exemple, la blatte Periplaneta en compte 125, le papillon Sphingidae du genre Manduca environ 64 et le moustique Aedes moins de 10.
De manière générale, les axones des sensilles olfactives des antenne se terminent dans les glomérules, où chacun d’eux n’est relié qu’à un seul glomérule (figure 8b). Chez les criquets, possèdant plus de 1 000 glomérules mal définis, chaque axone innerve a contrario plusieurs glomérules.
Au sein d’une même espèce, les glomérules semblent conserver une forme et une position constantes. Les mâles d’espèces détectant leurs partenaires sexuelles à l’aide des phéromones émises par les femelles possèdent cependant deux ou trois glomérules de plus grande taille, formant le complexe macroglomérulaire.
L’ensemble des informations nerveuses provenant des chémorécepteurs antennaires exprimant les mêmes protéines réceptrices olfactives convergent vers un même glomérule, se connectent au niveau des synapses (zone de contact entre deux neurones) avec des interneurones (neurones de projection) puis transmettent l’information aux calices des corps pédonculés et à des zones spécifiques du protocerebrum (figures 4b, 8b).
Les cellules chimioréceptrices des antennes ne s’activant qu’en présence d’un composé volatile (COV : composé organique volatil) en lien avec l’écologie de l’espèce (phéromone sexuelle par exemple) ou d’un mélange de composés spécifiques (sources alimentaires par exemple), cela permet de créer une transmission linéaire et directe avec le glomérule où les informations sont véhiculées sans aucune ambiguïté. En effet, le nombre relativement important de glomérules et d’interneurones permet aux insectes de distinguer un large panel d’odeurs.
Des neurones de projection réagissent toutefois lorsque l’antenne est exposée à une large gamme d’odeurs fournissant ainsi à l’insecte des informations générales sur son environnement.
On retrouve également dans les lobes antennaires une deuxième population d’interneurones : les neurones locaux. Contrairement aux neurones de projection, ces neurones s’interconnectent à plusieurs glomérules (figure 8b). Ils diffèrent également considérablement des neurones de projection par leur morphologie, leurs schémas de connectivité, leur physiologie et leurs neurotransmetteurs. Les abeilles possèdent par exemple environ 4 000 interneurones locaux dans chaque lobe antennaire.
Les interneurones locaux interviennent dans des voies nerveuses soit inhibitrice, soit excitatrice. Les neurones locaux inhibiteurs sécrètent des neurotransmetteurs comme l’acide aminobutyrique (GABA) et l’histamine, les excitateurs l’acétylcholine.
Il a été mis en évidence que des interneurones des lobes antennaires rejoignaient d’autres zones du cerveau. Ces interneurones synthétisent plusieurs types de neurotransmetteurs comme la sérotonine (neurone sérotoninergique), la dopamine, l’octopamine et/ou des peptides dont les profils (proportions et nombre de molécules) diffèrent considérablement selon les espèces d’insectes. Il semblerait que ces interneurones interviennent dans l’association des odeurs à des qualités gustatives appétissantes ou aversives (figure 7c).
-
Tritocérébron
Le tritocérébron, situé sous le deutocérébron, est à la fois la plus petite région du cerveau et la moins étudiée. Il est relié au ganglion sous-oesophagien par une paire de lobes enserrant le tube digestif et interconnectés par une commissure post-oesophagienne parfois peu visible (figure 2). Dans sa partie antérieure, le tritocérébron reçoit les informations nerveuses provenant des neurones sensoriels et moteurs du labrum et des pièces buccales (lien).
Comme le deutocérébron, le tritocérébron donne naissance à des neurones descendants vers les ganglions thoraciques et abdominaux. Bien qu’une certaine architecture générale ait pu être décrite, peu de choses sont connues quant à ses relations avec les autres régions du cerveau ou quant à ses connexions intrinsèques.
Illustration 3D du système nerveux d’une abeille (Source : Eric Keller – Bioopatone)
Pour tout savoir sur le système nerveux périphérique des insectes : Le système nerveux des insectes
Bibliographie
- The Insects: Structure and Function
(R.F. Chapman & Stephen J. Simpson – Edition : Cambridge University Press – 959 pages – 5ème édition : 12 novembre 2012)
- El Jundi B. ; Huetteroth W. ; Kurylas A.E. & Schachtner J. (2009) : Anisometric brain dimorphism revisited : implementation of a volumetric 3D standard brain in Manduca sexta. The Journal of Comparative Neurology, 517,2,210-225 (lien)
- Fahrbach S.E. (2006) : Structure of the mushroom bodies of the insect brain. Annu. Rev. Entomologiste. 51:209-32 (lien)
- Koniszewski N.D.B. et al. (2016) : The insect central complex as model for heterochronic brain development – background, concepts and tools. Development Genes and Evolution, 226, 209-219 (lien)
- Pfeiffer K. & Homberg U. (2014) : Organization and functional roles of the central complex in the insect brain. Annual review of entomology. 59:165-184 (lien)


Super article, sujet passionnant !
Une toute petite coquille dans la première phrase (« les vertébréS), mais ça n’enlève en rien de la qualité de l’article 😉