Par Emmanuelle Clervil, Emeline Houël, Isabelle Dusfour & Jean-Bernard Duchemin
L’Amazonie : une terre de conquête
L’Amazonie est réputée et admirée pour son immense biodiversité, mais celle-ci présente également ses revers. Si la biodiversité végétale est a priori la plus visible, les insectes et pathogènes n’ont rien à envier aux plantes en termes d’abondance et de diversité. De nombreuses espèces d’insectes sont cependant responsables de la transmission de maladies infectieuses bien connues comme le paludisme, transmis par les moustiques du genre Anopheles, ou de maladies tropicales négligées telles que la leishmaniose, ayant pour vecteur les phlébotomes du genre Lutzomyia (pour le Nouveau Monde), ou la maladie de Chagas, transmise par la piqûre de punaises hématophages de la sous-famille des Triatominae. Au côté de ces parasitoses figurent également les maladies infectieuses d’origine arbovirale à transmission vectorielle, dont les moustiques du genre Aedes sont notamment d’excellents vecteurs.
Le moustique Aedes aegypti est en particulier considéré comme l’un des vecteurs les plus importants, responsable de la transmission de la fièvre jaune, de la dengue, du chikungunya et plus récemment du virus Zika, dont les conséquences humaines en termes de morbidité et mortalité restent très élevées en particulier dans la zone sud-américaine.
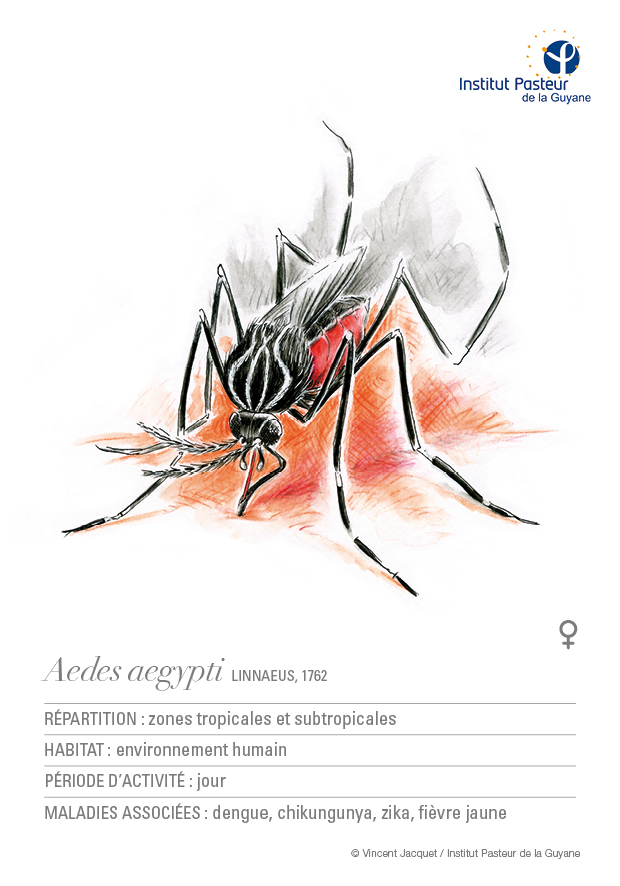
Cette espèce (Illustration 1) de moustique d’origine africaine, a a priori colonisé les Amériques durant la période de l’esclavage à partir du XVIIe siècle. Elle est aujourd’hui bien établie dans toutes les régions tropicales et subtropicales (Powell & Tabachnick, 2013). Inféodée aux zones urbaines, cette espèce domestique est préférentiellement diurne et fortement anthropophile (les femelles, hématophages, piquent volontiers les humains). Elle se reproduit surtout dans les gîtes créés par l’homme, c’est-à-dire dans tout récipient susceptible de contenir de l’eau stagnante (Simmons et al., 2012). De nombreux facteurs aussi bien biologiques (grande capacité d’adaptation d’Ae. aegypti, œufs résistants à la dessiccation), climatiques (températures adéquates, existence d’une saison des pluies favorable au maintien des gîtes larvaires) qu’humains (mosaïque culturelle et linguistique, limitation de l’accès aux soins, urbanisation chaotique, manque d’infrastructures, problème de collecte de déchets) favorisent le développement des moustiques et compliquent la mise en place de mesures de prévention dans de nombreuses régions d’Amazonie (Abilio et al., 2018 ; Carvalho & Moreira, 2017).
Parmi ces régions se trouve la Guyane, territoire français d’Amazonie situé au Nord-Ouest du continent sud-américain entre le Surinam et le Brésil, et recouvert à plus de 90% de forêt tropicale humide.
La lutte contre Aedes aegypti : une longue histoire
De par sa situation géographique et administrative, la Guyane se retrouve au carrefour des problématiques locales et régionales (Amazonie et plateau des Guyanes) et des réglementations françaises et européennes en termes de santé publique et de lutte insecticide. En l’absence de vaccin ou de traitement contre la plupart des arboviroses citées plus haut (sauf la fièvre jaune), le contrôle des moustiques vecteurs, et donc notamment d’Ae. aegypti, est une priorité de santé publique afin de limiter le nombre et l’impact de ces épidémies.

Depuis les années 40, les stratégies de lutte anti-vectorielle se succèdent sur ce territoire (Epelboin et al., 2018). Si une première campagne d’éradication du paludisme et de la fièvre jaune fut couronnée de succès par l’élimination des vecteurs Anopheles sp. et Ae. aegypti grâce à un large usage du DDT (photo 1) vis-à-vis des moustiques adultes de la bande littorale, les limites de cette stratégie furent atteintes au début des années 60 avec la réapparition de populations d’Ae. aegypti résistantes au DDT, puis à la dieldrine utilisée en remplacement. En 1991 et après l’interdiction du DDT, la deltaméthrine fût introduite en Guyane pour la lutte adulticide.
Dans les années 90 et 2000 des organophosphorés tels que le malathion ou le fénithrotion ont pu également être utilisés en pulvérisation en parallèle ou remplacement de la deltaméthrine. Du fait du danger pour la santé humaine lié à l’utilisation d’insecticides organophosphorés, cette molécule de la classe des pyréthrinoïdes est devenue en 2011 le seul composé autorisé par l’Union Européenne et disponible pour le traitement adulticide par pulvérisation. Cependant, et après les résistances observées chez Ae. aegypti vis-à-vis des organochlorés et certains organophosphorés, une forte résistance à la deltaméthrine, seul composé donc actuellement autorisé par l’Union Européenne et disponible pour le traitement adulticide par pulvérisations, a été enregistrée au laboratoire de l’Institut Pasteur de la Guyane pour les populations locales d’Ae. aegypti (Dusfour et al., 2011) et confirmée par des études successives (Dusfour et al. 2015, Faucon et al. 2015, 2017).
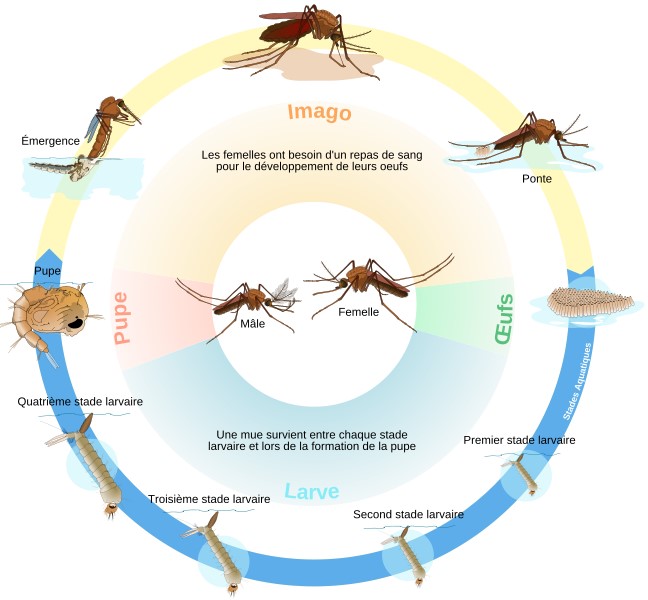
Cependant la lutte anti-vectorielle peut cibler les deux stades de vie du moustique : le stade larvaire, aquatique, et le stade adulte (Illustration 2 ci-dessous). La lutte larvicide, peu utilisée encore dans les années 50 en Guyane malgré quelques essais aussi bien en termes de lutte biologique, mécanique ou chimique, fut caractérisée par quelques tentatives de développement entre les années 60 et 90, par utilisation occasionnelle de DDT ou d’insecticide organophosphoré (téméphos, naled, fenthion et fenitrothion). Cependant, la lutte adulticide est toujours demeurée la première ligne de contrôle des vecteurs jusqu’à l’introduction dans les années 90 de formulations d’origine naturelle en granulés de Bacillus thuringiensis var. israelensis, ou Bti.
Si des traitements complémentaires des gîtes larvaires au téméphos ont pu être réalisés jusqu’en 2009, date d’interdiction d’utilisation des organophosphorés en tant que larvicide, le Bti est désormais la seule substance autorisée en France sauf dérogations locales ou ponctuelles, et donc en Guyane, pour le traitement des gîtes larvaires. Aucune résistance au Bti n’existe actuellement. Cependant, ce produit possède une faible rémanence dans l’environnement (15 jours à 2 mois en fonction de la charge en matière organique, l’exposition aux UV…), limitant son action dans le temps et ne permettant donc pas de prévoir de façon fiable sa durée d’action. La première ligne d’action en Guyane pour la lutte larvicide reste donc la prévention et l’éducation, en vue de maintenir efficacement la surveillance et la suppression mécanique des gîtes larvaires.
Dans un contexte épidémiologique et législatif en évolution constante, et incluant le développement des résistances, il est donc crucial de découvrir de nouvelles alternatives aux composés actuellement utilisés pour la lutte anti-vectorielle, en particulier dans le cadre d’une démarche plus durable et éco-responsable. Si le milieu tropical fournit un écosystème très favorable au bon développement des vecteurs et des pathogènes, et ainsi qu’à leurs interactions mutuelles et avec leurs hôtes, il pourrait également être une source de solutions à ces problèmes, en offrant des opportunités de découverte de nouveaux insecticides d’origine végétale (Benelli, 2015 ; Benelli & Mehlhorn, 2016).
Cycle biologique du moustique
Des plantes au secours de la lutte contre les moustiques
Les plantes sont en effet depuis longtemps une source d’inspiration pour la recherche de produits insecticides (Miresmailli & Isman, 2014), étant en interaction constante et dynamique avec les herbivores, notamment arthropodes, et développant ainsi des défenses chimiques complexes et spécifiques (Fine et al., 2013 ; Gaston, 2000 ; Novotny et al., 2006). De ce fait, les plantes constituent une source durable de composés chimiques à activité insecticide pouvant être utilisés en tant qu’approche complémentaire ou substitutive aux insecticides de synthèse.
Plus de 2000 espèces végétales douées de propriétés insecticides ont ainsi pu être cataloguées (George et al., 2014). L’intérêt porté aux insecticides végétaux a surtout été supporté par les nombreux avantages écologiques qui émanent de leurs utilisations, tel que leur caractère biodégradable.
Ils présentent aussi une spécificité d’action liée à la sélectivité des métabolites, qui leur permet une action ciblée et à faible dose sur l’organisme visé. Ils sont également connus pour leur faible toxicité vis-à-vis des organismes non cibles, notamment les mammifères. Enfin, leurs mécanismes d’actions sont variés étant donné qu’ils sont issus de familles chimiques diverses, ce qui peut retarder ou limiter l’apparition de résistance chez les insectes (Regnault-Roger et al., 2008).
Dans le cadre de ces problématiques aussi bien globales que locales, des équipes de chercheurs de Guyane se sont associées pour la réalisation d’un projet financé par l’Union Européenne (PO-FEDER), la Collectivité Territoriale de Guyane, la Fondation Air Liquide et le Labex CEBA, et porté par le CNRS / UMR EcoFoG (Unité Mixte de Recherche Ecologie des Forêts de Guyane), en étroite association avec le laboratoire d’entomologie médicale (maintenant Vectopôle Amazonien Emile Abonnenc) de l’Institut Pasteur de la Guyane (Illustration 3).
Ce projet, intitulé « Insecticides : étude de la chimiodiversité en Amazonie guyanaise pour la recherche d’insecticides naturels », visait à mettre en évidence de nouvelles espèces végétales à potentiel insecticide, en particulier vis-à-vis du moustique Ae. aegypti, en s’inspirant des mécanismes de défense chimique mis en place dans le cadre des interactions plantes-insectes. L’objectif était également de voir si les activités mesurées pourraient être liées à des paramètres biotiques ou abiotiques (organe de la plante, ressources disponibles, type de végétation…) influant sur les défenses chimiques.

Nous avons évalué dans le cadre de ce projet l’activité vis-à-vis des larves d’Ae. aegypti de plus de 450 extraits obtenus à partir de 160 parties de plantes issues de 87 espèces collectées en Guyane dans des biotopes. Deux lignées d’Aedes aegypti ont été utilisées dans cette étude : une souche de laboratoire sensible à tous les insecticides, ainsi qu’une population naturelle résistante aux insecticides (pyréthrinoïdes et organophosphorés) collectée à Cayenne et utilisée pour évaluer l’activité des extraits les plus actifs.
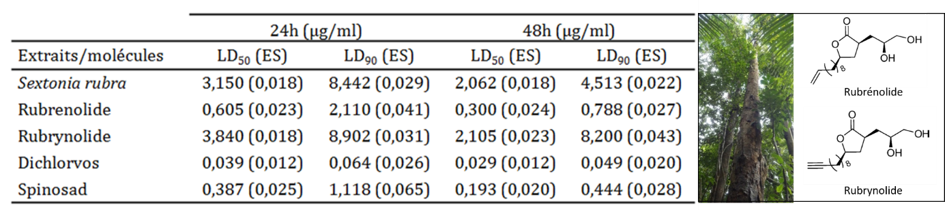
Huit espèces végétales (Maytenus oblongata Reissek, Celastraceae; Costus erythrothyrsus Loes., Costaceae; Humiria balsamifera Aubl., Humiriaceae; Sextonia rubra (Mez) van der Werff, Lauraceae; Piper hispidum Sw., Piperaceae ; Laetia procera (Poepp.) Eichl., Salicaceae; Matayba arborescens (Aubl.) Radlk., Sapindaceae et Cupania scrobitulata Rich., Sapindaceae) ont conduit à l’obtention d’extraits présentant une mortalité larvaire supérieure à 50% après 48h d’exposition à 100 µg/mL contre la population naturelle (Falkowski et al., 2020).
Sextonia rubra : un candidat au fort potentiel

Au travers de ce criblage, trois résultats majeurs ont été obtenus. Tout d’abord, l’analyse statistique multivariée de l’ensemble du jeu de données ainsi que l’observation des résultats obtenus a permis de mettre en évidence que la prise en compte des mécanismes de chimie défensive des plantes – leur « écologie » dans le milieu naturel – est déterminante lors de la recherche de nouveaux produits insecticides.
Ensuite, nous avons, grâce à ces travaux, souligné l’importance de prendre en compte non seulement l’activité insecticide du produit testé, mais également sa toxicité vis-à-vis de cellules humaines ou d’organismes non cibles, c’est-à-dire d’évaluer la sélectivité du produit. Enfin, nous avons en particulier mis en évidence l’excellente activité larvicide de l’extrait de bois et de ses constituants chimiques de l’espèce forestière amazonienne Sextonia rubra (Mez.) Van der Werff (Lauraceae) (photo 2 ci-contre).
En Guyane, cet arbre connu sous le nom de grignon franc est largement exploité en menuiserie du fait de sa remarquable durabilité naturelle. Le mécanisme expliquant cette excellente résistance aux agressions pathogènes (termites et champignons lignivores) a en partie été élucidé grâce à la découverte des propriétés anti-termites et antifongiques du rubrénolide et du rubrynolide, deux molécules isolées du bois de cœur de cette espèce (Rodrigues et al., 2010 ; Rodrigues et al., 2011 ; Houël et al., 2017).
Lors de nos travaux, les propriétés biologiques des extraits de bois de S. rubra ont été étudiées sur les larves du moustique Ae. aegypti. Il a par exemple été mis en évidence sur une souche de laboratoire sensible à tous les insecticides de référence une activité du rubrénolide comparable à celle du spinosad, un insecticide d’origine bactérienne. Un brevet a ainsi pu être déposé à l’issue de ces travaux (Falkowski et al., 2016), porté en copropriété entre les instituts de recherche, les universités et l’agence régionale de développement et d’innovation en Guyane (GDI), dans l’objectif d’assurer un retour au territoire en cas de valorisation industrielle des résultats obtenus (Figure 1).
Vers un nouvel insecticide d’origine végétal…
Ce travail a conduit à l’élaboration d’un nouveau projet financé par l’Union Européenne (PO-FEDER), actuellement en cours, et intitulé « SextoniAEDES : Valorisation des molécules issues des déchets de bois de Sextonia rubra pour la formulation de produits larvicides vis-à-vis du moustique Aedes aegypti : efficacité et sélectivité ».
De façon générale, ce projet s’inscrit dans une démarche intégrative et une volonté de développer des solutions issues des bioressources endogènes pour répondre à des problématiques locales. Bien que se caractérisant par une exploitation raisonnée de la ressource, l’industrie forestière guyanaise génère en effet de grands volumes de déchets (plus de 50% de la matière ligneuse perdue entre l’abattage et le sciage), convertis uniquement à ce jour en énergie, et qui pourraient être valorisés dans des domaines d’intérêt pour la population.
En approfondissant les connaissances sur l’activité larvicide de l’extrait de bois de S. rubra, une des espèces majoritairement exploitées par la filière bois en Guyane, ce projet vise non seulement à proposer des alternatives plus sûres et écologiques dans le cadre de la lutte antivectorielle, à faire progresser les connaissances sur les mécanismes d’action de l’extrait de bois et de ses molécules vis-à-vis du moustique Ae. aegypti, mais aussi à contribuer à une utilisation rationnelle des ressources, en participant à la structuration du développement et de l’innovation en Guyane.
Dans un premier temps, les doses létales de l’extrait de S. rubra ont été déterminées en laboratoire sur les larves de 4 lignées de moustiques présentant différents mécanismes et degrés de résistance à la deltaméthrine. Parmi ces lignées figurent à la fois une lignée dite de référence, sensible, maintenue en laboratoire de façon régulière et une lignée locale capturée sur la ville de Cayenne présentant une forte résistance à la deltaméthrine (photo 3). Entre ces deux extrêmes, deux lignées issues de populations naturelles de résistance intermédiaire à la deltaméthrine et maintenues en laboratoire. Comme décrit plus haut, la résistance d’Ae. aegypti aux pyréthrinoïdes a été démontrée dans des populations naturelles.
Les mécanismes de résistance impliqués sont d’une part une mutation de la cible (canal sodium voltage dépendant) (Dusfour et al., 2015) et d’autre part une augmentation du métabolisme de détoxification (Dusfour et al., 2015; Faucon et al. 2015, 2017). Cependant, le mode d’action de l’extrait de S. rubra et de ses constituants ainsi que les mécanismes de résistance qui pourraient être développés par les moustiques en réponse à leur exposition, ne sont actuellement pas connus. Dans cette étude, actuellement en cours, nous proposons donc de rechercher au laboratoire la possibilité d’une résistance croisée avec celles observée vis-à-vis des pyréthrinoïdes.
Cette première étape pourra également nous informer sur l’intervention de l’extrait de S. rubra ou de l’un de ses constituants sur le canal sodium voltage dépendant, et de l’implication des enzymes de détoxification en place sur la dégradation de ceux-ci. Les informations obtenues grâce à la mesure des doses létales sur différentes lignées seront en particulier complétées par des approches en biologie moléculaire visant à élucider les voies métaboliques mises en jeu chez les larves de moustiques mis en contact avec l’extrait et les molécules de grignon.

En complément, l’étude de potentielles modifications histologiques ou morphologiques des larves pourra être réalisée. Des résultats intéressants ont en effet déjà été obtenus par ce type d’approche dans l’étude du mode d’actions d’insecticides botaniques sur les larves d’Ae. aegypti (Kanis et al., 2018).
De futures analyses viseront également à mieux comprendre l’impact de l’extrait et des molécules obtenus à partir du bois de S. rubra sur les traits d’histoire de vie du moustique. Parmi les pistes envisagées, l’exposition à de faibles doses de substances actives permettrait d’obtenir des informations sur les modifications de durée des différents stades, du taux de gorgement ou de la fécondité des femelles adultes, ou encore des préférences pour certains gîtes larvaires. L’efficacité des substances sur des moustiques adultes serait aussi à déterminer, afin d’évaluer l’efficacité de l’extrait de grignon franc et d’envisager son utilisation sur ce stade.
Enfin, les doses létales déjà mesurées servent actuellement de base à la mise en place d’un protocole d’évaluation en conditions semi-opérationnelles de l’activité larvicide de formulations réalisées à partir de l’extrait de bois de grignon franc (photo 4). L’extrait est en effet en partie composé de molécules lipophiles, donc peu solubles dans l’eau, et a fortiori dans les gîtes larvaires. L’objectif du projet actuel est donc également de proposer un prototype de formulation permettant d’aboutir à une preuve de concept de l’utilisation opérationnelle possible de l’extrait de bois pour le traitement des gîtes larvaires.
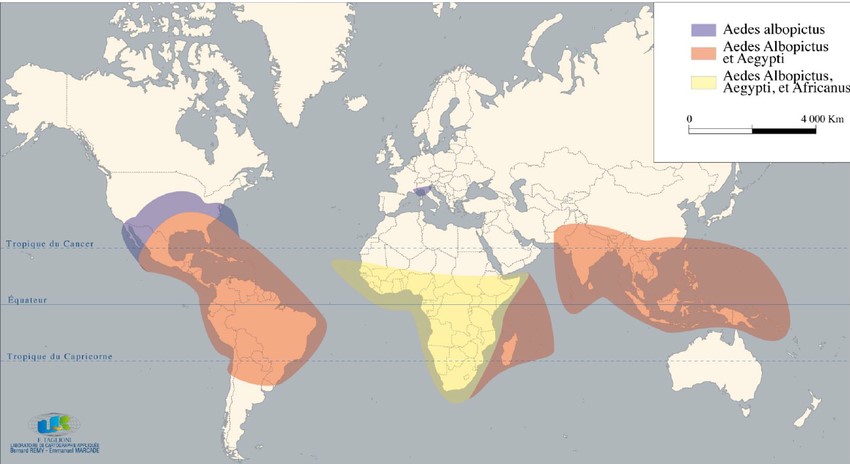
Carte de répartition
Les auteursEmmanuelle Clervil est ingénieure d’étude au CNRS au sein de l’UMR EcoFoG à Cayenne. Après un master en Entomologie médicale et Emergence des maladies parasitaires et Infectieuses à l’université de Montpellier, elle est recrutée en septembre 2019 sur le projet SextoniAedes. Ce dernier vise à évaluer l’activité larvicide et à comprendre le mode d’action des extraits de bois de Grignon franc ainsi que les molécules actives de ces extraits sur les larves du moustique vecteur Aedes aegypti. Emeline Houël est ingénieur de recherche au CNRS. Depuis 2005 en Guyane, elle travaille actuellement au Laboratoire des Substances Naturelles Amazoniennes de l’UMR EcoFoG à Cayenne. Co-responsable au sein de son unité de la thématique « Matériaux et Valorisation de la Biodiversité », elle a coordonné et participé à de nombreux projets de recherche dans le domaine des métabolites d’intérêt issus des plantes. Ses derniers travaux s’orientent autour de la chimie du bois de l’espèce forestière amazonienne Sextonia rubra (grignon franc), qu’il s’agisse de la valorisation de ses composés dans le domaine des insecticides naturels ou de la compréhension du rôle des molécules dans les mécanismes de défense de l’arbre. Isabelle Dusfour est entomologiste médicale. Elle a travaillé pendant 10 ans à l’Institut Pasteur de la Guyane, en tant qu’adjointe puis responsable scientifique du Vectopôle et de l’unité adaptation et contrôle des vecteurs. Depuis 2018 elle travaille en tant que professeur invitée à l’INRS-Centre Armand-Frappier Santé Biotechnologie de l’Université de Laval au Québec. Jean-Bernard Duchemin est chargé de recherche à l’Institut Pasteur. Il a travaillé pendant 15 ans dans le Réseau International des Instituts Pasteur en Guyane, en Afrique, puis 7 ans en Australie, au sein du CSIRO. Depuis 2018 en Guyane, il travaille sur la transmission des arbovirus et le comportement des moustiques. Les laboratoiresEcoFoG (Ecologie des Forêts de Guyane ; http://www.ecofog.gf) est une Unité Mixte de Recherche en Guyane (Kourou et Cayenne) mobilisant les ressources d’AgroParisTech, de l’INRA, du CIRAD, du CNRS, de l’Université des Antilles et de l’Université de Guyane. EcoFoG vise à intégrer un large éventail d’approches en écologie et en science des matériaux pour comprendre les relations entre la biodiversité et le fonctionnement des écosystèmes forestiers aménagés et non aménagés sous les pressions climatiques et anthropiques changeantes. Un des objectifs des recherches menées est de favoriser l’innovation dans la valorisation des ressources forestières de Guyane en tenant compte des contraintes du milieu tropical humide. Le Laboratoire d’Entomologie Médicale est situé au Vectopôle de l’Institut Pasteur de la Guyane, qui fête cette année ses 80 ans. L’unité de recherche regroupe, en plus du responsable du laboratoire, trois techniciens et une ingénieure de recherche. La plateforme comporte un insectarium avec plusieurs pièces thermo-régulées et un laboratoire de confinement de niveau P3, permettant les expérimentations avec des arbovirus, ainsi que des pièces dédiées aux manipulations d’insecticides, bactériologie et biologie moléculaire. Les thématiques de recherche sont ancrées dans l’appui à la Santé publique et à l’étude de la transmission des principales pathologies transmises par insectes en Guyane (paludisme, dengue, et autres arboviroses, leishmanioses…). |
Bibliographies récentes
- Abilio A.P. et al. (2018) : Distribution and breeding sites of Aedes aegypti and Aedes albopictus in 32 urban/peri-urban districts of Mozambique : implication for assessing the risk of arbovirus outbreaks. PLOS 12(9) (lien)
- Benelli G. (2015) : Research in mostiquo control : current challenges for a brighter future. Parasitology Research. 114:2801-2805 (lien)
- Benelli G. & Mehlhorn H. (2016) : Declining malaria, rising of dengue and Zika virus : insights for mostiquo vector control. Parasitology research. 115:1747-1754 (lien)
- Falkowski M. et al. (2020) : Towards the optimization of botanical insecticides research : Aedes aegypti larvicidal natural products in French Guiana. Acta Tropica. 201 (lien)
- Faucon F. et al. (2017) : In the hunt for genomic markers of metabolic resistance to pyrethroids in the mostiquo Aedes aegypti : an integrated next-generation sequencing approach. PLOS neglected tropical diseases (lien)
- Houël E. et al. (2017) : Natural durability of Sextonia rubra, an Amazonian tree species : description and origin. Food and Agriculture Organization of the United Nations (lien)
- Kanis L.A. et al. (2018) : Piper ovatum (Piperaceae) extract/starch-cellulose films to control Aedes aegypti (Diptera: Culicidae) larvae. Industrial Crops and Products, 122:148-155 (lien)
- Powell J.R. & Tabachnicl W.J. (2013) : History of domestication and spread of Aedes aegypti – A review. Memorias do Instituto Oswaldo Cruz (lien)
Ouvrages sur la thématique
- Géopolitique du moustique (Erik Orsenna & Isabelle de Saint-Aubin – Editions Fayard – 251 pages – 29 mars 2017)
- Alerte aux moustiques (Frédéric Simard ; Laurence Farraudière & André Yébakima – IRD Editions – 80 pages – 2 janvier 2017)
- Des moustiques et des hommes: Chronique d’une pullulation annoncée (Frédéric Darriet – IRD Editions – 136 pages – 27 mai 2014)
- Interactions entre insecticides chez les moustiques vecteurs (Editions Univ Européennes – 192 pages – 23 janvier 2011)