Par Benoît GILLES
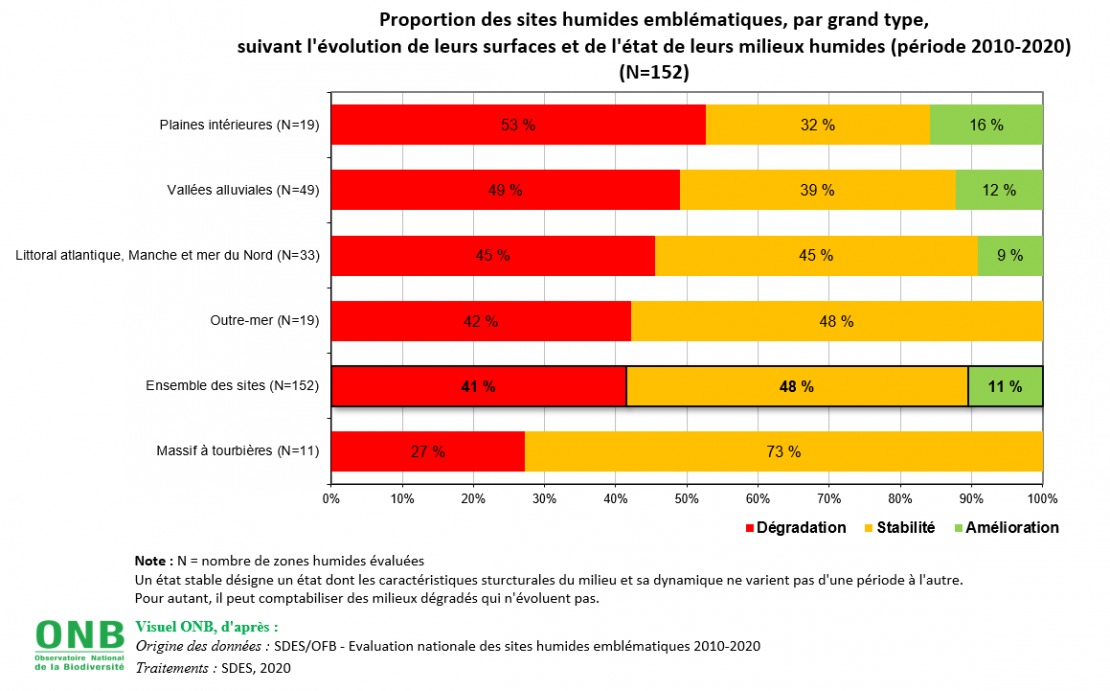
Au niveau mondial, les zones humides (lacs, cours, d’eau, tourbières et marais) disparaissent trois fois plus vite que les forêts. Depuis 1900, les scientifiques estiment que près de 64% des zones humides de la planète auraient ainsi disparu, entrainant dans leur sillage une biodiversité riche et inféodée à ces milieux singuliers. La richesse biologique des zones humides s’éteint plus rapidement et plus silencieusement que la biodiversité terrestre ou marine (figures 1 & 2). Les populations des espèces d’eau douce ont ainsi diminué de 76% entre 1970 et 2010 (Indice Planète Vivante et WWF).

Les principaux facteurs de cette perte de biodiversité des systèmes aquatiques reposent sur le développement des infrastructures (modifications des berges, ponts, etc.), l’occupation des sols par l’agriculture intensive et l’urbanisation, le détournement de l’eau (irrigation, barrages, digues), la pollution de l’eau et des sédiments par les phytosanitaires et les fertilisants, et le changement climatique asséchant de nombreuses régions.
En Europe centrale, l’industrialisation, combinée à la canalisation active de grands et de petits plans d’eau courante, a conduit à une réduction spectaculaire de la diversité en espèces de poissons et d’invertébrés aquatiques.
Bien que les extinctions d’espèces d’insectes aquatiques aient rarement été documentées, de nombreuses espèces auparavant répandues ne persistent désormais plus que sous formes de petites populations reliques dans des refuges n’ayant pas été soumis à de graves altérations de l’habitat.

Palingenia longicauda, la plus grande espèce d’éphémères d’Europe (figure 3), en est une des illustrations majeures. Jusqu’au 19ème siècle, l’espèce était bien connue des fleuves moyens à grands d’Europe : Hongrie, Pays-Bas, Tchécoslovaquie, Allemagne, Russie, Roumanie, Bulgarie, Pologne.
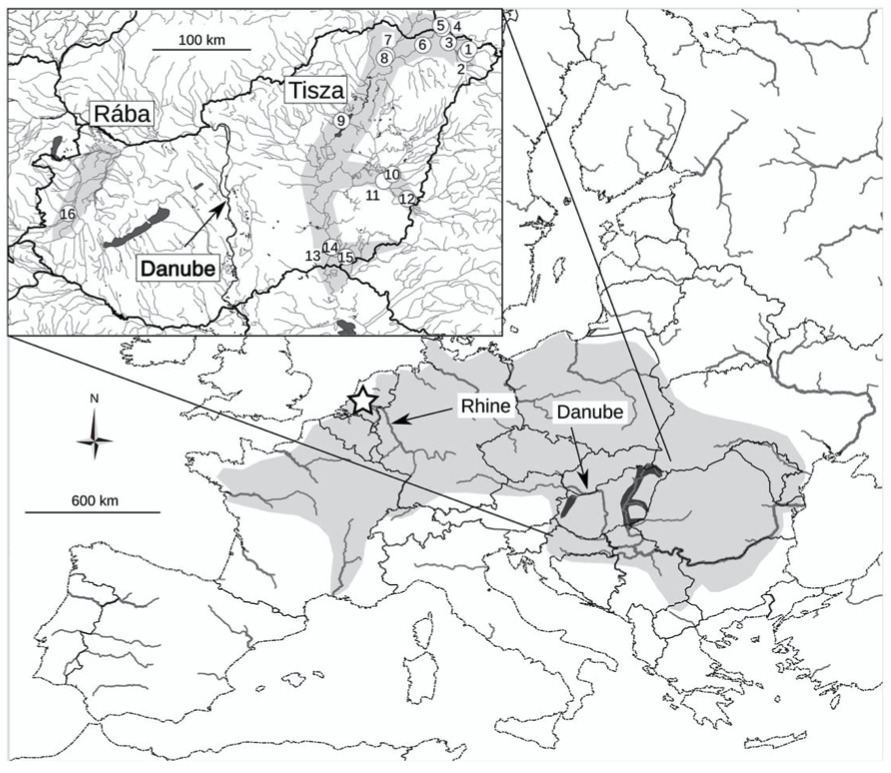
Aujourd’hui, P. longicauda persiste et est uniquement cantonnée à la rivière Tisza et aux chaînes inférieures des affluents de cette rivière en Hongrie, soit environ 2% de son ancienne aire de répartition (figure 4). Des individus ont été récemment observés dans la rivière Raba après 40 ans sans signalement. Le déclin spectaculaire de P. longicauda coïncide avec l’altération hydromorphologique rapide et intense, et avec la pollution des rivières européennes qui a connu son apogée dans les années 1930. L’espèce a disparu de la Loire (France) en 1922, du Rhin (Allemagne) en 1952 et du Danube (Serbie et Bulgarie) en 1973.
Cette région du Danube constitue une zone refuge pour un grand nombre d’espèces de cours d’eau et de zones humides (poissons, amphibiens, insectes, etc.) du Pléistocène (maximum période glaciaire) comme le Saumon du Danube (Hucho hucho) (Convention de Berne, Annexe III, « en danger » UICN), la Lamproies des Carpates (Eudontomyzon danfordi), le Goujon du Danube (Romanogobio uranoscopus) (Convention de Berne, Annexe III, « en danger » UICN).
L’extinction rapide et presque complète de P. longicauda a entrainé son inscription dans la liste des rares insectes aquatiques de l’Annexe II de la Convention relative à la conservation de la vie sauvage et du milieu naturel en Europe (Convention de Berne). Les tentatives de conservation actuelles incluent la protection de l’espèce dans ses habitats indigènes restants en Hongrie, ainsi que le peuplement d‘un affluent du Rhin en Allemagne avec des populations de la rivière Tisza.
L’espèce est devenue un symbole des efforts de conservation des eaux douces en Europe centrale, en particulier en Hongrie. En plus d’être le plus grand éphémère d’Europe (12 cm), P. longicauda offre un spectacle époustouflant lorsque des essaims composés de plusieurs millions d’individus se forment au mois de juin au-dessus de l’eau et ne durant que quelques heures.
C’est ce qu’ont pu observer le 16 juin dernier les habitants de la rivière Tisza en Hongrie.
Écologie et histoire de vie du stade larvaire
Tout commence lorsque les femelles Palingenia longicauda pondent entre 8 000 et 9 000 œufs de petite taille (0,360 à 0,380 mm) à la surface de l’eau. Les œufs, charriés parfois sur plusieurs kilomètres par le courant, se déposent au hasard au fond de la rivière pouvant atteindre 8 à 9 m de profondeur (Unger, 1927).
Les œufs qui auront la chance de se déposer sur un substrat composé de graviers, d’argiles et de boues vont pouvoir se développer en larves. Pour les autres, l’histoire va malheureusement s’arrêter à ce moment-là (Russev, 1967).
Les zones favorables au développement des œufs et des larves sont principalement localisées près des berges (Russev, 1977) à des profondeurs inférieures à 10 m et avec un courant inférieur à 1m/s (figure 5). Suite à leurs études menées sur la rivière Tisza, Csoknya et Halasy (1974) ont écrit : « … la distribution en larves la plus uniforme se rencontre à 5 m des berges dans le lit de la rivière, à des profondeurs de 60 cm. Les jeunes larves (0,5-20,5 mm) se rencontrent principalement près des rives (3 m) dans la boue, tandis que les larves de grande taille (20,5-40, mm) se situent quant à elles entre 3 et 7 m des berges ».

Les larves se fixent dans le substrat en creusant un tunnel en forme de U (figure 6) à l’aide de leurs pattes postérieures et de leurs mandibules élargies. La forme en U permet de créer, par des mouvements ondulatoires de leur corps et de leurs branchies trachéales, un flux d’eau unidirectionnel constant à l’intérieur du tunnel pour à la fois maintenir une oxygénation optimale et évacuer le CO2 et les excréments. Le tunnel d’une larve en fin de croissance mesure jusqu’à 10 à 15 cm de long pour un diamètre de 6 à 8 mm.

Nocturnes, les larves demeurent logées dans leur tunnel durant la journée, puis sortent à la nuit tombée pour explorer les alentours à la recherche de nourriture composées de matières organiques déposées sur le fond de la rivière (Bacescu, 1943 ; Stenger 1973), ou éventuellement chercher un site plus favorable.
Grâce aux travaux menés en laboratoire par Unger en 1927, il a été estimé que les larves émergent des œufs 4 à 6 semaines après la ponte dans une eau comprise entre 20 et 25°C et que le développement larvaire se termine au bout de 3 ans, après une vingtaine de mues successives.
Dans les zones favorables, comme l’a constaté Russev en 1977 dans le Danube, la densité en larves peut approcher les 1 000 individus au m2, soit une biomasse de 270g par m2. Des densités moyennes plus faibles ont cependant été observées dans d’autres rivières par Csoknya et Ferencz (1972) : 90 spécimens par m2, et 17,5 individus par m2 dans la rivière Tisza.
Lors de la saison sèche, la diminution du niveau de l’eau et du courant entraine un regroupement des larves à certains endroits. Ainsi, des concentrations de 2 000 à 4 000 tunnels au m2 ont pu être relevées, voire 6 700 tunnels au m2 de manière localisée !
Description morphologique
La forme adulte des mâles leur confère un vol plus rapide, efficace et actif que la forme subadulte, et est caractérisés par la présence de trois longs filaments caudaux (cerques) à l’extrémité de l’abdomen mesurant trois fois la longueur de l’insectes (65 mm), des pattes antérieures longues et de couleur jaunâtre (figure 7).
Les femelles sont aisément reconnaissables en raison de leur corps large, des ailes blanches et larges, de petits yeux, et leurs filaments caudaux 3 fois plus courts que ceux des mâles. Plus robustes et puissantes que les mâles, elles volent plus rapidement (18 km/h) et plus haut (14 km/h) (figure 7).

Écologie et histoire de vie des adultes
Comme cela a été constaté en 2022 dans le Danube, les émergences de masse des adultes se déroulent en général autour du 8 et 15 juin, et de manière plus large entre le 5 et le 20 juin, entre 15h et 19h30.
Ces émergences se déroulent en plusieurs étapes précises :
- Vers 15h – 15h30, les larves mâles quittent leur tunnel dans le lit de la rivière pour rejoindre la surface où ils vont effectuer une première métamorphose aboutissant à une forme ailée intermédiaire dite subimaginale (vidéo 1). Les subadultes volent aussitôt en direction des berges, s’agrippent à la végétation, à un rocher ou tout autre type de support pour accomplir une seconde métamorphose donnant la forme adulte (imaginale) définitive
- Puis, vers 16h – 16h30, les larves femelles remontent à leur tour à la surface pour réaliser une unique métamorphose (les femelles sont dépourvues de formes subimaginales : forme ailée intermédiaire entre la larve et l’adulte) et acquérir leur forme adulte définitive. Les mâles émergent une heure avant les femelles sans doute en raison de la nécessité de réaliser une mue supplémentaire sur les berges
- A partir de 17h30, et pour une durée de 2h, mâles et femelles se mettent à voler ensemble formant d’importants nuages d’insectes (vols de masse) au-dessus de la rivière à la recherche d’un partenaire sexuel : l’espérance de vie des imagos n’excède pas plus de 2h
Vidéo 1 : Mâle réalisant sa dernière mue permettant le passage de la forme subadulte à adulte (subimaginale – imago) – 2013 (source : Mirjana Rankov)
Durant les vols de masse, il a pu être comptabilisé plus de 120 individus par m3 d’air (figure 8 et vidéo 3).

Observer les mâles à la recherche d’une partenaire offre un spectacle à la fois singulier et étonnant. Volant à la surface de l’eau, pattes antérieures étirées en avant telles de cornes (figure 9) et les filaments caudaux affleurant la surface de l’eau avec un angle de 45° par rapport à l’axe du corps, le mâle agrippe fermement la tête de la première femelle émergeant de l’eau détectée par le contact avec l’un des filaments caudaux. Le sex-ratio étant en faveur des mâles, certaines femelles sont parfois recouvertes par une dizaine de mâles.

Une fois le couple formé, le mâle se place sous la femelle et l’entraine en altitude pour s’accoupler en vol. Lors de l’accouplement, les couples peuvent perdre de la hauteur et finir l’accouplement à la surface.
Dès l’accouplement terminé, les mâles lâchent leur partenaire, tombent et meurent rapidement. Les femelles poursuivent quant à elles leur courte vie en volant vers l’amont de la rivière (parfois sur 3 km) pour y pondre en déposant leurs œufs à la surface de l’eau. Les scientifiques suggèrent que les femelles remontent ainsi le cours de la rivière afin de compenser le courant lors de la chute des œufs au fond de la rivière.
Vidéo 2 : Femelles en train de pondre à la surface de l’eau – 2017 (source : Mirjana Rankov)
Une fois le vol de masse terminé, moins d’une demi-heure en général, les berges et la surface de l’eau sont couvertes de millions d’exuvies et de cadavres d’éphémères.
Facteurs écologiques
Les facteurs écologiques qui déclenchent et influencent l’émergence et le développement des stades adultes ne sont pas encore bien définis.
En général, les vols de masse ont lieu lors de journées ensoleillées, calmes et dépourvues de vent. Il a pu être constaté que la force et la direction du vent pouvaient perturber le phénomène. Cependant, il s’avère que les femelles ont la capacité d’adapter leur vol à de légères brises (vidéo 3).
Vidéo 3 : Vol de masse observé le 18 jour 2022 (source : Mirjana Rankov)
Les femelles semblent s’orienter en vol par le système visuels (ocelles notamment – liens) et identifier les sites de ponte à l’aide de leurs filaments caudaux touchant régulièrement la surface de l’eau (identification de paramètres physico-chimiques comme la température, la dureté, alcalinité, taux d’oxygène, etc.).
Comme le suggèra Pongracz en 1933, les essaimages seraient influencés par la luminosité et l’intensité lumineuse du ciel. Ils coïncideraient avec des conditions météorologiques offrant de hautes pressions atmosphériques, de fortes températures de l’eau et de l’air, durant un changement de phase de lune.
Dans le Danube, de 1955 à 1958, les essaimages ont ainsi eu lieu au dernier quartier de lune (13 juin, 20 juin, 9 juin respectivement).
Bibliographie
- Balint M. et al. (2012) : Species history masks the effects of human-induced range loss – Unexpected genetic diversity on the endangered giant mayfly Palingenia longicauda. PLos One, 7(3):1-9 (lien)
- Malnas et al. (2011) : Bridges as optical barriers and population disruptors for the mayfly Palingenia longicauda : on overlooked threat to freshwater biodiversité ? Journal of Insect Conservation, 15:823-832 (lien)
- Martinov A.V. (2018) : New records of some rare mayflies Fromm Ukraine. Ecologica Montenegrina, 16:48-57 (lien)
- Russev Boris K. (1987) : Ecology, life history and distribution of Palingenia longicauda. Tijdschrift voor Entomologie 130:109-127 (lien)





