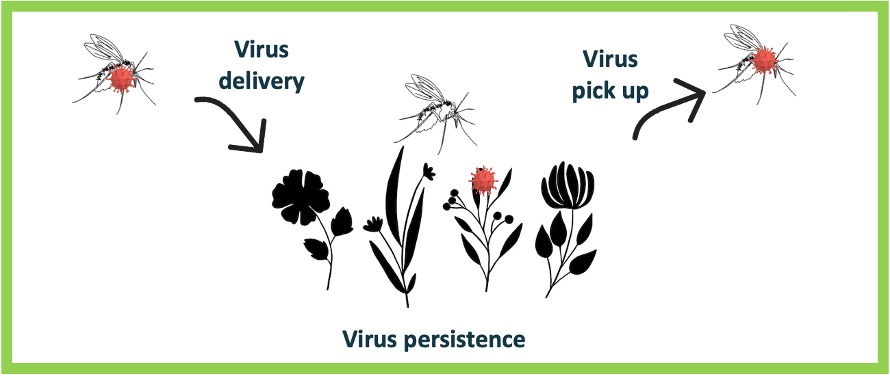
Nombre de vues : 4 342 Par Lison Laroche Les phlébotomes, présents dans toutes les régions intertropicales, sont des insectes diptères appartenant à la famille des
Catégorie : Actualités scientifiques
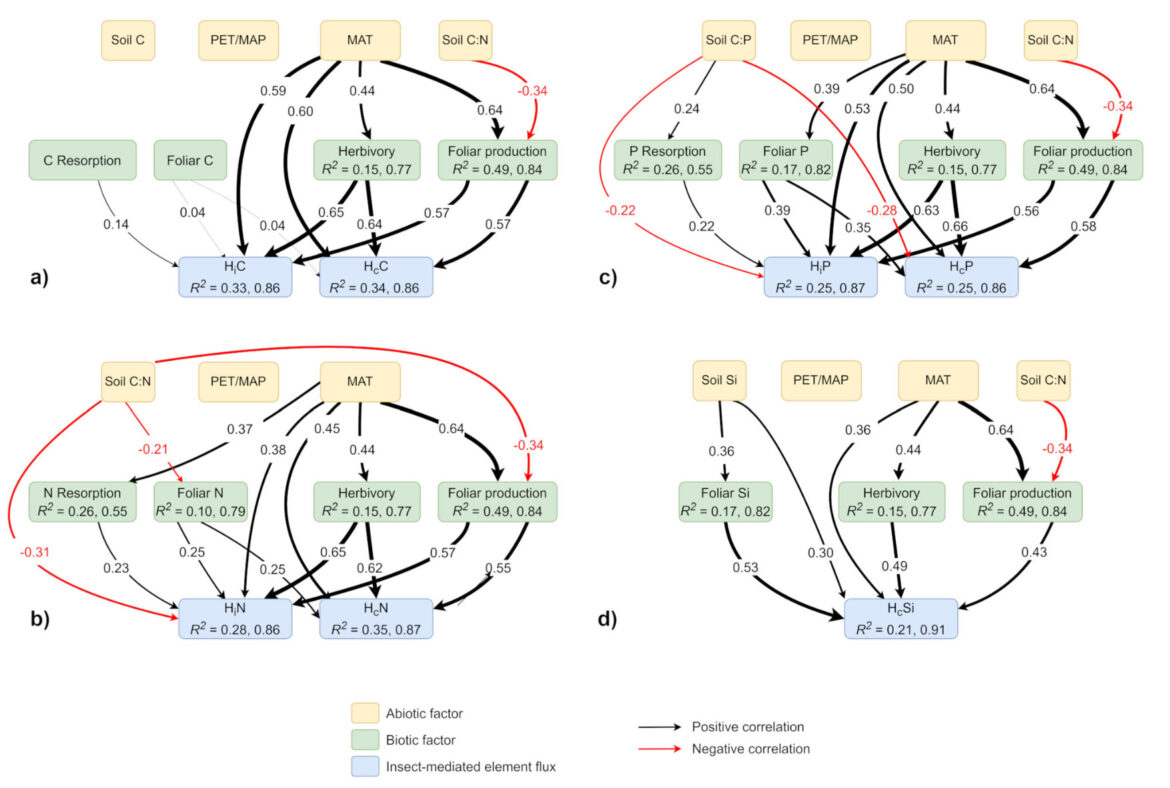
Impact des insectes phytophages sur le cycle biogéochimique dans les forêts de feuillus
Nombre de vues : 3 768 Par Benoît GILLES Le rôle et les services écosystémiques que procurent les insectes dans l’environnement (pollinisation, lutte biologique, dégradation de
Les bourdons incapables de détecter les insecticides !
Nombre de vues : 3 021 Par Benoît GILLES Les insectes participent à de nombreux services majeurs pour l’équilibre des écosystèmes comme la pollinisation (Calderone, 2012
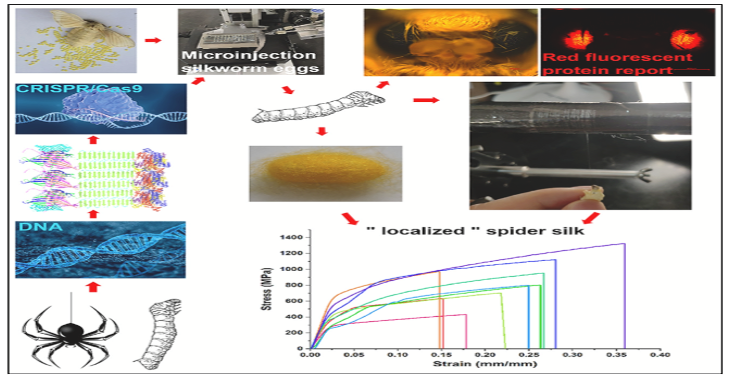
Production de soie d’araignée à partir de vers à soie !
Nombre de vues : 4 360 Par Benoît GILLES Tout type de matériau nouveau apporte souvent des améliorations dans une diversité de domaines : en témoignant le
L’ANR DISLAND : un projet de génétique du paysage pour informer la dispersion de la mouche orientale des fruits dans les paysages agricoles sénégalais
Nombre de vues : 2 493 Par Marie-Pierre Chapuis & Karine Berthier La mouche orientale des fruits, un ravageur majeur dans le monde Bactrocera dorsalis (BD ;
Le contrôle d’altitude chez les abeilles
Nombre de vues : 4 387 Par Julien Serres Comment les abeilles perçoivent-elles leur altitude ? Tout comme un aviateur pilotant à vue, les apidés se
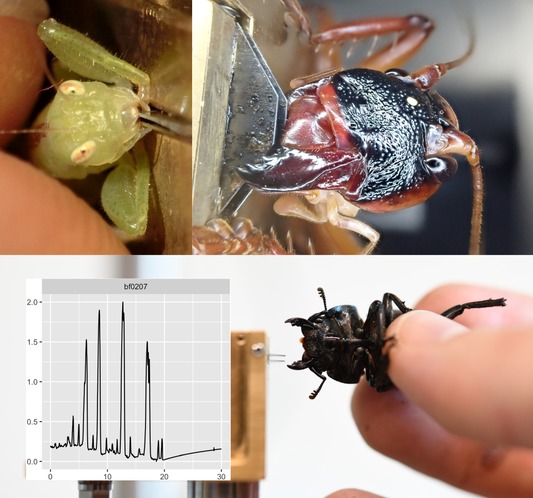
Une base de données sur la performance de morsure des insectes
Nombre de vues : 2 529 Par Benoît GILLES Le fait de pouvoir mordre avec force offre aux espèces qui sont dotées de cette capacité la
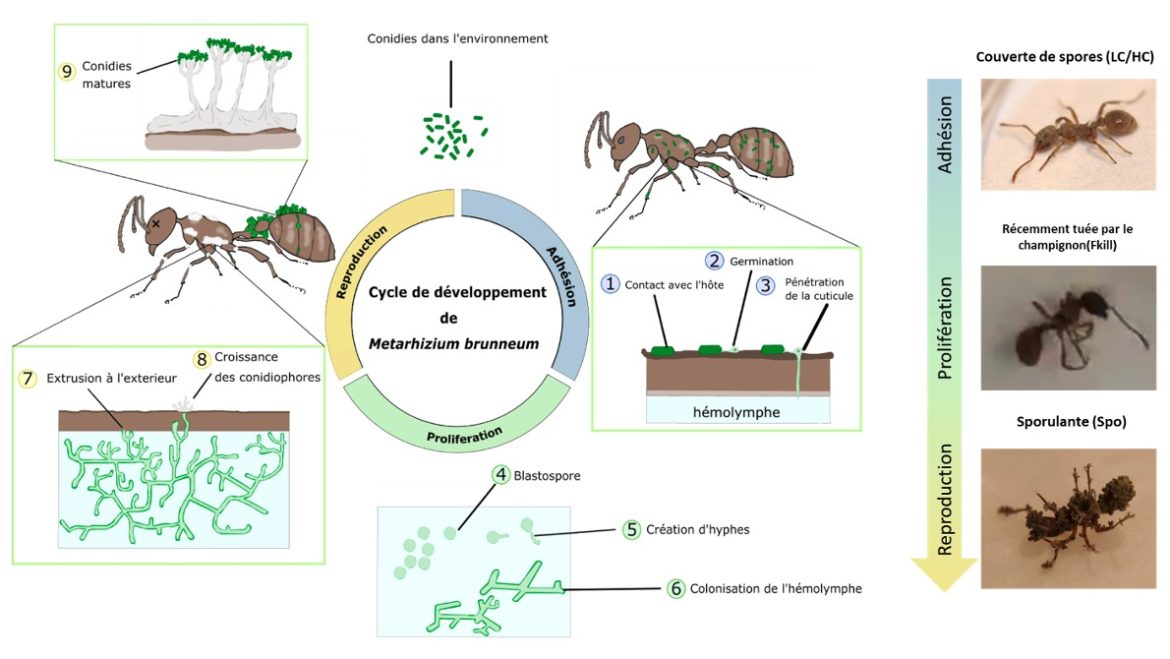
Comment les fourmis Myrmica rubra limitent-elles l’apport de pathogènes durant le fourragement ?
Nombre de vues : 3 484 Par Hugo Pereira Les insectes eusociaux théoriquement vulnérables aux pathogènes L’incroyable succès des insectes eusociaux et notamment des fourmis provient
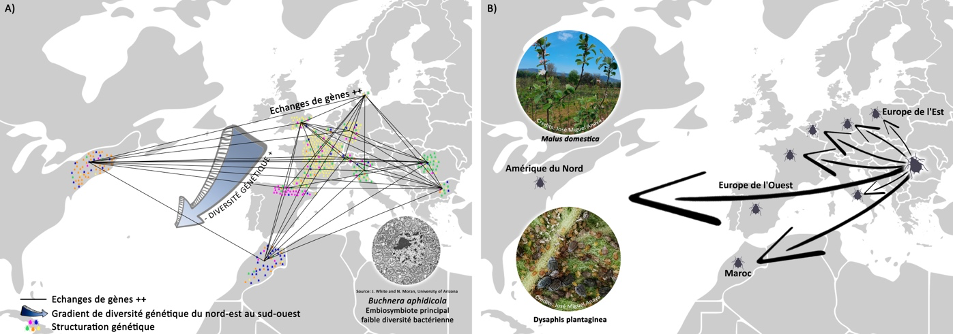
Colonisation récente du pommier dans les vergers en Europe, au Maghreb et en Amérique du Nord par le Puceron cendré
Nombre de vues : 2 371 Par Amandine Cornille et Sergio Olvera-Vazquez Reconstruire l’histoire de colonisation de ravageurs majeurs des cultures, les pucerons, à l’aide des
Un Coléoptère au service de la dermatologie ?
Nombre de vues : 1 726 Par Benoît GILLES La science s’inspire de plus en plus de la nature pour concevoir de nouveaux matériaux, de nouvelles