Par Thibault Ramage & Corentin Jouault
Les fourmis attirent et passionnent par leurs formes (figure 1), leurs comportements, leur biologie ou leur écologie. Ces insectes sociaux forment des sociétés complexes qu’animent des comportements que l’on pourrait imaginer « propres à l’Homme » existent. L’élevage ? Les fourmis protègent et s’occupent de pucerons et de cochenilles depuis des millions d’années. L’agriculture ? Les fourmis champignonnistes des Amériques coupent des morceaux de feuille pour faire pousser un champignon dont elles se nourrissent. L’esclavagisme ? Les fourmis amazones (genre Polyergus par exemple) incapables de s’occuper de leur couvain (œufs et larves), capturent des ouvrières d’autres espèces pour faire ce travail à leur place. Ce sont toutes ces caractéristiques qui provoquent, chez les petits comme les grands, chez les amateurs comme chez les scientifiques, ce fort engouement qui entoure ces insectes.

Près de 14 000 espèces sont décrites (13 684 pour être exact), réparties sur tous les continents (à l’exception des pôles) et dans quasiment tous les milieux. Les fourmis se sont adaptées à des milieux extrêmes que l’homme appréhende avec difficulté. Par exemple, en Alaska où le sol est gelé neuf mois sur douze, Leptothorax acervorum (Fabricius, 1793) survit en allongeant son cycle de développement larvaire sur plus de deux ans (Nielsen, 2011).
De la même manière, il est possible de rencontrer une dizaine d’espèces de fourmis à plus de 4 000m d’altitude dans l’Himalaya (Bharti et al., 2013). A l’inverse, certaines espèces des genres Cataglyphis, Ocymyrmex ou encore Melophorus peuvent sortir en plein soleil, pour de courtes durées, lorsque la température à la surface du sol avoisine les 60 à 70°C (Nielsen, 2011) !
Dans les mangroves, une espèce comme Colobopsis anderseni (McArthur & Shattuck, 2001), vivant dans les tiges des palétuviers, arrive à survivre à deux submersions marines quotidiennes grâce aux soldats qui bloquent les entrées avec leur tête aplatie, permettant ainsi à la colonie de rester au sec (Nielsen, 2011). Les ouvrières de Polyrhachis sokolova Forel, 1902, survivent quant à elles à l’immersion de leur colonie située dans la boue à l’aide de poches d’air (Robson, 2010).
A cette diversité d’occupation de biotopes et de micro-habitats s’ajoute une grande polyvalence dans leurs régimes alimentaires, et par conséquent une grande variabilité de taille et de morphologie. Les fourmis champignonnistes possèdent par exemple des mandibules courtes et fortes adaptées à la découpe des feuilles (figure 1B). D’autres espèces, vivant dans les strates arbustives et arborescentes, chassent à vue à l’aide de leurs grands yeux et de leurs mandibules courtes (comme Gigantiops destructor (Fabricius, 1804), figure 1A) ou longues (comme les Harpegnathos, figure 1H). Certaines de ces fourmis prédatrices comme celles du genre Odontomachus possèdent des mécanismes de fermeture des mandibules constituant les mouvements les plus rapides du monde animal. Cette rapidité est mise à profit par les fourmis vivant dans la litière, comme les Myrmoteras (figure 1F) pour capturer les collemboles ou autres proies très rapides.
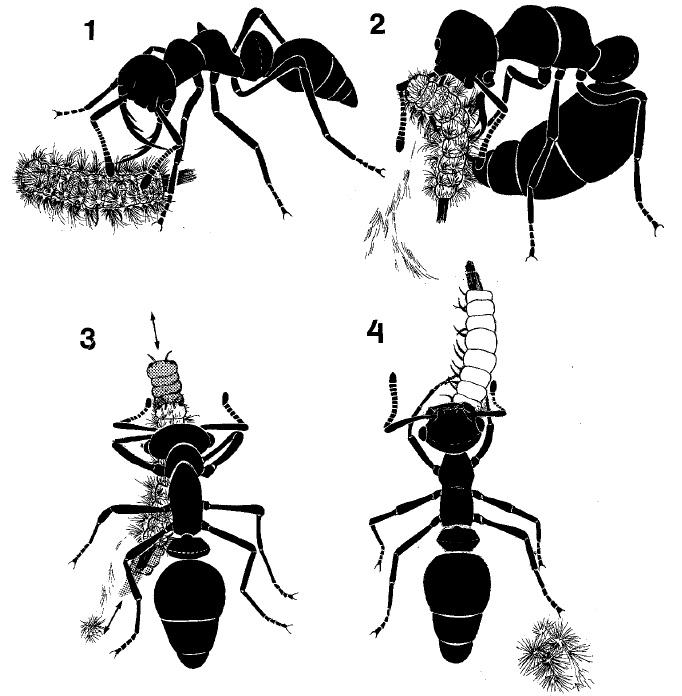
D’autres espèces poussent la spécialisation à son paroxysme, comme les Thaumatomyrmex (figure 1I) qui se nourrissent de « mille-pattes » de l’ordre des Polyxenida. Ces myriapodes possédant comme moyen de défense des soies détachables et barbelées qui emmêlent les prédateurs potentiels, les ouvrières utilisent leurs impressionnantes mandibules spécialisées pour retirer ces soies sans s’y empêtrer (figure 2) (Brandão et al., 1991).
Comment résister à la fascination qu’offre une telle diversité de formes et de comportements ?
Les auteurs y ont échoué et sont « tombés dans la marmite » étant tout jeunes, tradition bretonne oblige. D’abord l’observation dans la nature, à quatre pattes, les fesses en l’air, le nez collé au sol. Puis plus tard, l’observation à la maison de colonies , plus ou moins grandes, plus ou moins envahissantes. Et enfin parce que nous cherchons toujours à nommer les choses, ils se sont mis à la taxonomie, science ayant pour objet de décrire et de classer la biodiversité.
Les fourmis appartiennent aux Formicidae, une famille d’insectes bien étudiée et bien connue comparée aux autres familles d’Hyménoptères. Les myrmécologues (spécialistes des fourmis) ont, de surcroît, développé un certain nombre de sites internet et de bases de données sur le sujet (Antbase, AntCat, Antmaps, AntWiki, AntWeb, etc.).
Ces outils devenus incontournables pour l’étude des fourmis (catalogue taxonomique, bibliographique, cartographie des espèces, photos des spécimens types, clés de détermination) sont aujourd’hui accessibles à tous ceux qui s’intéressent à ces insectes fascinants. La communauté des myrmécologues offre quotidiennement des découvertes. Bien que la diversité des fourmis soit plus importante dans les régions tropicales et subtropicales, les nouveautés ne se cachent pas forcément loin de chez nous : une demi-douzaine d’espèces a été décrite en France métropolitaine ces dix dernières années ! Entre 2010 et 2019, 1851 espèces et sous-espèces de fourmis ont été décrites sur la planète, soit 14% de la myrmécofaune totale (Antwiki, 2020b) ! En 2019, nous avons eu l’opportunité de décrire deux de ces taxons.
Notre histoire se déroule en Nouvelle-Calédonie, un territoire français situé à plus de 16 000 km de la métropole et réputé pour sa biodiversité qu’il abrite (figure 3).
Alors que l’île ne fait que 400 km de long et 60 km de large, elle offre des niveaux d’endémisme comparables à ceux de l’Europe et du sous-continent indien comme en témoignent les terres ultramafiques (roches magmatiques et méta-magmatiques très pauvres en silice) du Sud et de leur maquis minier, où la quasi-totalité des plantes est endémique, ou encore la présence du Cagou, dernier représentant d’une famille d’oiseaux restreinte à cette île (Gargominy & Bocquet, 2013). Cet archipel héberge aussi le seul conifère parasite au monde, Parasitaxus usta (Vieill.) de Laub., 1972, ou encore Amborella trichopoda Baill., 1869, la plante à fleurs (Angiosperme) vivante considérée comme la plus « primitive ».
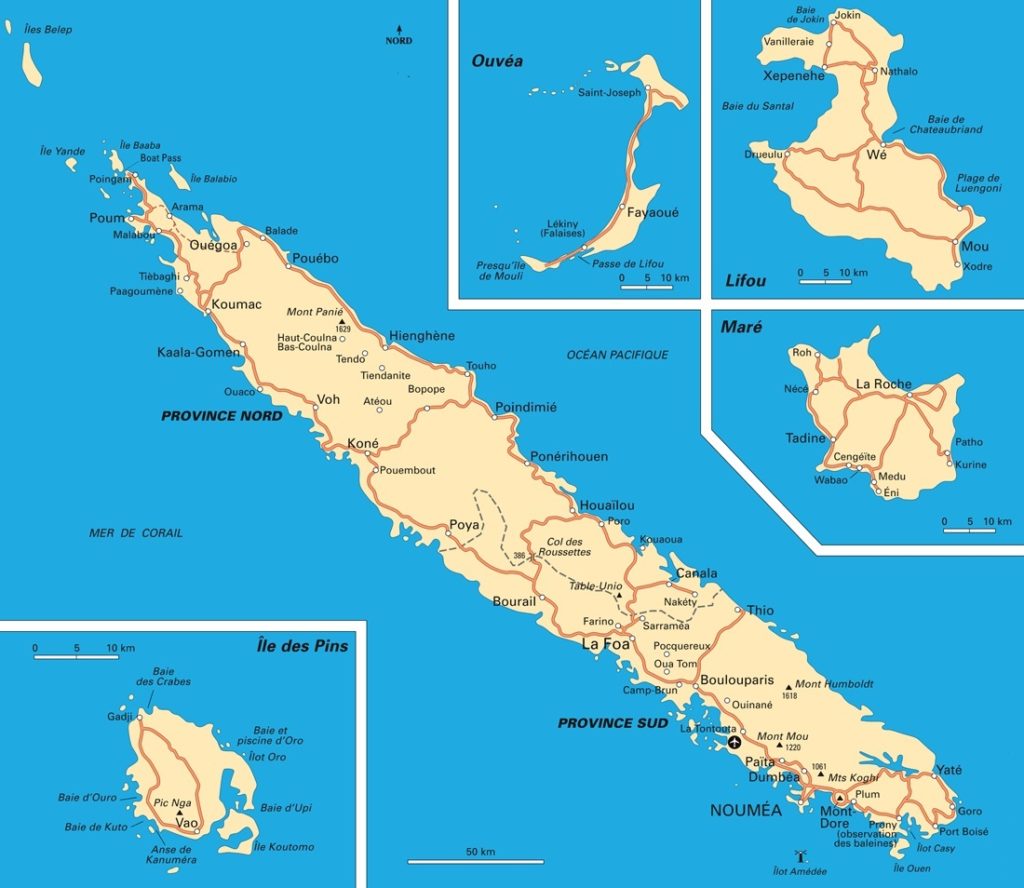
L’origine géologique de la Nouvelle-Calédonie, très ancienne, correspondrait à une partie du Zealandia, un fragment du Gondwana séparé de l’Australie il y a 83 millions d’années. La Nouvelle-Calédonie a longtemps été considérée comme une « arche de Noé » où auraient subsisté une faune et une flore issues du Gondwana. Elle aurait subi une submersion puis une émersion par obduction il y a 37 millions d’années, un phénomène géologique extrêmement rare et encore mal connu (Gargominy & Bocquet, 2013). Il y a toutefois débat sur la submersion totale ou partielle du territoire, avec la survie de groupes archaïques sur des îles aujourd’hui disparues.
Emery (1883, 1914) puis André (1889) et Forel (1894) furent les premiers à travailler sur les fourmis de Nouvelle-Calédonie et décrivirent respectivement 7, 37, 2 et 3 espèces, la quasi-totalité étant endémiques. Depuis, la majorité des espèces nouvelles de Nouvelle-Calédonie ont été décrites dans des révisions génériques portant sur la faune du Pacifique voire sur la faune mondiale.
Le travail de Ward (1984) sur les Rhytidoponera reste l’un des derniers travaux majeurs dans ce domaine. La myrmécofaune néo-calédonienne compte désormais 134 espèces et sous-espèces connues. Mais de récents inventaires, notamment ceux de Maïa Berman (Berman 2012; Berman & Andersen 2012; Berman et al. 2013a, 2013b), ont mis en évidence plusieurs dizaines d’espèces nouvelles (Antwiki, 2020a).
C’est en travaillant sur les récoltes de Maïa ainsi que sur celles de Vincent Perrichot que nous avons découvert deux nouvelles espèces des genres Leptogenys Roger, 1861 et Lioponera Mayr, 1879.
Le genre Leptogenys fédère plus de 300 espèces, réparties dans les régions tropicales et subtropicales (Bolton, 2019). S’étant fortement diversifié en Afrique il y a 30 à 40 Ma, ce genre est le plus riche au sein de la sous-famille des Ponerinae. La plupart des Leptogenys sont prédatrices d’Isopodes (cloportes), d’où la forme particulière de leurs mandibules (figure 1E). Certaines Leptogenys sont également nocturnes.

Parmi les échantillons de Vincent Perrichot, une Leptogenys de grande taille (un peu plus de 4 mm), à la forme fine et élancée s’est rapidement distinguée. Jusqu’à présent, quatre espèces de Leptogenys étaient connues de Nouvelle-Calédonie : L. acutangula Emery, 1914, L. punctata Emery, 1914, L. rouxi Emery, 1914 et L. sagaris Wilson, 1958. L’examen des descriptions et des photos des holotypes de ces espèces a rapidement permis de distinguer notre Leptogenys de ses congénères néo-calédoniens.
Cette nouvelle espèce, nommée Leptogenys loarelae (figure 4) en l’honneur de la fille du premier auteur, se distingue des trois espèces (L. acutangula, L. punctata, L. sagaris) par sa grande taille notamment, et de la quatrième espèce néo-calédonienne (L. rouxi) par la forme de ses mandibules (figure 5). Cette nouvelle fourmi n’est à ce jour connue que d’un spécimen unique. La découverte de spécimens additionnels permettra peut-être d’en connaître plus sur sa biologie, son écologie ou son régime alimentaire.
Le genre Lioponera a été mis en synonymie avec Cerapachys Smith, 1857 par Brown en 1975, puis revalidé par Borowiec en 2016 lors de la révision des genres de Dorylinae. Ce genre est présent en Afrique, en Asie et en Océanie, principalement dans les régions tropicales et sub-tropicales. A ce jour, le genre Lioponera comprend 74 espèces. C’est en Australie que se retrouve la plus grande diversité de Lioponera, avec 43 espèces recensées. Une récente étude phylogénétique suggère que ce genre d’origine africaine se serait propagé ensuite dans les régions indo-malaisienne et australasienne (Borowiec, 2019). Jusqu’à présent, toutes les espèces de Lioponera observées se nourrissent d’autres fourmis.

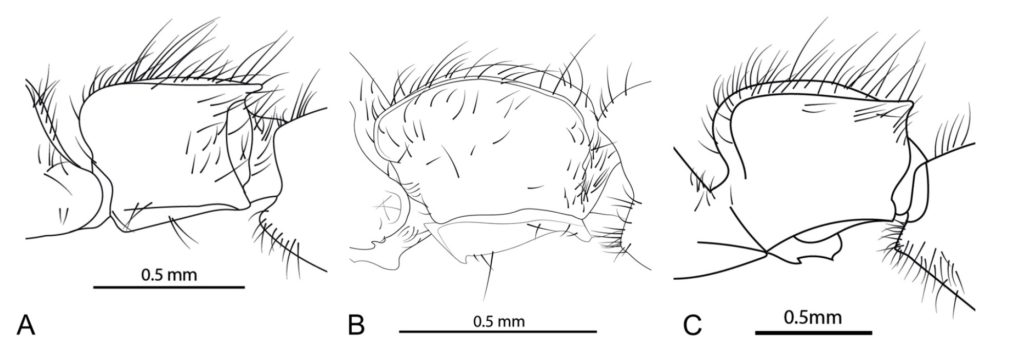
Alors que seules deux espèces de Lioponera sont connues de Nouvelle-Calédonie, L. cohici (Wilson, 1957) et L. dumbletoni (Wilson, 1957), les récoltes de Vincent Perrichot ainsi que celles de Maïa Berman contenaient une morpho-espèce (espèce décrite à partir de caractères morphologiques) qui ne correspondait pas à celles déjà décrites. Les nouveaux spécimens étaient bien plus petits que L. dumbletoni et s’en distinguaient également par des scapes plus petites et par la présence de marges dorso-latérales sur le mésosome (=thorax). Enfin, ils se distinguent de L. cohici par l’absence de marge entre le dessus du mésosome et la face déclive du propodeum, et par la forme du pétiole (article faisant la jonction entre le thorax et l’abdomen chez les fourmis) (figure 6). Cette nouvelle espèce a été nommée neocaledonica (figure 7). Comme pour Leptogenys loarelae, le peu de spécimens connus et l’absence d’observations in situ pour Lioponera neocaledonica ne permet pas de connaître sa biologie, son écologie ou son régime alimentaire.

Leptogenys loarelae et Lioponera neocaledonica ont été collectées dans la chaîne centrale de montagnes en Nouvelle-Calédonie, zone couverte principalement de forêts humides poussant sur un sol ultramafique. Sur le plateau de Dogny, la nouvelle espèce de Lioponera a été collectée à 441m d’altitude, dans une forêt humide mixte à arbustes d’Amborella trichopoda, la plante à fleurs vivante primitive dont nous avons parlé plus haut, et à fougères Ptisana rolandi-principis (Rosenst.) Christenh., 2011. Leptogenys loarelae a, quant à elle, été collectée à plus haute altitude, dans une forêt humide composée d’un grand nombre de conifères Austrotaxus spicata Compton (figure 8).
Ces fourmis nouvelles sont à leur manière « l’arbre qui cache la forêt », deux espèces nouvelles parmi tant d’autres, encore à découvrir.
Les inventaires réalisés par Maïa Berman ont permis de récolter des spécimens d’Acropyga Roger, 1862 ou de Crematogaster Lund, 1831, genres nouveaux pour la Nouvelle-Calédonie. Plus conséquente encore, la diversité des morpho-espèces récoltées face à la diversité décrite et recensée du territoire est bien plus importante. A titre d’exemple, 8 espèces de Discothyrea Roger, 1863, 19 de Lordomyrma Emery, 1897, 33 de Chelaner Emery, 1914, 10 de Paraparatrechina Donisthorpe, 1947 ou encore 17 de Pheidole Westwood, 1839 ont été collectées alors que les diversités connues sont moindres (1, 4, 7, 3 et 9 respectivement). Et tout cela sur un nombre restreint de sites, et sans recours à une méthode aussi productive que le tamisage. Ces perspectives laissent espérer de beaux jours pour les myrmécologues s’intéressant à la faune néo-calédonienne !

Les auteurs
 Thibault Ramage : Dès ma plus petite enfance, la nature m’a passionné, en particulier les plantes, les oiseaux et les insectes. Peu à peu, cette passion s’est concentrée sur les arthropodes, avec une prédilection pour les fourmis. C’est durant plusieurs expériences professionnelles dans l’Outre-mer (Nouvelle-Calédonie, Polynésie française et La Réunion) que je me suis spécialisé dans la taxonomie des insectes ultra-marins, plus précisément pour les Hyménoptères Aculéates. Je suis entomologiste indépendant depuis plus de 7 ans travaillant essentiellement pour la recherche scientifique.  Corentin Jouault : Passionné depuis toujours par les insectes, je m’intéresse maintenant à leur évolution. J’étudie particulièrement les Hyménoptères et les Isoptères (termites) et certains Diptères Brachycères (Bombyliidae, Empidoidea). Je travaille majoritairement sur le registre fossile et notamment sur les ambres Crétacés (Myanmar et France) et Miocène (Chine et République Dominicaine). Je concentre également mes études sur la taxonomie des fourmis des territoires ultra-marins (Nouvelle-Calédonie et Guayne française). |
Bibliographie
- André E. (1889) : Hyménoptères nouveaux appartenant au groupe des Formicides. Revue d’Entomologie, 8: 217-231
- Antwiki. (2020a) : Ant Diversity of New Caledonia. Available from http://www.antwiki.org/wiki/Ant_Diversity_of_New_Caledonia
- Antwiki. (2020b) : Taxa described for year. https://www.antwiki.org/wiki/Category:Taxa_Described_for_Year
- Berman M. (2012) : Impacts of Anthropogenic Fires and Invasive Ants on Native Ant Diversity in New Caledonia: from Genes to Communities. PhD thesis, Université Montpellier 2, France and Charles Darwin University, Australia (lien)
- Berman M. & Andersen, A.N. (2012) : New Caledonia has a depauperate subterranean ant fauna, despite spectacular radiations above ground. Biodiversity and Conservation, 21: 2489-2497 (lien)
- Berman M. ; Andersen A.N. ; Hély C. & Gaucherel C. (2013a) : Overview of the distribution, habitat association and impact of exotic ants on native ant communities in New Caledonia. PLoS ONE, 8(6): e67245 (lien)
- Berman M. ; Andersen A.N. & Ibanez T. (2013b) : Invasive ants as back-seat drivers of native ant diversity decline in New Caledonia. Biological Invasions, 15: 2311-2331 (lien)
- Bharti H. ; Sharma Y. P. ; Bharti M. & Pfeiffer M. (2013) : Ant species richness, endemicity and functional groups, along an elevational gradient in the Himalayas. Asian Myrmecology, 5: 79-101 (lien)
- Brandão C. R. F. ; Diniz J. L. M. & Tomotake E. M. (1991) : Thaumatomyrmex strips millipedes for prey: a novel predatory behaviour in ants, and the first case of sympatry in the genus (Hymenoptera: Formicidae). Insectes Sociaux, 38: 335-344
- Emery C. (1883) : Alcune formiche della Nuova Caledonia. Bollettino della Società Entomologica Italiana, 15: 145-151
- Emery C. (1914) : Les fourmis de la Nouvelle-Calédonie et des îles Loyalty. Nova Caledonia. Forschungen in Neu-Caledonien und auf den Loyalty-Inseln. Recherches scientifiques en Nouvelle-Calédonie et aux îles Loyalty. A. Zoologie, 1: 393-437
- Forel A. (1894) : Quelques fourmis de Madagascar (récoltées par M. le Dr. Voltzkow) ; de Nouvelle Zélande (récoltées par M.W.W. Smith) ; de Nouvelle Calédonie (récoltées par M. Sommer) ; de Queensland (Australie) (récoltées par M. Wiederkehr) ; et de Perth (Australie occidentale) (récoltées par M. Chase). Annales de la Société entomologique de Belgique, 38: 226-237
- Gargominy O. & Bocquet A. (2013) : Biodiversité d’Outre-mer. UICN France, Paris et éditions Roger Le Guen – PANACOCO, Beaumont-de-Lomagne: 360 pp
- Nielsen M. G. (2011) : Ants (Hymenoptera: Formicidae) of mangrove and other regularly inundated habitats: life in physiological extreme. Myrmecological News, 14: 113-121 (lien)
- Robson S. (2010) : Ants in the intertidal zone: colony and behavioral adaptations for survival. In: Lach, L., Parr, C. L. & Abbott, Kirsti L. (eds.). Ant Ecology. Oxford University Press, Oxford: 185-186 (lien)
- Ward P.S. (1984) : A revision of the ant genus Rhytidoponera (Hymenoptera: Formicidae) in New Caledonia. Australian Journal of Zoology, 32: 131-175
Recommandations d’ouvrages sur cette thématique :
- Les Fourmis : Comportement, Organisation Sociale et Evolution
(Luc Passera et Serge Aron – Edition : Canadian Science Publishing – 480 pages – janvier 2005)
- Le monde des fourmis
(Rémy Chauvin – Edition du Rocher – 285 pages – 2 octobre 2003)
- Le monde extraordinaire des fourmis
(Luc Passera – Edition : Fayard – 235 pages – 13 mars 2008)
- Ant Ecology
(Catherine Parr ; Kirsti Abbott & Lori Lach – Edition : Oxford University press – 2010)
- Mutualism : Ants and their Insect Partners
(Bernhard Stadler & Tony Dixon – Edition : Cambridge University Press – 248 pages – 7 avril 2008)
- The Leafcutter Ants – Civilization by Instinct
(Bert Hölldobler & Edward O’Wilson – Edition W. W. Norton & Company – 192 pages – 26 octobre 2010)
- The Lives of Ants
(Laurent keller & Elisabeth Gordon – Edition OUP Oxford – 273 pages – 26 février 2009)