Par Benoît GILLES
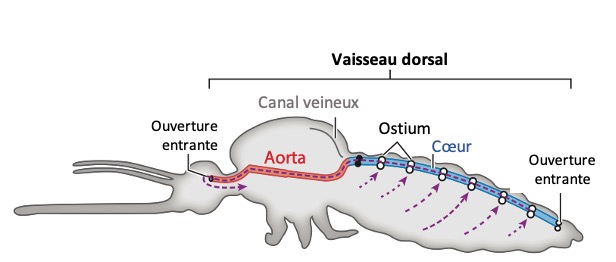
Chez les insectes, le système circulatoire se distingue de celui des vertébrés à la fois par sa morphologie et par son fonctionnement. Il assure le transport de l’hémolymphe (liquide circulatoire chez les arthropodes) à travers un réseau relativement simple, composé principalement d’un vaisseau dorsal linéaire antéro-postérieur situé juste sous l’exosquelette (figures 1 – 2 – 4 – 8 – video en bas de page).
Dans certains cas particuliers, comme chez les lépidoptères et certains hyménoptères, ce vaisseau s’enroule entre les muscles longitudinaux des ailes.
Il peut être soit fixé à la paroi dorsale du corps, soit suspendu à celle-ci par des filaments élastiques. À l’avant du corps, le vaisseau dorsal s’associe au tube digestif pour s’insérer entre le cerveau et l’œsophage. S’il est ouvert à l’avant, il est généralement fermé à l’arrière, à l’exception des larves d’éphémères (Éphéméroptères), chez lesquelles trois vaisseaux se ramifient vers les filaments caudaux depuis l’extrémité du cœur.
Ce vaisseau dorsal se divise en deux parties distinctes :
- Un cœur postérieur, dont la paroi est perforée par des ostiums, des orifices d’expulsion ou d’aspiration (figures 1 – 2 – 4)
- Une aorte antérieure, qui prolonge le cœur sous la forme d’un tube non perforé
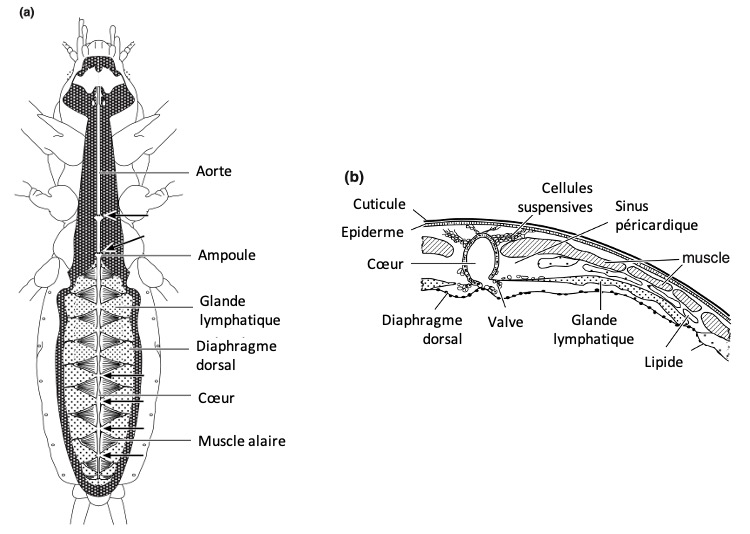
Le cœur est généralement confiné à l’abdomen, mais chez les blattes (Blattodea), il peut s’étendre jusqu’au prothorax. Chez les orthoptères, il présente une structure segmentée en raison de dilatations localisées en ampoules (canal dilaté) au niveau des ostiums (orifice ou court canal ouvrant l’accès à une cavité ou faisant communiquer deux cavités). Chez certaines larves, comme celles des libellules (Odonates) et des tipules (Tipula), il est compartimenté en plusieurs chambres par des valves positionnées en amont de chaque paire d’ostiums d’aspiration. Enfin, chez les larves de Cloeon (Éphéméroptères), les valves ostiales sont si allongées qu’elles se rejoignent, formant une paroi (septum) au centre du vaisseau.
La paroi du vaisseau dorsal, contractile, est généralement constituée d’une ou de deux couches de cellules musculaires disposées en cercle ou en spirale (figure 3). Des fibres musculaires longitudinales sont également présentes ; chez les Hétéroptères, elles s’insèrent dans la paroi du vaisseau en avant et en arrière et ne sont pas connectées aux autres tissus.
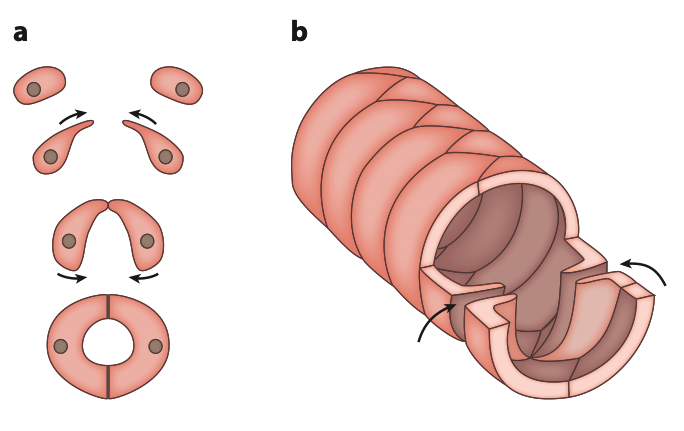
Le muscle cardiaque des insectes peut adopter différentes orientations, bien que cette diversité apparente soit parfois liée à l’insertion des muscles alaires sur le cœur (figure 1). Les muscles du vaisseau dorsal se caractérisent par des sarcomères courts (dispositif musculaire générateur de force ou porteur de charge), avec des bandes d’environ 2 µm de long. Chaque filament épais est entouré de 9 à 12 filaments fins, une organisation similaire à celle des muscles viscéraux.
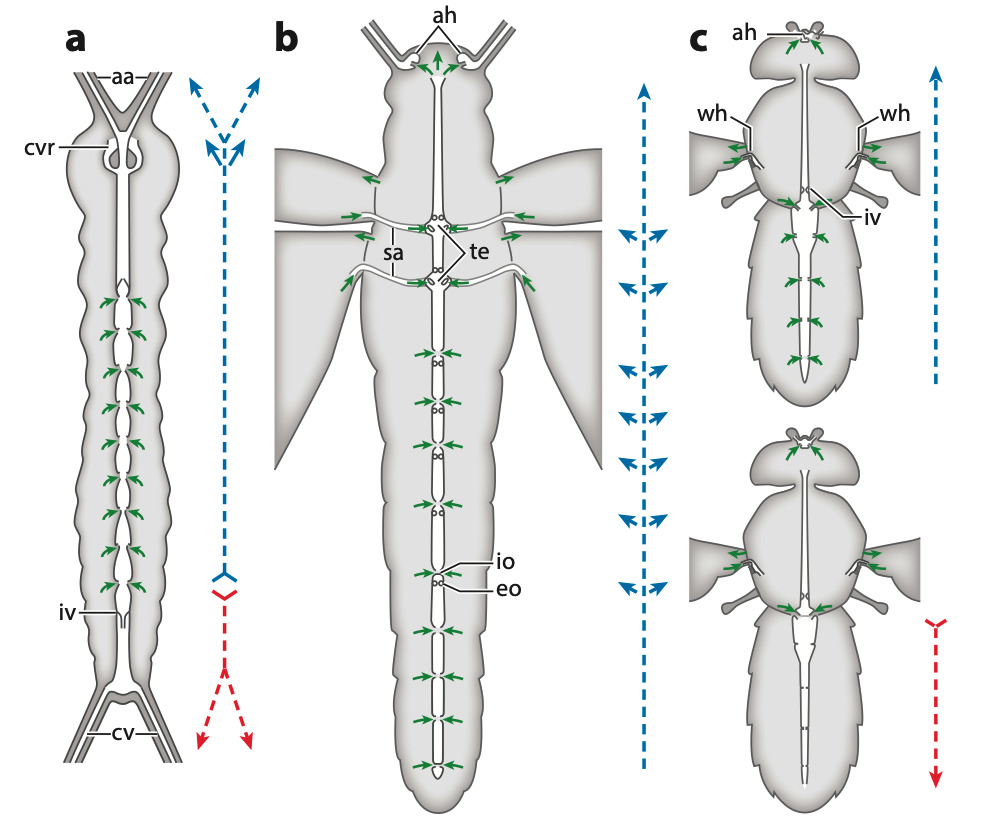
Abréviations : aa, artères antennaires ; ah, cœur antennaire ; cv, vaisseau cercal ; cvr, anneau vasculaire circumœsophagien avec ouverture ventrale ; eo, ostium à flux sortant ; io, ostium à flux entrant ; iv, valve intracardiaque ; sa, bras scutellaire ; te, élargissement thoracique du vaisseau dorsal ; wh, cœur alaire (Source : Hillyer & Pass, 2020)
Ces muscles sont enveloppés, à l’intérieur comme à l’extérieur, par une lame basale qui recouvre également les néphrocytes (cellules ayant un rôle dans l’excrétion). Les ostiums à flux entrants (afférent), qui permettent l’entrée de l’hémolymphe dans le cœur, sont des ouvertures en forme de fentes situées sur la paroi latérale du cœur. Un insecte peut en posséder jusqu’à 12 paires, réparties en neuf paires abdominales et trois paires thoraciques (figure 4).
Cette répartition varie selon les ordres :
- Blattodea et Orthoptera : 12 paires complètes
- Lépidoptères : généralement sept ou huit paires
- Hyménoptères aculéates (abeilles, guêpes, fourmis) : cinq paires
- Mouche (Musca) : seulement quatre paires
- Poux (Phthiraptera) et certains hétéroptères : deux à trois paires seulement, avec un cœur restreint aux segments abdominaux postérieurs.
Les ostiums possèdent deux lèvres, une antérieure et une postérieure, qui se rétractent vers le cœur pour former une valvule. Ce mécanisme permet l’entrée de l’hémolymphe lors de la diastole (expansion du cœur) tout en empêchant son reflux vers l’extérieur durant la systole (contraction) (figures 3 – 5 – 6). Lors de la diastole, la pression de l’hémolymphe entrante force les lèvres à s’écarter. Une fois cette phase terminée, la pression interne les referme, les maintenant closes jusqu’à la fin de la systole.
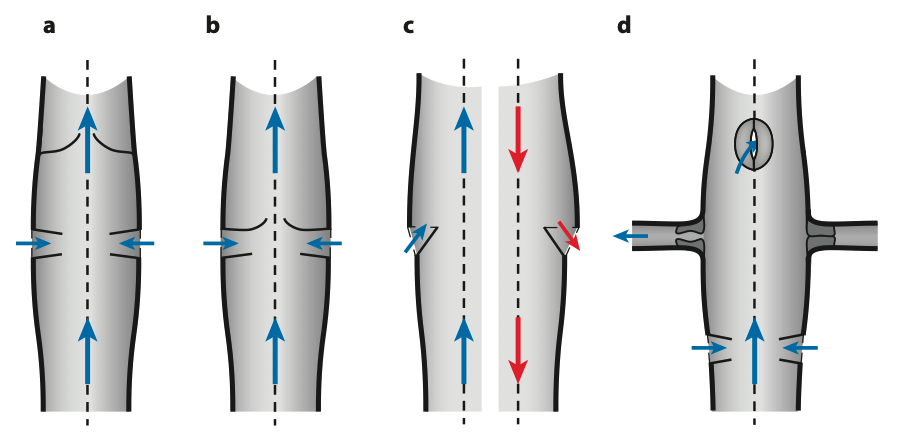
Chez certaines espèces, la structure de ces valvules varie :
- Chaoborus (mouches fantômes) : les valvules ont tendance à s’évaginer sous la pression exercée pendant la systole, mais une paroi unicellulaire interne empêche leur éversion complète (figure 6 (a))
- Bombyx mori (ver à soie) : seule la lèvre postérieure de chaque ostium se replie à l’intérieur du cœur (figure 2b). Lors de la systole, ce repli est plaqué contre la paroi cardiaque, empêchant toute fuite d’hémolymphe (figure 6 (b))
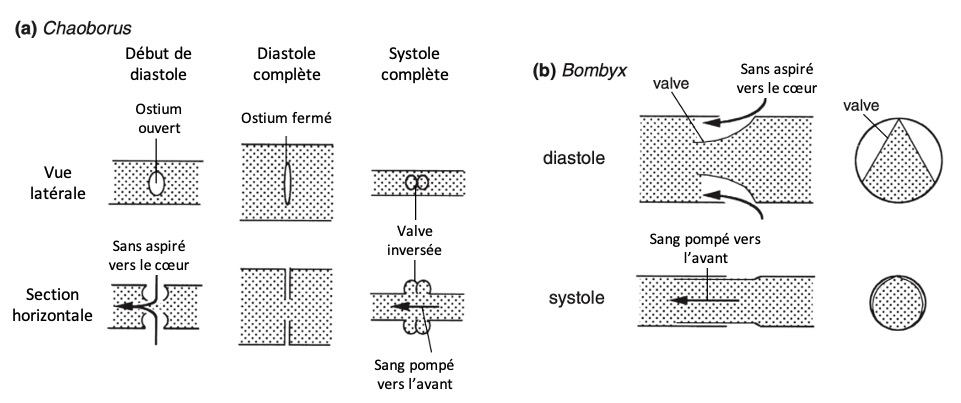
Lorsque le rythme cardiaque s’inverse (voir video ci-dessous), l’hémolymphe s’écoule via les ostiums afférents. En revanche, les ostiums à flux sortants (efférent) sont plus rares et ne se retrouvent que chez certains groupes d’insectes, notamment chez les Thysanoures (poissons d’argent), Orthoptères, Plécoptères et Embioptères. Leur disposition varie selon les ordres :
- Plécoptères et Embioptères : ostiums efférents impairs
- Orthoptères : paires d’ostiums ventro-latéraux sans valves internes, généralement cinq paires abdominales et deux thoraciques
- Blattodea et Mantodea : absence d’ostiums afférents ; l’hémolymphe s’évacue via des vaisseaux segmentaires latéraux
- Periplaneta (blatte) : cinq paires de vaisseaux segmentaires abdominaux chez les nymphes tardives, avec deux paires thoraciques supplémentaires à l’âge adulte (voir video ci-dessous)
- Mantes : uniquement des vaisseaux abdominaux, chacun équipé d’une valve musculaire unidirectionnelle
Les parois de ces vaisseaux segmentaires ne sont pas musculaires, ce qui limite ainsi leur rôle au simple transport de l’hémolymphe.
Chez la plupart des insectes, le cœur est innervé par des nerfs issus des ganglions segmentaires ventraux, qui longent la paroi corporelle. Dans plusieurs ordres, comme chez les Odonates, Blattodea, Phasmatodea, Orthoptères, les larves de Lépidoptères et certains Coléoptères adultes, ces nerfs segmentaires se regroupent pour former un nerf cardiaque latéral, qui court de chaque côté du cœur.
Chez Locusta, par exemple, des groupes de neurones situés sur la ligne médiane de chaque ganglion abdominal envoient des axones vers le cœur. De plus, une paire de cellules neurosécrétrices du ganglion sous-œsophagien projette un axone vers l’avant, à travers le conjonctif circumœsophagien, et un autre vers l’arrière, le long du cordon nerveux ventral. Ce dernier se ramifie à chaque ganglion abdominal et donne naissance à un nerf latéral, qui s’étend dorsalement jusqu’au cœur. Ces branches, intégrées au nerf cardiaque latéral, présentent des terminaisons nerveuses dilatées (variqueuses), caractéristiques des cellules neurosécrétrices, qui libèrent un peptide de type FMRFamide (figure 7).
Les nerfs cardiaques latéraux reçoivent également l’innervation de neurones extra-ganglionnaires, situés à proximité du cœur, appelés neurones cardiaques. Periplaneta (blatte) en possède environ 32, dont certains sont neurosécréteurs.
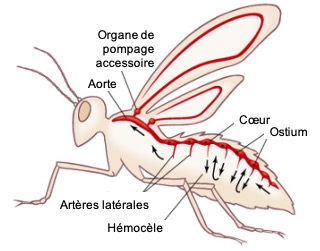
Chez la majorité des insectes holométaboles, les nerfs segmentaires atteignent directement le cœur sans former de nerfs cardiaques latéraux. Cependant, certaines exceptions existent : chez les moustiques Anopheles, le cœur ne reçoit aucune innervation directe, bien que des nerfs segmentaires soient connectés aux muscles alaires (figure 8).
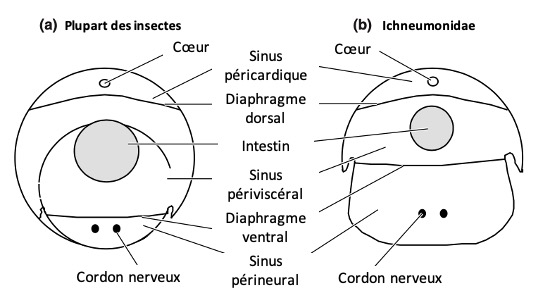
Sinus et diaphragmes
L’hémocèle (cavité interne où circule l’hémolymphe) de nombreux insectes est organisé en trois sinus principaux (figure 9) :
- Le sinus péricardique dorsal, situé juste sous le dos de l’insecte
- Le sinus périviscéral, occupant la majeure partie de la cavité corporelle
- Le sinus périneural ventral, localisé sous le cordon nerveux
Ces sinus sont séparés par deux diaphragmes : le diaphragme dorsal, qui délimite le sinus péricardique, et le diaphragme ventral, qui sépare le sinus périneural du sinus périviscéral. Chez la plupart des insectes, le sinus périviscéral domine en volume, mais il est particulièrement élargi chez les Ichneumonidés.
- Le diaphragme dorsal et les muscles alaires
Le diaphragme dorsal est une fine membrane conjonctive perforée, généralement incomplète sur ses parties latérales. Cette discontinuité permet au sinus péricardique, situé au-dessus, de rester en continuité avec le sinus périviscéral, situé en dessous. Les limites latérales du diaphragme sont délimitées par la présence de muscles, de trachées, ainsi que par l’insertion des muscles alaires, qui s’intègrent directement à cette structure.
Les muscles alaires, qui s’étendent transversalement sous le cœur, jouent un rôle dans la circulation de l’hémolymphe. Chez Hyalophora (un papillon), ces muscles sont directement connectés aux muscles cardiaques via des disques intercalaires. Ils prennent naissance sur le tergum (partie dorsale d’un segment), s’étalant en éventail pour se rejoindre en une large zone médiane (figure 9). Chez les sauterelles et certains Orthoptères, leur origine est plus large, et seule la partie proche de leur attache est contractile, le reste étant constitué de faisceaux conjonctifs qui se ramifient et s’anastomosent. Certaines de ces fibres forment un plexus reliant le diaphragme à la paroi cardiaque.
Le nombre de muscles alaires varie selon les ordres d’insectes :
- Orthoptères : jusqu’à dix paires abdominales et deux paires thoraciques
- Hétéroptères terrestres : entre 4 et 7 paires
- Chez d’autres insectes, leur nombre est réduit
D’un point de vue structurel, les muscles alaires sont des muscles viscéraux, composés d’environ 10 à 12 filaments fins pour chaque filament épais.
- Le diaphragme ventral et sa variabilité
Le diaphragme ventral est un septum horizontal (structure anatomique faite d’un tissu dense formant une cloison séparant deux cavités), situé juste au-dessus du cordon nerveux ventral, séparant le sinus périneural du sinus périviscéral (figure 9). Sa présence varie selon les groupes d’insectes et leur stade de développement :
- Il est présent chez les larves et adultes des Odonates, Blattodea, Orthoptères, Neuroptères (chrysopes) et Hyménoptères
- Il apparaît uniquement chez les adultes chez les Mécoptères (mouches-scorpions), Lépidoptères et Diptères nématocères
- Chez les Lépidoptères, le cordon nerveux est relié à la face ventrale du diaphragme par du tissu conjonctif
Généralement, ce diaphragme est limité à l’abdomen, mais chez certaines sauterelles et hyménoptères, il s’étend aussi jusqu’au thorax.
Sa structure varie selon les espèces :
- Chez les sauterelles, il s’agit d’une membrane mince et peu musclée
- Chez d’autres insectes, il peut être une membrane musculaire solide
- Latéralement, il se relie aux sternites, formant de larges ouvertures qui assurent la continuité entre les sinus périviscéraux et périneuraux
Son organisation évolue également au cours du développement : chez les Corydales (Neuroptera), il est solide chez la larve, mais devient fenêtré chez l’adulte.
Organes pulsatiles accessoires
Les insectes possèdent plusieurs structures pulsatiles facilitant la circulation de l’hémolymphe, en particulier dans les appendices tels que les ailes, les pattes, les antennes et, chez les femelles, l’ovipositeur (figures 10 – 11 – 12)
- Les organes pulsatils des ailes
Chez la plupart des insectes adultes, un organe pulsatile spécifique assure l’irrigation des ailes en hémolymphe. Il est généralement présent dans les deux segments alaires, sauf chez les Diptères et les Coléoptères Polyphaga, où il est limité au mésothorax.
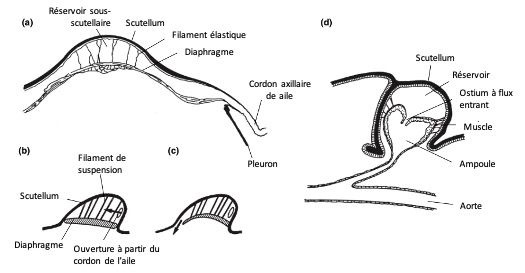
Cet organe comprend :
- Un réservoir hémolymphatique (ou espace de stockage) situé sous la partie postérieure du tergum (scutellum). Ce réservoir est isolé partiellement ou totalement du reste de l’hémocèle thoracique
- Une connexion avec les veines postérieures des ailes via le cordon axillaire
- Une pompe musculaire, formée par la paroi ventrale du réservoir, qui peut être une extension du cœur ou une structure indépendante (figure 10)
- Mécanisme de pulsation
Le fonctionnement de cet organe pulsatile varie selon les groupes d’insectes :
- Chez les insectes holométaboles et les Hémiptères
Un diaphragme musculaire indépendant du cœur entoure le réservoir sous-scutellaire sur sa face ventrale, relié au scutellum par plusieurs filaments élastiques (figure 10a-c). La contraction des muscles (commandée par la moelle nerveuse ventrale) aplatit le diaphragme, aspirant l’hémolymphe des ailes vers le réservoir.
Lors de la relaxation musculaire, le diaphragme remonte, probablement sous l’effet de l’élasticité des filaments, refoulant l’hémolymphe dans la cavité corporelle (figure 10b-c).
- Chez les insectes hémimétaboles (hors Hémiptères), les Coléoptères et les Hyménoptères symphytes
L’organe pulsatile alaire est une expansion du vaisseau dorsal, formant un diverticule. Il possède une paire d’ostiums afférents s’ouvrant depuis le réservoir sous-scutellaire.
- Chez les Odonates
Chaque segment du ptérothorax contient une ampoule pulsatile, reliée à l’aorte par un vaisseau étroit (figure 10d). Cette ampoule est suspendue au tergum par des ligaments élastiques et possède une paroi dorsale musclée. Lors de la contraction musculaire, l’ampoule est comprimée, refoulant l’hémolymphe dans l’aorte.
Simultanément, le volume du réservoir sous-scutellaire augmente, ce qui aspire l’hémolymphe depuis les ailes :
- Les veines postérieures assurent le flux afférent (vers l’ampoule)
- Les veines antérieures assurent le flux efférent (depuis l’ampoule vers la circulation générale)
- Lors de la relaxation musculaire, les ligaments élastiques restaurent la forme de l’ampoule, permettant ainsi l’aspiration de l’hémolymphe depuis le réservoir
- Les organes pulsatiles antennaires et leurs mécanismes
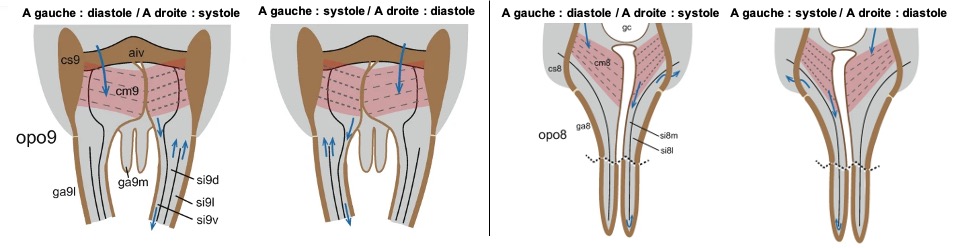
Les insectes possèdent un organe pulsatile à la base de chaque antenne, permettant d’assurer la circulation de l’hémolymphe. Cet organe se présente sous la forme d’une ampoule, reliée à un fin tube qui s’étend presque jusqu’à l’extrémité de l’antenne.
Variations selon les groupes d’insectes
- Thysanoures (poissons d’argent), Archéognathes (perce-oreilles) et certains Plécoptères : leurs ampoules sont dépourvues de muscles. Elles servent uniquement à diriger le flux d’hémolymphe depuis l’ouverture de l’aorte vers l’antenne
- Chez la plupart des insectes : les ampoules sont munies de muscles dilatateurs. La compression de l’ampoule, qui propulse l’hémolymphe dans l’antenne, est assurée par l’activité de filaments élastiques situés de part et d’autre de sa paroi
- Cas particulier des Dermaptères (perce-oreilles) : ce sont les seuls insectes à posséder des muscles compresseurs au niveau des ampoules
- Chez la les blattes du genre Periplaneta : un muscle unique relie les deux ampoules antennaires. Lorsqu’il se contracte, il provoque la dilatation simultanée des deux ampoules, permettant ainsi l’entrée de l’hémolymphe par un ostium (figure 12e–g – vidéo ci-dessus). Ces contractions sont d’origine myogénique (capable de se contracter sans stimulation nerveuse), mais peuvent être modulées par des signaux nerveux, en raison de la présence de terminaisons nerveuses dans le muscle
La majorité des terminaisons nerveuses sont concentrées dans l’ampoule, qui pourrait ainsi jouer un rôle de centre neurohémal (organe ou aire dans lequel coexistent les nerfs et la circulation sanguine ou hémolymphatique). Les axones responsables de cette activité prennent naissance dans le ganglion sous-œsophagien et proviennent :
- D’un neurone médian dorsal unique
- D’une paire de somates situés latéralement
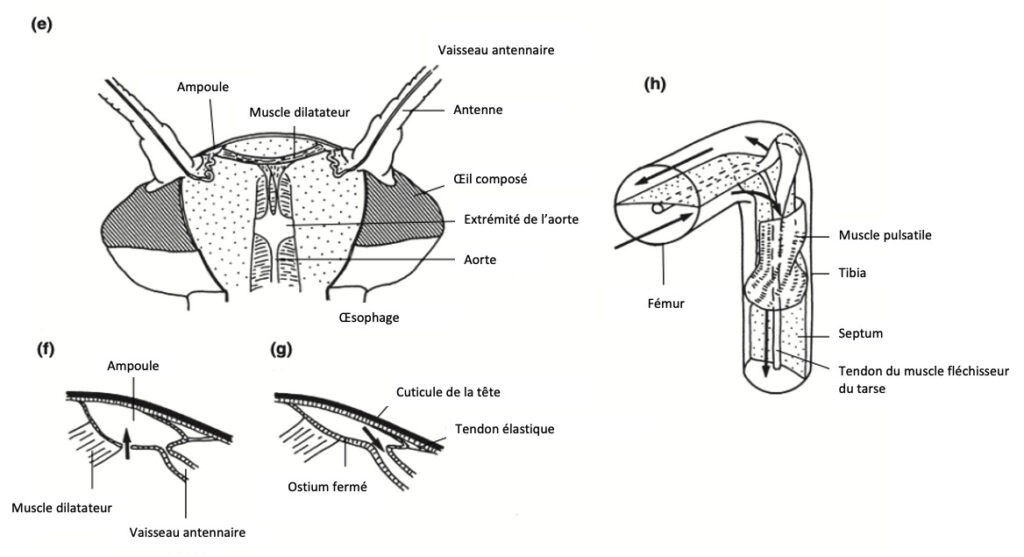
L’aorte et les vaisseaux antennaires chez les Lépidoptères
Chez les Lépidoptères, l’aorte se termine antérieurement par un sac, à partir duquel émergent les vaisseaux antennaires, participant à la circulation de l’hémolymphe dans les antennes.
La circulation hémolymphatique dans les pattes
La plupart des insectes possèdent, au niveau des pattes, un septum longitudinal divisant leur lumière interne en deux sinus, permettant ainsi un flux bidirectionnel de l’hémolymphe.
Chez les Hémiptères : le septum subit une torsion de 90° à l’extrémité proximale du tibia. À cet endroit, on trouve un muscle spécifique (figure 12h) qui, lorsqu’il se contracte compresse un sinus, forçant l’hémolymphe à remonter vers le thorax. Simultanément, il élargit l’autre sinus, facilitant ainsi l’aspiration de l’hémolymphe dans la patte.
L’activité de ce muscle est probablement myogénique (capable de se contracter sans stimulation nerveuse), bien qu’elle puisse être modulée par le système nerveux.
Certains insectes, dotés de cerques particulièrement longs, nécessitent des adaptations spécifiques pour assurer la circulation de l’hémolymphe. Chez les éphéméroptères, de petits vaisseaux non contractiles s’étendent depuis l’extrémité postérieure du cœur jusqu’aux cerques, facilitant ainsi le flux hémolymphatique.
En revanche, chez les plécoptères, bien que des vaisseaux hémolymphatiques soient également présents dans les cerques, ils ne sont pas directement reliés au cœur. Ils s’ouvrent dans la cavité périviscérale, tandis que la lumière cercale reste connectée à cette cavité via le paraprocte (plaque ventro-latérale de l’extrémité de l’abdomen). Les variations de volume du paraprocte, générées par un petit muscle, permettent d’aspirer l’hémolymphe depuis la lumière externe du cerque et de la refouler dans la cavité périviscérale, assurant ainsi une circulation continue du fluide biologique.
Bibliographie
- The Insects – Structure and Fonction – Cambridge University Press – Chapman – 2013 – 5ème édition
- Hustert R. ; Frisch M. ; Böhm A. & Pass G. (2014) : A new kind of auxiliary heart in insect : functional morphology and neuronal control of the accessory pulsatile organs of the cricket ovipositor. Frontiers in Zoology, 11,43 (lien)
- Hillyer J. & Pass G. (2020) : The insect circulatory system : structure, function and evolution. Annual Review of Entomology, 65:121-143 (lien)

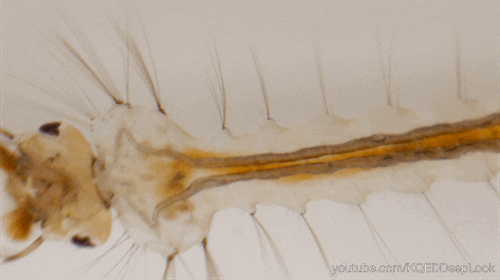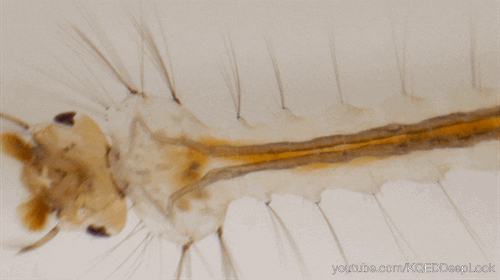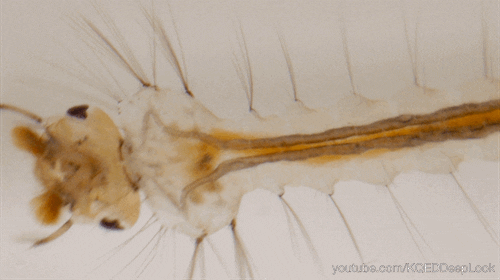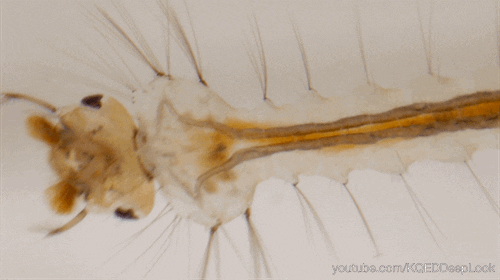

J’imagine que les liquides réagissent différemment dans le cerques d’un éphémère que dans nos grosses veines humaines.
Y a-t-il des différences entre les circulations de flux entre une échelle humaine et une échelle entomologique ?
Je pense notamment à la tension superficielle qui est une force importante à de très petites échelles.
Est-ce que la tension superficielle de l’émolymphe joue un rôle, ou au contraire est-elle contraignante dans sa circulation ?
Il mieux de classé les insectes primitive dans l’ordre de hyménoptères.