Par Etienne Herrbach
Si l’on entend parler d’insectes vecteurs d’agents pathogènes, aussitôt pense-t-on aux moustiques et autres vecteurs de maladies humaines (fièvre jaune, paludisme etc.). Certes, ce sont des sujets majeurs en médecine. Toutefois, beaucoup ignorent que des vecteurs de maladies de plantes existent aussi et s’avèrent même très nombreux et souvent préoccupants (Mulot et al., 2020).
Ainsi, en phytopathologie, un « vecteur » est un organisme vivant capable de transmettre un virus (ou une bactérie) pathogène d’une plante à une autre. Le pathogène est retenu spécifiquement dans l’organisme vecteur avant d’infecter une nouvelle plante, ce qui distingue un vecteur d’un simple disséminateur passif. Le virus et la plante étant par nature immobiles, l’action d’un vecteur est le plus souvent indispensable au virus pour pouvoir atteindre son hôte, c’est la ‘transmission horizontale’. Toutefois, certains virus sont transmis par la graine et la majorité par la multiplication végétative, c’est la « transmission verticale ».
Quels insectes sont des vecteurs de virus de plante, ou phytovirus ?

Il n’est guère étonnant que les vecteurs de phytovirus, se recrutent essentiellement parmi les Hémiptères phytophages à appareil buccal piqueur-suceur ou stylets (pucerons [lien et lien], aleurodes, cochenilles, cicadelles et familles apparentés, punaises), auxquels s’ajoutent les thrips (Thysanoptères) (figure 1).
En effet, ces insectes se nourrissent de sucs végétaux : ce sont des phloémophages (ingérant la sève élaborée), parfois des xylémophages (suçant la sève brute), mais aussi des « videurs » de cellules, en particulier épidermiques (cas des thrips). Le caractère piqueur du vecteur permet en outre de faire franchir au virus la cuticule végétale et les parois cellulaires. Toutefois, certains coléoptères, à pièces buccales broyeuses, sont aussi des vecteurs de virus, selon des mécanismes encore peu connus.
Outre les insectes, des acariens, des nématodes et même quelques champignons et protistes peuvent transmettre des phytovirus
Le processus de la transmission
Le processus de vection commence avec une phase d’acquisition (le vecteur prélève des particules virales dans son hôte) et une phase d’inoculation (il inocule le virus à une plante). Ces phases sont séparées par une phase de latence (le vecteur n’est pas encore capable d’inoculer le virus) et suivies d’une phase d’infectivité (durée pendant laquelle le vecteur reste infectieux, c’est-à-dire peut inoculer le virus qu’il a retenu).
Les modes de transmission
La biologie de la vection virale a surtout été étudiée chez les pucerons (Aphididae), qui est le groupe ayant le plus d’espèces vectrices et transmettant le plus d’espèces virales. Dès les années 1950, les chercheurs ont montré l’existence de deux modes de vection distincts chez les pucerons. Toutefois, les autres insectes piqueurs-suceurs suivent des modes similaires.
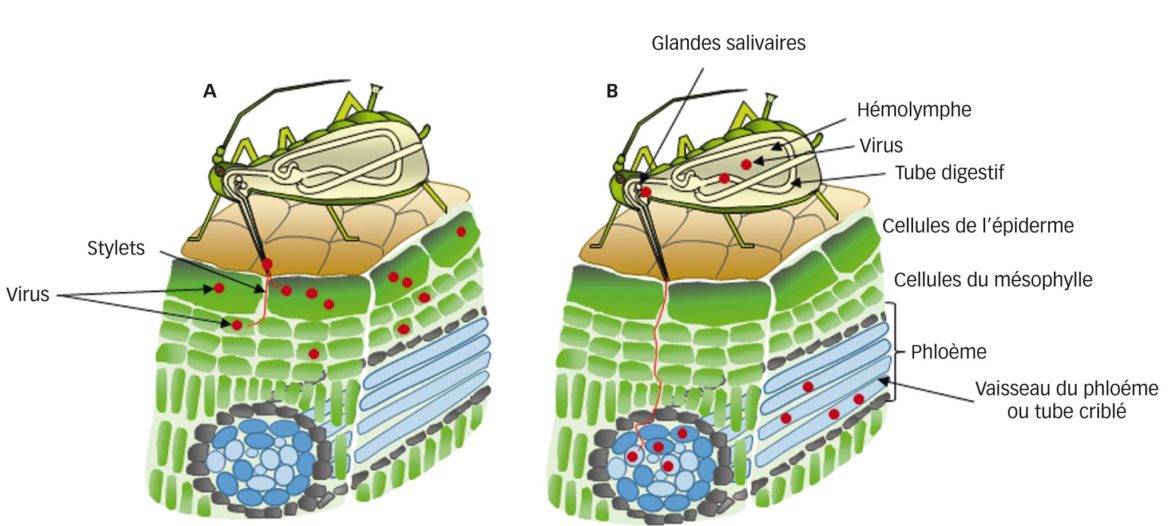
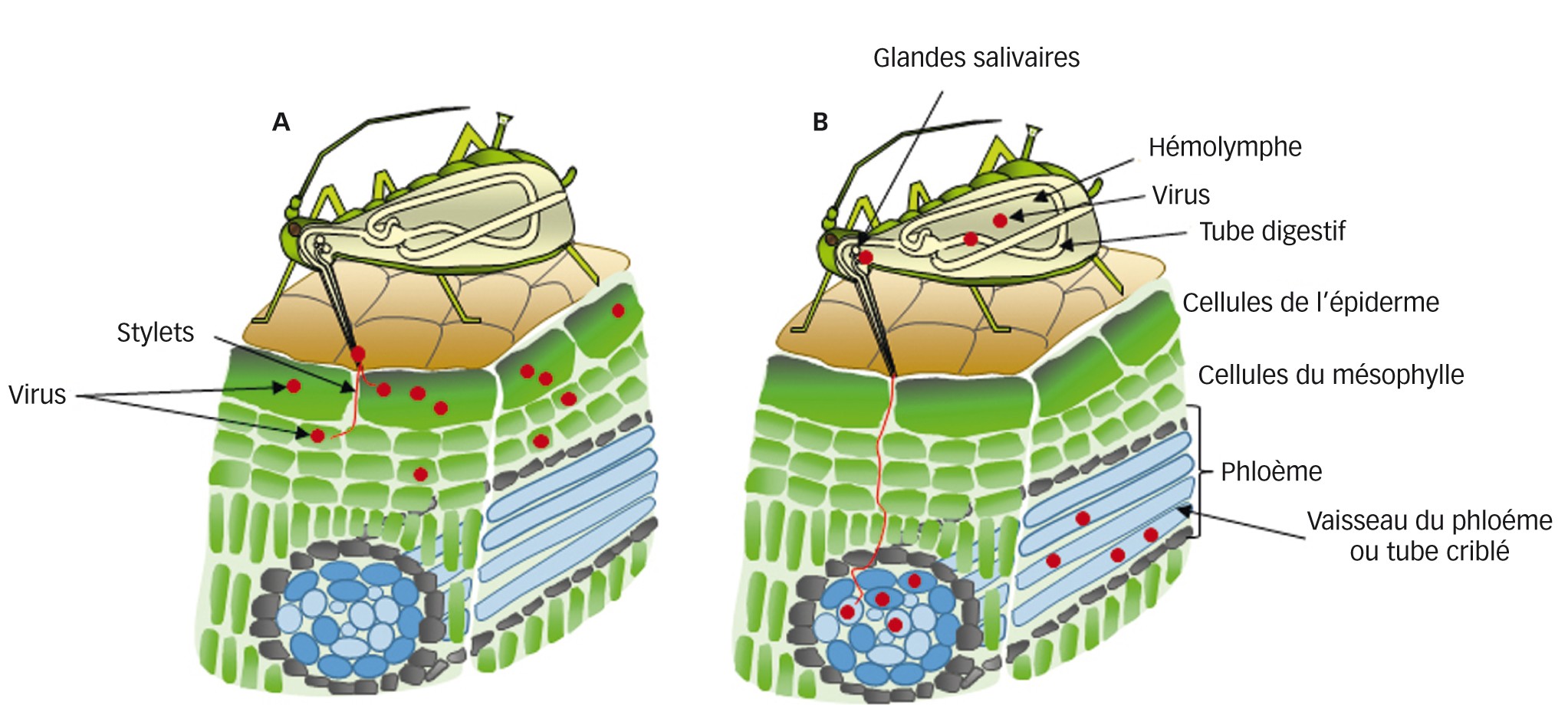
- Le mode non-persistant ou non-circulant : le vecteur peut acquérir et inoculer les particules lors de piqûres brèves (secondes à minutes) ou « piqûres d’essai », dans l’épiderme ; la latence est quasi-nulle et l’insecte perd son infectivité lors de la mue. Chez le puceron, les piqûres d’essai le renseignent sur la qualité d’hôte ou non de la plante, avant de s’y installer ou de la quitter. L’on sait à présent que les particules sont retenues au niveau des stylets à des récepteurs spécifiques. Certains virus sont retenus directement à la cuticule des stylets (« stratégie capside ») et d’autres nécessitent un « pont » moléculaire entre la particule et la cuticule (« stratégie helper »), ce pont étant formé par un (ou deux) peptide(s) virocodé(s), le(s) facteur(s) helper ou assistant(s), acquis par le vecteur en même temps que les particules (figure 2A)
- Le mode persistant ou circulant : le vecteur acquiert et inocule le virus lors de piqûres d’ingestion longues dans le phloème, ce que le vecteur n’effectue que sur ses plantes-hôtes. La latence est de quelques heures à jours, durée nécessaire aux particules ingérées pour traverser l’épithélium intestinal puis celui des glandes salivaires, d’où elles sont inoculées avec la salive ; c’est pourquoi l’infectivité est conservée lors de la mue (passage transstadial). Dans ce mode, le virus ne se réplique généralement pas dans le vecteur ; néanmoins, la réplication virale existe dans certaines associations virus–vecteur – on parle alors de mode persistant-multipliant (figure 2B)
Plus tard a été décrit le mode semi-persistant, dans lequel les particules sont acquises et inoculées lors de piqûres phloémiennes (à l’instar du mode persistant) et retenues dans niveau de la cavité buccale du vecteur, sans passage par un épithélium (comme pour le mode non-persistant).
Études actuelles en biologie de la vection
Une littérature scientifique foisonnante existe sur les propriétés de la vection entomophile de phytovirus. Les études mécanistiques actuelles portent sur les interactions moléculaires et cellulaires entre virus et vecteur, la « manipulation » par le virus du comportement du vecteur et la recherche de cibles pour inhiber la transmission.
– Interactions moléculaires : la séquence nucléique, et donc le peptide structural porté par la particule, impliqués dans le mécanisme de reconnaissance virus–vecteur sont identifiés dans de nombreux cas. En revanche, il n’en est pas de même du site récepteur chez le vecteur. Ainsi, chez des virus à vection persistante, la particule est reconnue par des récepteurs intestinaux, dont une aminopeptidase chez l’énamovirus Pea enation mosaic virus-1 (Linz et al., 2015) et le récepteur de l’éphrine chez le polérovirus Turnip yellows virus (Mulot et al., 2018), et d’autres peptides potentiels sont en cours de validation. Quant à la vection non-persistante, les études ont montré que les particules de potyvirus sont retenues dans une zone précise des stylets, appelée « acrostyle », et qui se lie au facteur helper qui lui-même retient la particule (Uzest et al., 2010). L’acrostyle est composé de peptides, les « stylines », agissant comme récepteurs viraux (Webster et al., 2018).
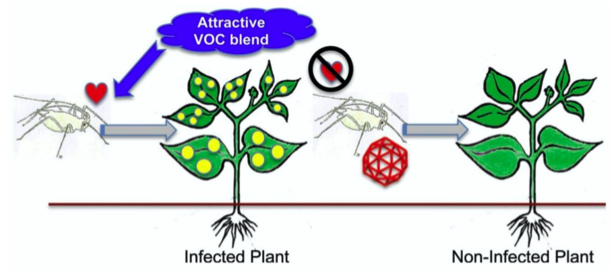
– « Manipulation » virale : quoique signalé dès 1951, ce phénomène biologique fait l’objet de très nombreux travaux cette dernière décennie (Mauck & Chesnais, 2020). L’infection virale modifie le phénotype et la physiologie de la plante infectée et, par suite, le comportement et la physiologie du vecteur. Ainsi, les symptômes de jaunissement foliaire induits par certains virus peuvent attirer le vecteur ailé, de même que la modification des stimuli olfactifs. De plus, nombre de virus augmentent la teneur en sucre et d’autres nutriments, ce qui favorisent la fitness des vecteurs. Enfin, il a été montré que, si un vecteur non porteur de virus (avirulifère) est attiré par une plante virosée, un vecteur virulifère préfère une plante saine, selon des mécanismes encore obscurs.
Tout cela démontre une longue co-évolution entre virus, vecteur et plante, au bénéfice du virus, d’où le terme de « manipulation »
Études en épidémiologie des virus à transmission vectorielle
Les travaux en épidémiologie s’attachent à comprendre la dispersion des vecteurs et des virus dans les agroécosystèmes, afin de mieux protéger les cultures contre les viroses. Selon le vecteur et sa biologie, le(s) virus, le mode de transmission, la culture (pérenne ou annuelle, sensible ou non), la région, la présence d’hôtes alternatifs dans le paysage, etc., le déroulement épidémique va largement différer (figure 3).
Au-delà des études purement descriptives, nombre de travaux actuels visent à comprendre et à prévoir l’arrivée et le développement des épidémies virales, en particulier par la modélisation mathématique et l’intelligence artificielle (cf. la revue de Jeger, 2020).
Importance de la vection de virus en agriculture
La production végétale mondiale paie un très lourd tribut aux phytovirus (près d’un millier d’espèces connues) (Herrbach & Chesnais, 2021), surtout à ceux liés à des insectes vecteurs propageant le pathogène au sein des cultures et entre cultures, parfois éloignées. Les dommages occasionnés peuvent encore s’accentuer avec les échanges internationaux de matériel végétal et l’évolution climatique, ce qui impacte les aires de répartition des virus et des vecteurs (exemple du Puceron cendré).
Étant donné que les plantes ne guérissent pas une fois infectées par un virus, l’enjeu agronomique est d’en empêcher l’infection. La lutte contre le vecteur peut faire appel à l’emploi d’insecticides, à l’utilisation d’ennemis naturels, ou à des pratiques culturales telles que l’attraction hors des cultures (stratégie du « push-pull »). Par ailleurs, la résistance variétale au virus, voire au vecteur, sont utilisées pour nombre de cultures, mais pour d’autres aucune source de résistance n’est connue chez les parents sauvages.
Les travaux en cours et à venir sur la biologie de la vection et l’épidémiologie des virus transmis par insectes ouvriront sans nul doute de nouvelles pistes de phytoprotection, telles celle d’une inhibition moléculaire de l’interaction virus–vecteur (Tech & Brault, 2018)
Bibliographie
- Hech M. & Brault V. (2018) : Targeted disruption of aphid transmission: a vision for the management of crop diseases caused by Luteoviridae members. Current Opinion in Virology 33:24-32 (lien)
- Jeger M.J. (2020) : The epidemiology of plant virus disease: Towards a new synthesis. Plants 2020, 9, 1768 (lien)
- Linz, L.B. ; Liu, S. ; Chougule, N.P. & Bonning, B.C. (2015) : In vitro evidence supports membrane alanyl aminopeptidase N as a receptor for a plant virus in the pea aphid vector. J. Virol. 89, 11203–11212 (lien)
- Mauck K.E. & Chesnais Q. (2020) : A synthesis of virus-vector associations reveals important deficiencies in studies on host and vector manipulation by plant viruses. Virus Research 285: 197957 (lien)
- Mulot M. ; Monsion B. ; Boissinot S. ; Rastegar M. ; Meyer S. ; Bochet N. & Brault V. (2018) : Transmission of Turnip yellows virus by Myzus persicae is reduced by feeding aphids on double-stranded RNA targeting the ephrin receptor protein. Front. Microbiol. 9:457 (lien)
- Uzest M. ; Gargani D. ; Dombrovsky A. ; Cazevieille C. ; Cot D. & Blanc S. (2010) : The “acrostyle”: A newly described anatomical structure in aphid stylets. Arthropod Structure & Development 39: 221-229 (lien)
- Webster CG. ; Pichon E. ; van Munster M. ; Monsion B. ; Deshoux M. ; Gargani D. et al. (2018) : Identification of plant virus receptor candidates in the stylets of their aphid vectors. J. Virol. 92: e00432-18 (lien)