Par Paul Clémençon
Cet article est la suite de l’article sur la navigation spatiale chez les insectes : https://planet-vie.ens.fr/thematiques/ecologie/ethologie/s-orienter-vers-la-bonne-route-la-navigation-spatiale-chez-les. Il se compose de deux parties : une partie sur l’écologie des jeux proies-prédateurs, et une autre sur des aspects plus neuroéthologiques de l’évasion. Certains Arachnides (qui ne sont certes pas des insectes) seront mentionnés dans cette partie.
Les interactions proies-prédateurs sont répandues dans la culture populaire, et fascinent par la grande diversité d’innovations évolutives dans la course aux armements proies-prédateurs. Certaines font l’objet de plusieurs documentaires spectaculaires sur la BBC, et d’autres ont inspiré de nombreuses scènes de films et jeux vidéos.
Les insectes, pour leurs avantages expérimentaux, offrent une bonne porte d’entrée pour l’étude des interactions proies-prédateurs ainsi que les bases neurales du comportement d’évasion. Les réponses d’évasion sont facilement élicitables, robustes, soumises à des contraintes de parcimonie neuronale, mais ne sont pas figées pour autant (1). Elles offrent un cadre scientifique permettant d’étudier des questions comme le decision-making ou la sélection d’action parmi un répertoire d’actions comportementales. L’évasion offre également la possibilité d’avoir une riche approche comparative, c’est-à-dire comprendre comment un même problème est résolu par différentes espèces dans des niches écologiques variées, de la détection et l’identification de la menace au choix de l’action comportementale appropriée.
La compréhension des mécanismes d’évasion inspire les ingénieurs pour développer de nouvelles technologies, et est cruciale pour prédire l’évolution des relations proies-prédateurs suite aux pressions anthropiques.
I – Écologie des jeux de cache-cache et de course-poursuite entre prédateurs et proies
Dans cet article, nous nous focaliserons plus sur l’échelle de l’individu que sur l’échelle macroécologique. Lorsque l’on parle d’interactions proies-prédateur, on pense souvent en premier lieu aux aspects de course-poursuite (défenses secondaires), mais il ne faut pas oublier les lignes de défenses primaires en amont. Les lignes de défenses, primaires ou secondaires, peuvent être actives ou passives (nécessitent ou non la présence de comportement « actif »).
Les interactions proies-prédateurs peuvent être décomposées en deux parties (figure 1): une phase de cache-cache, et une phase de course-poursuite. Cette séquence peut ensuite se répéter (2). Un exemple illustratif est décrit en détail par Fabre : lorsqu’une araignée est attaquée par une guêpe maçonne, elle tombe au sol (course-poursuite), échappant quelque temps à la prédation. La guêpe inspecte attentivement les alentours (cache-cache) avant de retrouver l’araignée. Cette dernière court (course-poursuite), pour échapper à la guêpe, et la séquence peut se répéter plusieurs fois (3).
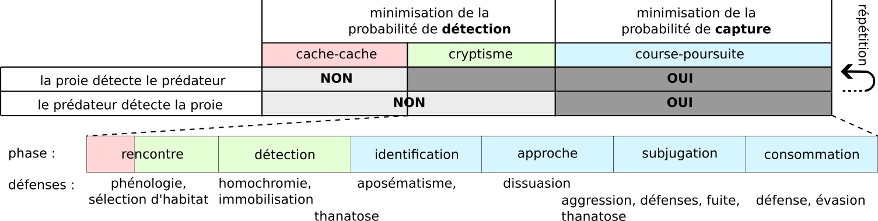
A) Cache-cache
Dans un jeu de cache-cache entre proie et prédateur, on modélise souvent la proie comme un agent cherchant à minimiser la probabilité de détection. Différentes stratégies minimisent cette probabilité (5). On peut citer notamment la sélection d’habitats complexes et difficiles d’accès pour le prédateur (galles, refuges), des phénologies particulières, l’évitement des zones de prédation (les grillons percevant l’odeur d’araignées changent de zone) (6) ou encore l’homochromie, parfois combinée à des couleurs voyantes. Les criquets Oedipoda sont par exemple bien camouflés dans l’environnement, leur corps prenant un ton ocre rappelant la couleur des sentiers de cailloux.
De plus, leurs ailes postérieures (visibles seulement lorsque l’insecte saute) présentent des couleurs vives. Cela augmente l’efficacité du camouflage, le prédateur devant changer d’objet visuel à chercher, et cela limite la persistance des attaques en limitant la probabilité de détection.
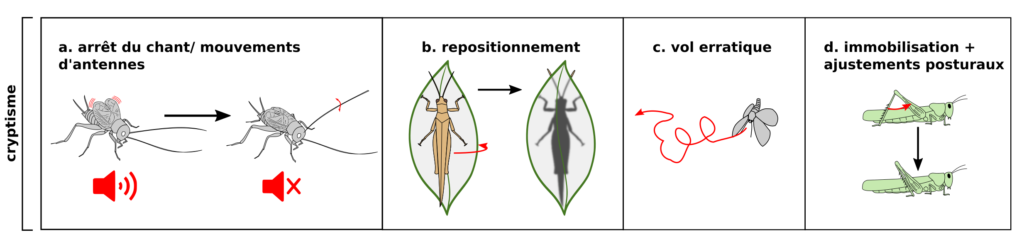
Dans le cas précis où la proie perçoit la présence du prédateur, mais où le prédateur ne perçoit pas la présence de la proie (jeu de cryptisme), certaines modifications du comportement ont été décrites. On peut citer l’arrêt du chant des Orthoptères (figure 2a) (7), le repositionnement derrière une feuille (figure 2b), le vol erratique des papillons de nuit (figure 2c), certains mouvements pour augmenter l’efficacité du camouflage (oscillations chez les phasmes) ou des comportements d’immobilisation et d’alerte qui diminuent la probabilité de détection (figure 2d) et augmentent l’attention.
Il faut noter que la détection du prédateur n’entraîne pas automatiquement une réponse de fuite chez la proie. L’évasion présente de nombreux coûts en terme de fitness : réduction du temps passé à s’approvisionner ou à rechercher un partenaire. Certains modèles soulignent également la perte de l’effet de surprise ainsi que d’avantages tactiques si la proie s’enfuit trop tôt (8).
Lorsque la proie est détectée, le prédateur ne lance pas systématiquement une attaque, la proie pouvant dissuader le prédateur.
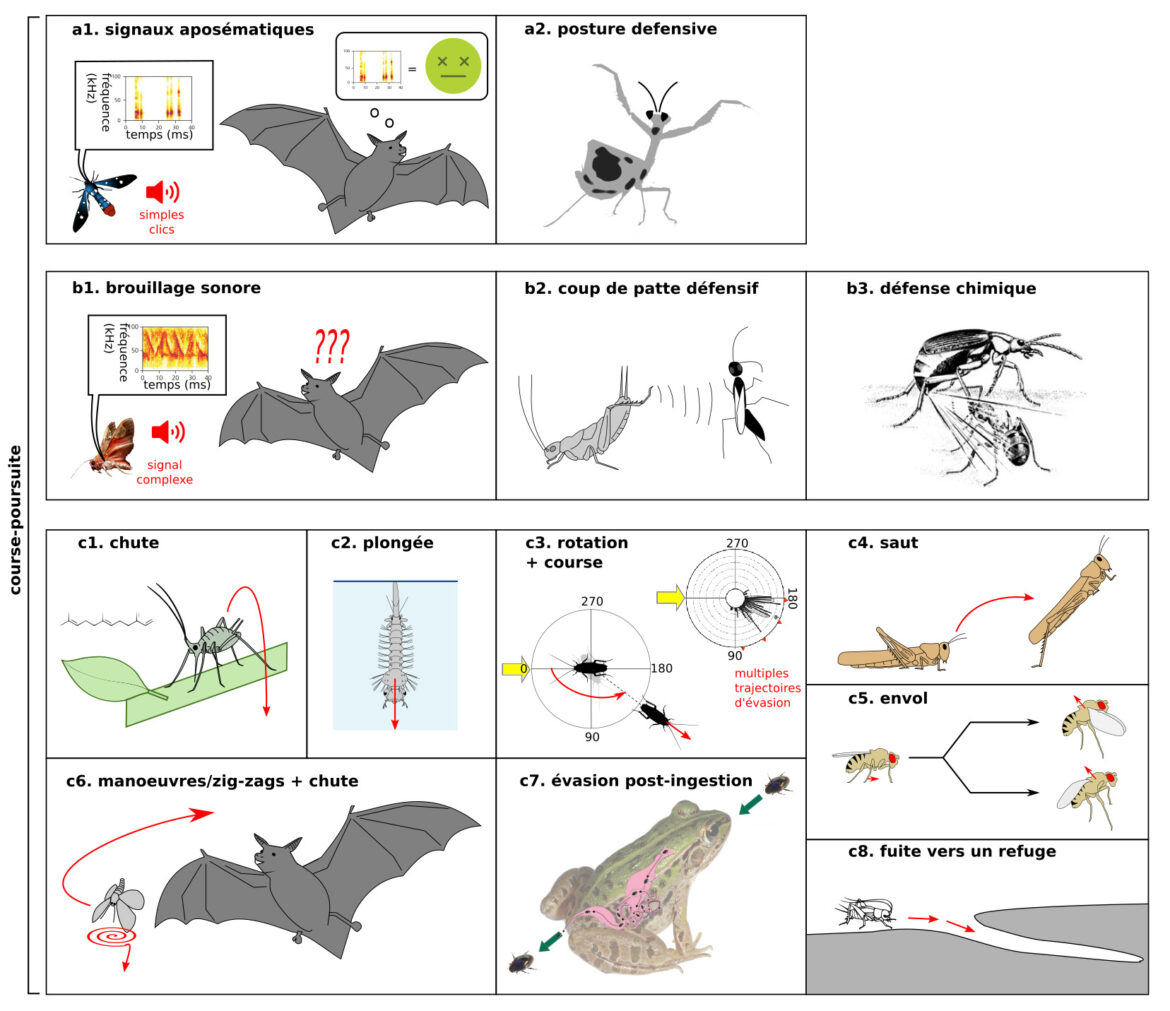
Certains signaux, structures ou comportements indiquent un danger. Les mantes présentent une posture menaçante (figure 3b), les Apocrites présentent un aiguillon, parfois couplé à une glande à venin, d’autres insectes présentent des épines ou autres structures de défense, plusieurs papillons ont des motifs en forme « yeux » pour effrayer le prédateur, … Certains insectes présentent des signaux aposématiques (couleurs vives, clics par les organes tympanaux chez les papillons de nuit destinés aux chauve-souris, figure 3a) qui indiquent un mauvais goût (9). Lorsque plusieurs espèces toxiques présentent les mêmes signaux (comme chez les papillons Heliconius), on parle de mimétisme mullérien. A l’inverse, certaines espèces inoffensives imitent des espèces toxiques, on parle de mimétisme batésien.
D’autres structures, signaux et comportements rendent la proie difficile à attaquer (les papillons-lunes présentent des queues sur les ailes postérieures qui interfèrent avec le système de détection des chauves souris (10)) ou peu attractive (de nombreux insectes réalisent une thanatose c’est-à-dire faire le mort (figure 1).
Encart : Mentionnons quelques bénéfices de la stratégie de groupe. L’existence de comportements de vigilance permet de s’approvisionner plus efficacement, un ou plusieurs conspécifiques donnant l’alerte (many-eyes hypothesis). Le groupe dilue également le risque de capture (en perturbant le prédateur qui peine à trouver une cible, et en diminuant le risque d’être pris pour cible), et certains comportements collectifs rebutent le prédateur (shimmering waves chez certaines abeilles) (11).
B) Course-poursuite
Lorsque le prédateur lance une attaque, on parle de jeu différentiel. Quand toutes les barrières de défenses « primaires » décrites au dessus ont échoué, une réponse active « secondaire » de la proie est requise pour éviter d’être mangée. La détermination du « gagnant » dépend de composants variés : aspects sensoriels, performance locomotrice et trajectoires. On retrouve chez les insectes des circuits spécialisés, efficaces et rapides minimisant le délai de traitement et d’initiation de la réponse d’évasion (voir Partie II), et parfois des mécanismes biomécaniques puissants, comme les pattes arrière de certains Orthoptères.
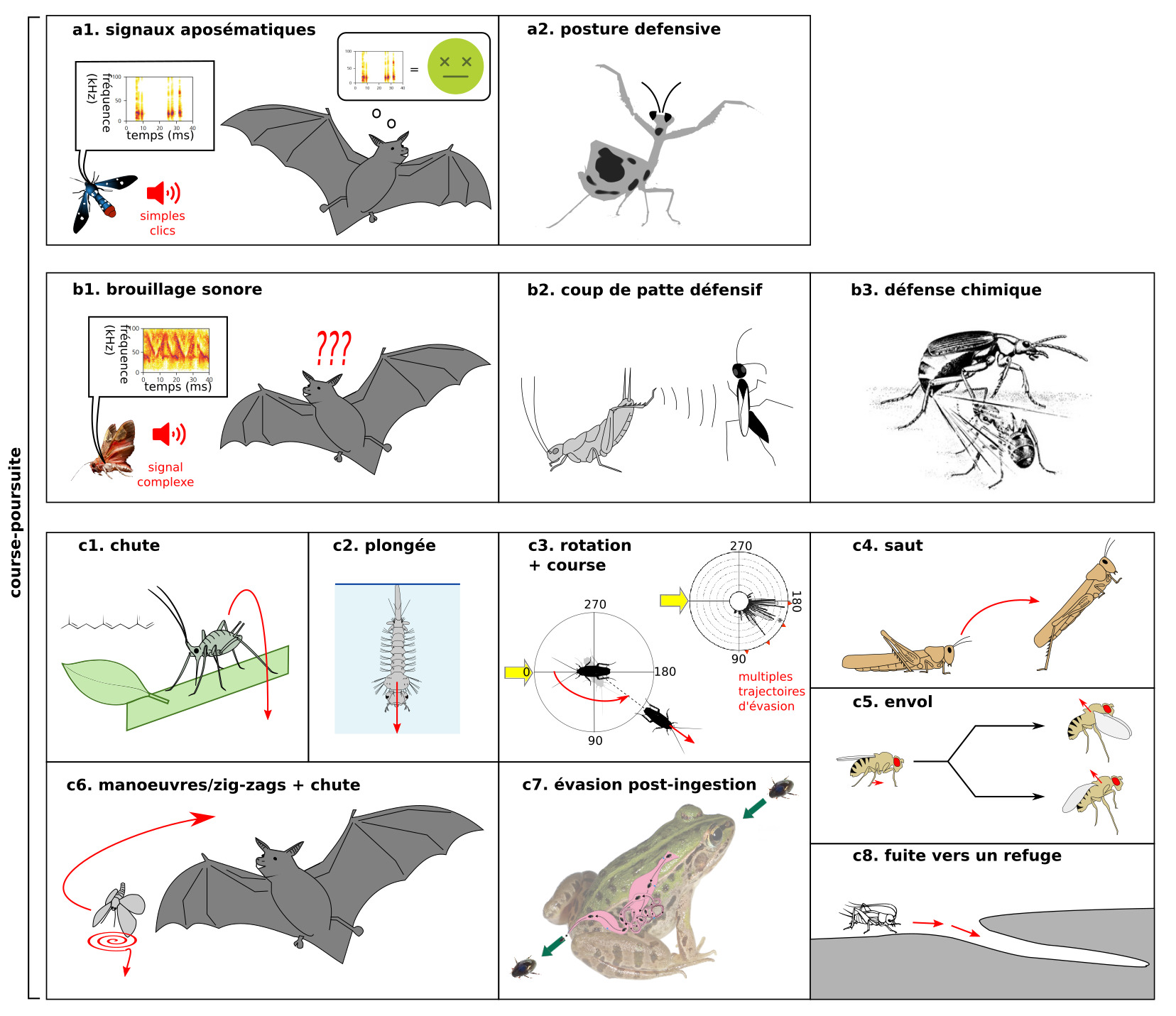
(b) Contre-attaque : (b1) Interférence avec le buzz terminal de la chauve souris par émission de signaux sonores chez le papillon B.trigona – (b2) coup de patte défensif chez le grillon Acheta face à une guêpe parasitoïde Liris. (b3) défense chimique chez le bombardier Brachinus sp. (source inconnue)
(c) Fuite : (c1) chute du puceron en réponse à la phéromone d’alarme – (c2) plongée d’une larve de moustique – (c3) rotation du corps et course chez la blatte Periplaneta en réponse à un prédateur (indiqué par la flèche jaune). La blatte tourne selon un angle choisi aléatoirement parmi plusieurs directions possibles (indiquées par des triangles rouges) dans un même secteur angulaire. Adapté de (12) (c4) saut chez le criquet – (c5) envol chez la Drosophile avec ou sans élévation des ailes, en fonction de l’urgence – (c6) Manœuvres ou chute chez un insecte nocturne volant en réponse aux cris d’une chauve-souris – (c7) évasion post-ingestion chez le coléoptère R. attenuata. D’après Shinji Sugiura, Kobe University – (c8) fuite vers un terrier chez le grillon des champs (Source : P. Clémençon)
B.1) Diversité du répertoire comportemental pour échapper aux prédateurs
Durant la phase de subjugation (figure 1), les réponses d’évasion sont variées (13).
Certains insectes émettent des signaux ou réalisent des comportements pour étourdir le prédateur. Plusieurs espèces de grillons et de blattes utilisent l’« attaque » et se défendent des guêpes parasitoïdes en donnant des coups de pattes puissants (14) (figure 3b2). Certains insectes produisent une substance lorsqu’ils sont attaqués : les pucerons produisent une substance collante qui aveugle les coccinelles, et les bombardiers libèrent une substance brûlante (figure 3b2). Si plusieurs papillons de nuit émettent de simples clics aposématiques comme décrit précédemment (15) (figure 3a1), les noctuelles Bertholdia trigona produisent des signaux plus complexes qui couvrent une large gamme de fréquences et perturbent l’écholocation des chauve-souris (brouillage sonore ou sonar jamming), le timing de l’écho retour étant crucial pour détecter avec précision la position d’un objet dans l’espace (16). Les chauves-souris manquent les papillons B. trigona de 15-20 cm (figure 3b1).
D’autres insectes font de l’autotomie (perte volontaire d’un membre) (17) ou présentent une fausse tête, perturbant le prédateur, ce qui donne quelques millisecondes cruciales à la proie pour s’échapper.
Enfin, de nombreuses proies réalisent une réponse de fuite, c’est-à-dire un déplacement pour sortir de la « zone de danger», en sortant du champ de détection du prédateur par des manœuvres diverses (Partie B.2) : chute vers le sol (figure 3c1), plongée en spirale (figure 3c2), course (figure 3c3), rotation du corps suivi d’un mouvement de translation comme le saut (figure 3c4), vol (figures 3c5 & c6), nage dans le tube digestif (figure 3c7). La présence de refuges influence l’évasion (figure 3c8).

Il faut noter que les réponses d’évasion ne sont pas fixes, comme illustré sur la figure 4. Le comportement d’envol d’une drosophile peut être décomposé en plusieurs sous-comportements (ajustements posturaux, élévation des ailes, saut) qui peuvent être interrompus ou sautés en fonction de la nature de la menace. De même, chez le criquet, la flexion initiale ne s’ensuit pas toujours de l’étape de co-contraction, et cette étape ne s’ensuit pas toujours d’un saut (on parle de réponse abortive).
B.2) Les trajectoires d’évasion, un mélange entre optimum géométrique, imprédictibilité et recherche de refuges
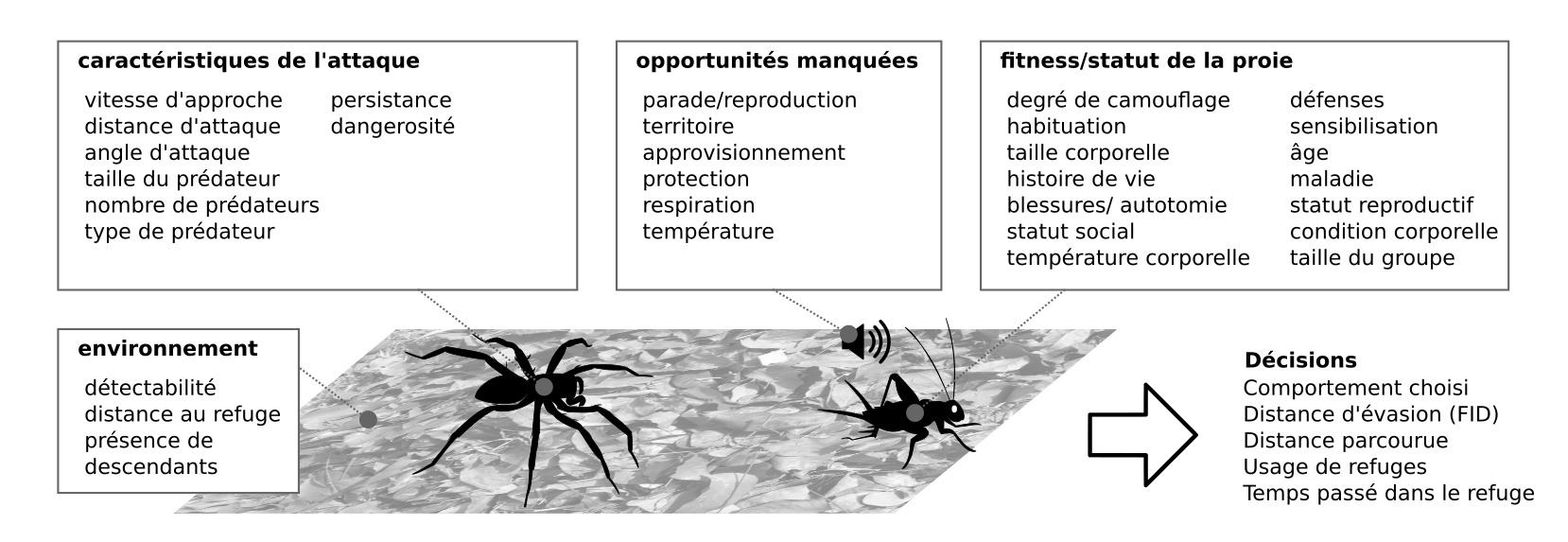
Plusieurs paramètres géométriques sont couramment utilisés pour caractériser les trajectoires d’évasion : l’angle de rotation initial du corps, la sinuosité de la trajectoire, la distance totale parcourue (Distance Fled), ou encore le timing (FID pour Flight Initiation Distance). De nombreux modèles géométriques permettent de prédire les trajectoires et le timing en fonction de différents paramètres.
Le ratio entre la vitesse du prédateur et celle de la proie (18), ou celui entre les distances d’attaques et de fuite (19) ont souvent été décrits comme des paramètres clés dans la compréhension des interactions proies-prédateurs.
Dans certains cas, une action locomotrice (un saut, un cycle de marche) suffit. Par exemple, dans la litière de feuilles, lorsqu’une araignée Pardosa attaque un grillon des bois Nemobius, celui-ci peut réaliser un saut puissant qui l’éloigne parfois à plusieurs dizaines de centimètres de l’araignée, et sort de la zone de danger (pour l’araignée, les indices sensoriels indiquant la position du grillon dans l’environnement ne sont alors plus suffisants pour lancer une attaque) (20).
Vidéo d’une attaque d’araignée Pardosa sur un grillon des bois Nemobius (ralentie environ 300 fois)
A l’inverse, dans le cas où une chauve-souris poursuit un papillon de nuit, le ratio des vitesses est en faveur du prédateur (21). Les trajectoires de fuite résultant en une évasion réussie sont souvent caractérisées par une forte accélération angulaire, la présence de zigzaging, ou l’exécution de plongeons d’évasion en spirales imprédictibles qui rend leur tracking sensoriel plus difficile pour les chauve-souris (figure 3c5).
Vitesse et manœuvres sont des déterminants du succès de l’évasion
La persistance du prédateur influence fortement le comportement de fuite. Chez les criquets ou les larves de moustiques, la distance parcourue augmente lors d’attaques répétées. L’angle de fuite est caractérisé par un mélange entre optimum géométrique et imprédictibilité. On constate intuitivement l’angle de fuite qui maximise la distance au prédateur est généralement de 180°. Certains écarts ont été interprétés comme étant la conséquence de bruit dans la perception et dans la réponse motrice, ou encore de contraintes locomotrices.
Les punaises Triatoma (Reduviidae), par exemple, fuient à un angle de 120°, interprété comme un angle maximisant la distance au prédateur tout en gardant sa position dans le champ visuel (22). D’autres insectes fuient assez clairement dans des directions aléatoires, imprédictibles, une stratégie limitant l’apprentissage chez les prédateurs, en particulier dans le cas d’attaques persistantes. L’imprédictibilité souligne la flexibilité des réponses d’évasion, qui sont plus complexes que de simples boucles réflexes comme cela a été décrit dans le passé.
Choisir un angle totalement aléatoire (comportement protéen) présente des limites, la proie pouvant foncer vers le prédateur. Chez les blattes, des études ont mis en évidence la présence de plusieurs directions préférées dans un même secteur angulaire, choisies aléatoirement, qui ne sont néanmoins pas dirigées vers le prédateur (angles de 90° – 270°) (12).
Ainsi, l’imprédicitibilité (randomness) est aussi un déterminant du succès de l’évasion, en limitant l’apprentissage.
Enfin, des expériences ont souligné l’orientation de certaines trajectoires vers des refuges. De nombreux insectes sur les parties aériennes des végétaux se laissent simplement tomber au sol lorsqu’un prédateur approche. L’un des exemples les plus célèbres est celui des pucerons qui se laissent tomber sur le sol lorsqu’il sentent l’haleine d’un herbivore, ou lorsqu’il perçoivent la phéromone d’alarme émise par un conspécifique, le β-farnesène (figure 3c1). Certains insectes construisent un refuge, comme les grillons des champs, et s’y cachent lorsqu’un prédateur s’approche de trop près pendant une durée qui dépasse généralement la patience du prédateur (23). D’autres insectes fuient vers une cachette de proximité comme la végétation ou une pierre. L’entrée dans un refuge n’est pas sans coûts en terme de fitness. Les larves et pupes de moustiques quittent la surface pour fuir la prédation en surface, mais leurs réserves d’oxygène diminuent (24).
Ainsi, la connaissance de routes ou la présence de refuges influencent la trajectoire, même si les refuges ne sont pas sans coûts.
Pour conclure, rappelons que les réponses d’évasion ne sont pas de simples boucles réflexes. Elles dépendent également de nombreux facteurs internes et externes comme l’âge, l’expérience, la taille corporelle, la température ou encore le comportement en cours.
Les décisions prises lors de l’évasions sont le résultat d’une évaluation des coûts/bénéfices (figure 4) (25). Par exemple, un papillon de nuit mâle très proche d’une femelle ne s’enfuit que lorsqu’une chauve-souris est sur le point d’attaquer (buzz terminal). Au contraire, ce même papillon de nuit loin d’une femelle réalise des réponses d’évasion dès que le prédateur est détecté, lors de la phase d’approche (26).
|
Le point de vue du prédateur Il existe un gradient de stratégies chez les prédateurs à différentes échelles. Pour la rencontre proie-prédateur, d’un côté du spectre se trouvent les prédateurs sit-and-wait, qui attendent qu’une proie passe à proximité comme les chenilles carnivores, certaines libellules restent immobiles sur une perche (lien), un point d’observation. Certains construisent des pièges comme larves de fourmillons, ou les toiles. D’autres produisent des signaux trompeurs pour attirer la proie jusqu’à eux (araignée Bolas, guêpes sur toile,…). De l’autre côté du spectre se trouvent les prédateurs cruising (27) qui parcourent activement des distances jusqu’à trouver une proie, comme certaines coccinelles. La recherche de proies commence souvent par la détection d’indices à longue portée (CO2, …). Une fois la proie détectée, les prédateurs sit-and-wait attendent le dernier moment pour attaquer (la distance entre la proie et le prédateur est très petite, et le temps de réaction de la proie est souvent supérieur à la durée de l’interaction). Certains prédateurs, comme les mantes religieuses réalisent une embuscade lente avant l’assaut final rapide. D’autres prédateurs initient, une fois la proie détectée, une course-poursuite effrénée. Les cicindèles, asilides et libellules sont connus pour leur capacité à traquer leur proie à grande vitesse. On distingue deux stratégies de poursuite, le suivi, ou tracking, et la navigation parallèle qui consiste à viser un point fictif où la proie se retrouvera à un instant t+1 (lien) (28). Bien entendu, certains prédateurs utilisent diverses stratégies en fonction de facteurs internes et externes. La distance d’attaque des mantes religieuses Tenodera dépend du niveau de satiété : une mante affamée va parcourir de grandes distances pour se rapprocher de la proie, alors qu’une mante repue adopte des comportements plus opportunistes, n’attaquant que les proies à faible portée (29). Tout comme la proie, le succès du prédateur repose sur des systèmes sensoriels efficaces mais aussi des biomécaniques puissants et précis, notamment des systèmes de catapulte. L’exemple le plus frappant est celui de la larve de libellule, qui a inspiré le film Alien, un système rapide et précis (lien). |
Ne manquez pas la seconde partie de cet article sur les aspects plus neuroéthologiques de l’évasion ! Partie II
|
Bibliographie
- G. M. Card (2012) : Escape behaviors in insects. Curr. Opin. Neurobiol. 22, 180–186 (lien)
- S. Alpern & S. Gal (2006) : The Theory of Search Games and Rendezvous (Springer Science & Business Media, 2006) (lien)
- J. Fabre : Souvenirs entomologiques: Etudes sur l’instinct et les murs des insectes, vol. 4 (1891)
- J. A. Endler : “Interactions between predator and prey” in Krebs, J.R. and Davies, N., Behavioural Ecology, Blackwell Scientific Publications, pp. 169–196
- W. J. Boeing : “Defensive Avoidance” in Encyclopedia of Animal Behavior, M. D. Breed, J. Moore, Eds. (Academic Press, 2010), pp. 476–480
- R. Kortet & A. Hedrick (2004) : Detection of the Spider Predator, Hololena nedra by Naïve Juvenile Field Crickets (Gryllus integer) Using Indirect Cues. Behaviour 141, 1189–1196 (lien)
- A. V. Hedrick (2000) : Crickets with extravagant mating songs compensate for predation risk with extra caution. Proc. R. Soc. Lond. B Biol. Sci. 267, 671–675 (lien)
- M. Broom (2013) : “Interactions Between Searching Predators and Hidden Prey” in Search Theory: A Game Theoretic Perspective, S. Alpern, R. Fokkink, L. Gąsieniec, R. Lindelauf, V. S. Subrahmanian, Eds. (Springer, 2013), pp. 233–248
- G. D. Ruxton ; W. L. Allen ; T. N. Sherratt & M. P. Speed (2023) : Avoiding Attack: The Evolutionary Ecology of Crypsis, Aposematism, and Mimicry (Oxford University Press, 2018) https:/doi.org/10.1093/oso/9780199688678.001.0001
- J. R. Barber, et al. (2015) : Moth tails divert bat attack: Evolution of acoustic deflection. Proc. Natl. Acad. Sci. 112, 2812–2816 (lien)
- G. Kastberger ; F. Weihmann & T. Hoetzl (2010) : Complex social waves of giant honeybees provoked by a dummy wasp support the special-agent hypothesis. Commun. Integr. Biol. 3, 179–180 (lien)
- P. Domenici ; J. M. Blagburn & J. P. Bacon (2011) : Animal escapology I: theoretical issues and emerging trends in escape trajectories. J. Exp. Biol. 214, 2463–2473 (lien)
- P. W. Bateman & P. A. Fleming (1990) : “Invertebrates” in, pp. 177–196
- R. Hustert & W. Gnatzy (1995) : The Motor Program for Defensive Kicking in Crickets: Performance and Neural Control. J. Exp. Biol. 198, 1275–1283 (lien)
- A. J. Corcoran ; J. R. Barber ; N. I. Hristov & W. E. Conner (2011) : How do tiger moths jam bat sonar? J. Exp. Biol. 214, 2416–2425 (lien)
- A. J. Corcoran & W. E. Conner (2012) : Sonar jamming in the field: effectiveness and behavior of a unique prey defense. J. Exp. Biol. 215, 4278–4287 (lien)
- P. A. Fleming ; D. Muller & P. W. Bateman (2007) : Leave it all behind: a taxonomic perspective of autotomy in invertebrates. Biol. Rev. 82, 481–510 (lien)
- P. Domenici & G. D. Ruxton (2015) : “Prey behaviors during fleeing: escape trajectories, signaling, and sensory defenses” in Escaping From Predators: An Integrative View of Escape Decisions, D. T. Blumstein, J. Cooper William E., Eds. (Cambridge University Press, 2015), pp. 199–224
- J. Casas & T. Steinmann (2014) : Predator-induced flow disturbances alert prey, from the onset of an attack. Proc. R. Soc. B Biol. Sci. 281, 20141083 (lien)
- S. Morice ; S. Pincebourde ; F. Darboux ; W. Kaiser & J. Casas (2013) : Predator-prey pursuit-evasion games in structurally complex environments. Integr. Comp. Biol. 53, 767–779 (lien)
- A. J. Corcoran & W. E. Conner (2016) : How moths escape bats: predicting outcomes of predator–prey interactions. J. Exp. Biol. 219, 2704–2715 (lien)
- C. Lazzari & D. Varjú (1990) : Visual lateral fixation and tracking in the haematophagous bug Triatoma infestans. J. Comp. Physiol. A 167, 527–531 (lien)
- D. M. Hugie (2003) : The waiting game: a “battle of waits” between predator and prey. Behav. Ecol. 14, 807–817 (lien)
- I. Rodríguez-Prieto ; E. Fernández-Juricic & J. Martín (2006) : Anti-Predator Behavioral Responses of Mosquito Pupae to Aerial Predation Risk. J. Insect Behav. 19, 373–381 (lien)
- R. C. Ydenberg & L. M. Dill (1986) : “The Economics of Fleeing from Predators” in Advances in the Study of Behavior, (Elsevier, 1986), pp. 229–249.
- N. Skals ; P. Anderson ; M. Kanneworff ; C. Löfstedt & A. Surlykke (2005) : Her odours make him deaf: crossmodal modulation of olfaction and hearing in a male moth. J. Exp. Biol. 208, 595–601 (lien)
- N. Zoroa ; M. J. Fernández-Sáez & P. Zoroa (2011) : A foraging problem: Sit-and-wait versus active predation. Eur. J. Oper. Res. 208, 131–141 (lien)
- S. T. Fabian ; M. E. Sumner ; T. J. Wardill ; S. Rossoni & P. T. Gonzalez-Bellido (2018) : Interception by two predatory fly species is explained by a proportional navigation feedback controller. J. R. Soc. Interface 15, 20180466 (lien)
- S. C. Pickard, et al. (2021) : Internal state effects on behavioral shifts in freely behaving praying mantises (Tenodera sinensis). PLOS Comput. Biol. 17, e1009618 (lien)

 Paul Clémençon
Paul Clémençon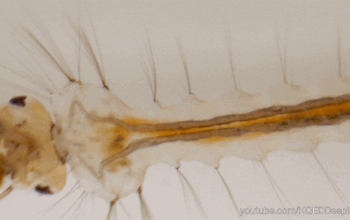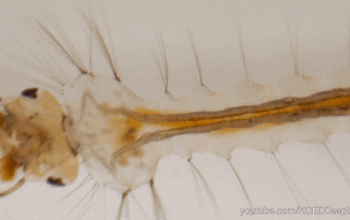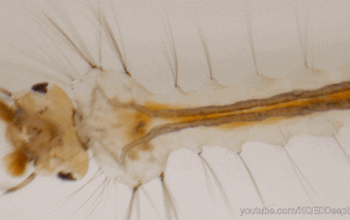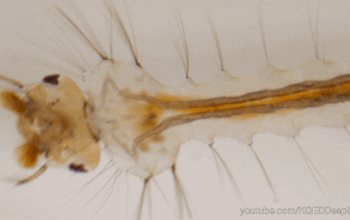

J’ai déjà exprimé mon admiration pour vos articles sur un précédent dont le contenu a été zappé lors de l’envoie. je serai donc bref: bravo